


所属成套资源:2022年高考化学专练【热点·重点·难点】
重点4 无机化工流程分析- 高考化学专练【热点·重点·难点】
展开
这是一份重点4 无机化工流程分析- 高考化学专练【热点·重点·难点】,文件包含重点4无机化工流程分析-高考化学专练热点·重点·难点解析版doc、重点4无机化工流程分析-高考化学专练热点·重点·难点原卷版doc等2份试卷配套教学资源,其中试卷共15页, 欢迎下载使用。
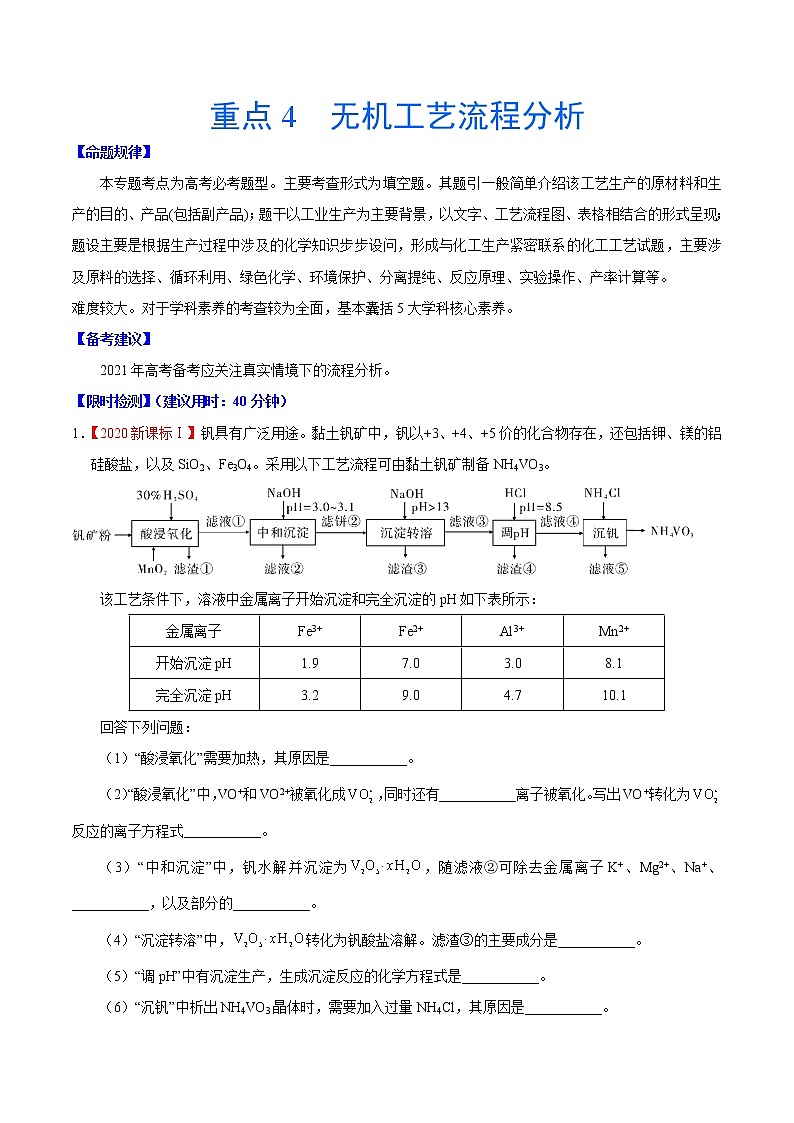
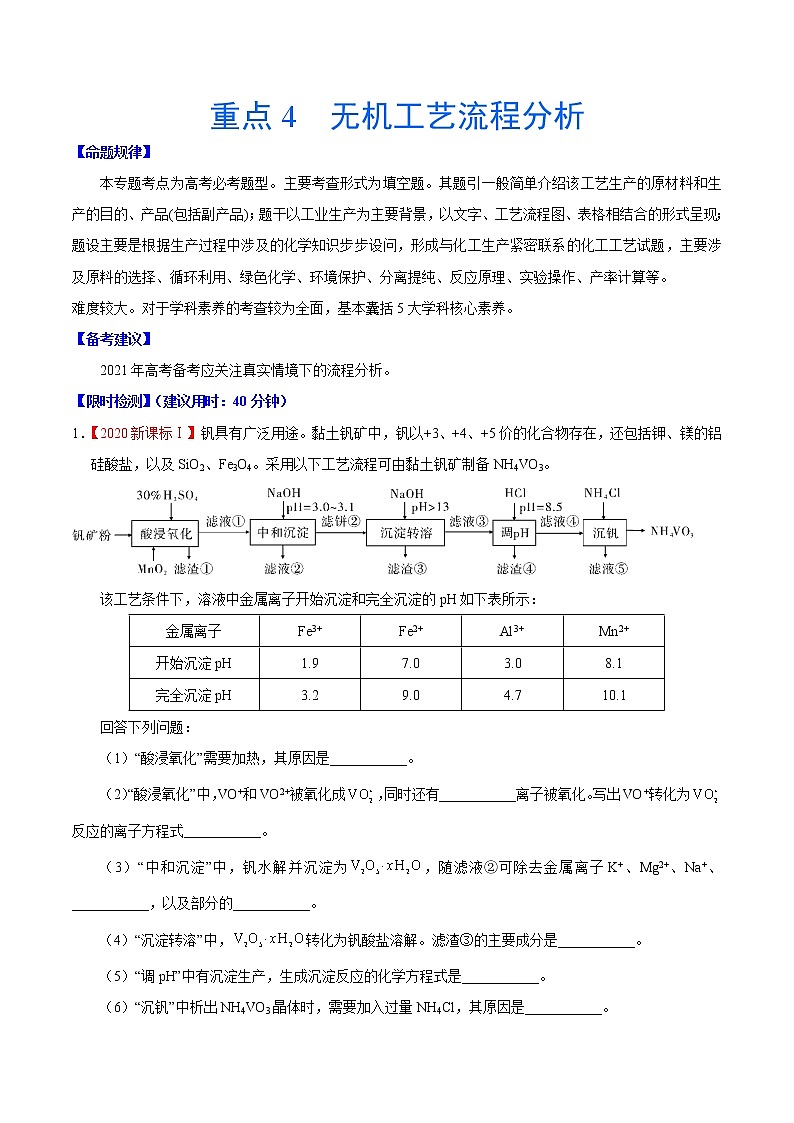
重点4 无机工艺流程分析【命题规律】本专题考点为高考必考题型。主要考查形式为填空题。其题引一般简单介绍该工艺生产的原材料和生产的目的、产品(包括副产品);题干以工业生产为主要背景,以文字、工艺流程图、表格相结合的形式呈现;题设主要是根据生产过程中涉及的化学知识步步设问,形成与化工生产紧密联系的化工工艺试题,主要涉及原料的选择、循环利用、绿色化学、环境保护、分离提纯、反应原理、实验操作、产率计算等。难度较大。对于学科素养的考查较为全面,基本囊括5大学科核心素养。【备考建议】2021年高考备考应关注真实情境下的流程分析。【限时检测】(建议用时:40分钟)1.【2020新课标Ⅰ】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:金属离子Fe3+Fe2+Al3+Mn2+开始沉淀pH1.97.03.08.1完全沉淀pH3.29.04.710.1回答下列问题:(1)“酸浸氧化”需要加热,其原因是___________。(2)“酸浸氧化”中,VO+和VO2+被氧化成,同时还有___________离子被氧化。写出VO+转化为反应的离子方程式___________。(3)“中和沉淀”中,钒水解并沉淀为,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。(4)“沉淀转溶”中,转化为钒酸盐溶解。滤渣③的主要成分是___________。(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________。(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________。【答案】(1)加快酸浸和氧化反应速率(促进氧化完全)(2)Fe2+ VO++MnO2 +2H+ =+Mn2++H2O(3)Mn2+ Al3+和Fe3+(4)Fe(OH)3(5)NaAl(OH)4+ HCl= Al(OH)3↓+NaCl+H2O(6)利用同离子效应,促进NH4VO3尽可能析出完全【解析】【分析】黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4,用30%H2SO4和MnO2“酸浸氧化”时VO+和VO2+被氧化成,Fe3O4与硫酸反应生成的Fe2+被氧化成Fe3+,SiO2此过程中不反应,滤液①中含有、K+、Mg2+、Al3+、Fe3+、Mn2+、;滤液①中加入NaOH调节pH=3.0~3.1,钒水解并沉淀为V2O5·xH2O,根据表中提供的溶液中金属离子开始沉淀和完全沉淀的pH,此过程中Fe3+部分转化为Fe(OH)3沉淀,部分Al3+转化为Al(OH)3沉淀,滤液②中含有K+、Na+、Mg2+、Al3+、Fe3+、Mn2+、,滤饼②中含V2O5·xH2O、Fe(OH)3、Al(OH)3,滤饼②中加入NaOH使pH>13,V2O5·xH2O转化为钒酸盐溶解,Al(OH)3转化为NaAlO2,则滤渣③的主要成分为Fe(OH)3;滤液③中含钒酸盐、偏铝酸钠,加入HCl调pH=8.5,NaAlO2转化为Al(OH)3沉淀而除去;最后向滤液④中加入NH4Cl“沉钒”得到NH4VO3。【详解】(1)“酸浸氧化”需要加热,其原因是:升高温度,加快酸浸和氧化反应速率(促进氧化完全),故答案为:加快酸浸和氧化反应速率(促进氧化完全);(2)“酸浸氧化”中,钒矿粉中的Fe3O4与硫酸反应生成FeSO4、Fe2(SO4)3和水,MnO2具有氧化性,Fe2+具有还原性,则VO+和VO2+被氧化成的同时还有Fe2+被氧化,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;VO+转化为时,钒元素的化合价由+3价升至+5价,1molVO+失去2mol电子,MnO2被还原为Mn2+,Mn元素的化合价由+4价降至+2价,1molMnO2得到2mol电子,根据得失电子守恒、原子守恒和电荷守恒,VO+转化为反应的离子方程式为VO++MnO2+2H+=+Mn2++H2O,故答案为:Fe2+,VO++MnO2+2H+=+Mn2++H2O;(3)根据分析,“中和沉淀”中,钒水解并沉淀为V2O5·xH2O,随滤液②可除去金属离子K+、Mg2+、Na+、Mn2+,以及部分的Fe3+、Al3+,故答案为:Mn2+,Fe3+、Al3+;(4)根据分析,滤渣③的主要成分是Fe(OH)3,故答案为:Fe(OH)3;(5)“调pH”中有沉淀生成,是NaAlO2与HCl反应生成Al(OH)3沉淀,生成沉淀反应的化学方程式是NaAlO2+HCl+H2O=NaCl+Al(OH)3↓或Na[Al(OH)4]+HCl= NaCl+Al(OH)3↓+H2O,故答案为:NaAlO2+HCl+H2O=NaCl+Al(OH)3↓或Na[Al(OH)4]+HCl= NaCl+Al(OH)3↓+H2O。(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是:增大NH4+离子浓度,利用同离子效应,促进NH4VO3尽可能析出完全,故答案为:利用同离子效应,促进NH4VO3尽可能析出完全。2.【福建省莆田市2021届高三毕业班第一次教学质量检测】是染料工业中常用的还原剂,难溶于乙醇,受热易分解。某研究小组对的性质与制备方法进行了研究。Ⅰ.锌粉法制备。(1)的制备过程要在无氧条件下进行,其原因是___________;为了增大的吸收效率,可采取的措施有___________(任写一点)。(2)步骤②需要控制温度在,可能的原因是___________。(3)步骤③中加入一定量固体的目的是___________。Ⅱ.对性质的探究。(4)常温下,的溶液的约为8,露置在空气中,溶液的逐渐减小至5,再经过一段时间,溶液的减小至1,则溶液的从8逐渐减小至5的过程中,可能发生反应的化学方程式为___________,后来继续减小至1的原因是___________。(5) 固体在隔绝空气的条件下加热至时完全分解,生成、、,检验产物中是否含有的实验方法是___________。【答案】具有强还原性,容易被氧气氧化 增大与悬浊液的接触面积(或通入的导管末端连接一个多孔球泡或将缓慢通入悬浊液中等) 温度过高,容易分解;温度过低,反应速率太慢 增大溶液中,降低的溶解度,便于结晶析出 逐渐被氧化为,使溶液酸性增强 取少量固体溶于足量稀盐酸中,静置后向溶液中滴加氯化钡溶液,若有白色沉淀,则产物中含有硫酸钠 【详解】(1)由于中S的化合价为+3价,处于S的中间价位,所以该物质既有氧化性又有还原性,但中的S主要体现还原性,所以的制备过程要在无氧条件下进行,其原因为具有强还原性,容易被氧气氧化;增大的吸收效率的措施有:可以增大二氧化硫与悬浊液的接触面以及减缓二氧化硫的流速等,故答案为:具有强还原性,容易被氧气氧化;增大与悬浊液的接触面积(或通入的导管末端连接一个多孔球泡或将缓慢通入悬浊液中等);(2) 不稳定受热易分解,但温度过低化学反应速率太慢,所以步骤②需要控制温度在,可能的原因是:温度过高,容易分解;温度过低,反应速率太慢,故答案为:温度过高,容易分解;温度过低,反应速率太慢;(3) 属于钠盐,易溶于水,所以步骤③中加入一定量固体的目的是为了增大溶液中钠离子的浓度,减小的溶解,从而提高的产率,故答案为:增大溶液中,降低的溶解度,便于结晶析出;(4)由题意可知溶液被空气中的氧气氧化为,从而使溶液的pH由8降低至5,溶液会被空气中的氧气继续氧化为从而使溶液的pH值将到1,故答案为:;逐渐被氧化为,使溶液酸性增强;(5)能与氯化钡反应产生白色的固体,所以检验产物中是否含有的实验方法是:取少量固体溶于足量稀盐酸中,静置后向溶液中滴加氯化钡溶液,若有白色沉淀,则产物中含有硫酸钠,故答案为:取少量固体溶于足量稀盐酸中,静置后向溶液中滴加氯化钡溶液,若有白色沉淀,则产物中含有硫酸钠。3.【广东省肇庆市2021届高三毕业班第一次统一检测】我市某企业对高砷高锡铅阳极泥进行脱砷处理,分离出锡铅废渣的同时制备了砷酸钠晶体()。其工艺流程如下:已知:i.砷在高砷高锡铅阳极泥中以单质形式存在;ii.砷酸钠晶体有毒性;iii.“浸出液”呈碱性,其主要成分为和。请回答下列问题:(1)储存砷酸钠晶体时应张贴的危险品标志为__________(填选项字母)。A B C D(2)焙烧前需要将阳极泥与碳酸钠固体充分混合,其目的是_____________。(3)用控制变量法探究焙烧温度和焙烧时间对砷的浸出率影响如图,则应选择的最佳焙烧温度和时间分别为____________________。(4)“焙烧”时生成的化学方程式为_____________________。(5)“氧化”过程中若使用作氧化剂,则发生反应的离子方程式为______________。(6)“一系列操作”具体为________、_______、过滤﹑洗涤、干燥。(7)若的阳极泥(砷百分含量为)经过上述工艺流程最后制得晶体,则砷酸钠晶体的产率为______________%。(用含有、的式子表示,产率)【答案】C 增大反应物接触面积,加快反应速率,提高原料利用率 、 蒸发浓缩 冷却结晶 【分析】砷在阳极泥中以单质形式存在,“焙烧”时砷单质被氧气,“浸出液”呈碱性,其主要成分为和,再将被氧化为,氧化后溶液中含,要从溶液中提取晶体,则需结晶等 “一系列操作”,即可得到砷酸钠晶体;【详解】(1)是放射性标志,表示腐蚀品,表示有毒物质,表示易燃物质,砷酸钠有毒,故选C。(2)焙烧前需要将阳极泥与碳酸钠固体充分混合,目的就是增大反应物接触面积,加快反应速率,提高原料利用率。(3)由图可知“焙烧”时应选择的最佳焙烧温度和时间分别为、,其中时间选左右即可。(4)已知砷在高砷高锡铅阳极泥中以单质形式存在,“焙烧”时砷单质被氧化为,氧化剂为氧气,则化学方程式为。(5)已知“浸出液”呈碱性,其主要成分为和 , “氧化”过程中若采用作氧化剂,则被氧化为,发生反应的离子方程式为。(6)氧化后溶液中含,要从溶液中提取晶体,则需结晶,故 “一系列操作”具体为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。(7)阳极泥中砷百分含量为,按砷元素守恒,的阳极泥可制得砷酸钠晶体的理论产量为kg,故砷酸钠晶体的产率为。4.【河北省“五个一名校联盟”2021届高三上学期第一次诊断考试】氧锰八面体纳米棒(OMS-2)是一种新型的环保催化剂。用软锰矿和黄铁矿(主要成分分别为MnO2、FeS2)合成OMS-2的工艺流程如下:金属离子Fe3+Fe2+Mn2+开始沉淀的pH2.27.58.8完全沉淀的pH3.29.O10.8(1)“调pH值”步骤中,pH的调节范围是___________。(2)已知Fe3O4可改写成Fe2O3·FeO的形式,Mn12O19中氧元素化合价均为-2价,锰元素有Mn(Ⅲ)、Mn(Ⅳ)两种化合价,则Mn12O19可表示为___________。(3)生产过程中的原料KMnO4、K2S2O8、MnSO4·H2O按物质的量比1︰1︰5反应,产物中硫元素全部以的形式存在,该反应的离子方程式为___________。(4)甲醛(HCHO)在OMS-2催化氧化作用下生成CO2和H2O,现利用OMS-2对某密闭空间的甲醛进行催化氧化实验,实验开始时,该空间内甲醛含量为1.25 mg·L-1,CO2含量为0.5 0 mg·L-1,一段时间后测得CO2含量升高至1.30 mg·L-1,该实验中甲醛的转化率为___________(保留三位有效数字)。【答案】[3.2,8.8)(或3.2≤pH<8.8) 5Mn2O3·2MnO2 43.6% 【分析】软锰矿和黄铁矿用硫酸酸浸,得到的淡黄色固体为S,在酸浸过程中,FeS2中硫的化合价升高,所以Mn的化合价降低,过滤后溶液A中含有Mn2+和Fe2+,向溶液A中加入H2O2,把Fe2+氧化为Fe3+,调节溶液的pH,除去Fe3+后的滤液精制得到MnSO4▪H2O,加入酸性KMnO4溶液和K2S2O8,生成Mn12O19,最后焙烧Mn12O19得到OMS-2。【详解】(1)调pH的目的是除去Fe3+,根据表格中的数据,使Fe3+沉淀完全,而Mn2+不能沉淀,故pH的范围是3.2≤pH<8.8。(2)锰元素有Mn(Ⅲ)、Mn(Ⅳ)两种化合价,把Mn12O19表示为aMn2O3▪bMnO2,则有2a+b=12,3a+2b=19,可得a=5,b=2,所以Mn12O19可表示为5Mn2O3▪2MnO2。(3)生产过程中的原料KMnO4、K2S2O8、MnSO4▪H2O按物质的量比1:1:5反应,产物中硫元素全部以的形式存在,Mn全部转化为Mn12O19,根据质量守恒和电荷守恒,可写出反应的化学方程式为2 +2+10Mn2++11H2O=Mn12O19↓+4 +22H+。(4)CO2含量为0.50 mg·L-1,一段时间后测得CO2含量升高至1.30 mg·L-1,则生成的CO2为0.80mg·L-1,设容器体积为1L,根据甲醛氧化的方程式:HCHO+O2CO2+H2O,可求得转化的甲醛的质量为 =mg,则甲醛的转化率为×100%=43.6%。5.【四川省乐山市2021届高三12月第一次调研考试】硝酸铜晶体[Cu(NO3)2·6H2O],是一种重要的化工原料,常用于农药、镀铜、搪瓷等工业。以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备硝酸铜晶体的某工艺如图所示:回答下列问题:(1)“浸取”时,为了提高浸取率可采取的措施有______ (任写一点),浸取时在生成S的反应中还原剂与氧化剂的物质的量之比为______。(2)薄层层析法是利用溶液各成分对同一吸附剂吸附能力不同,在溶液流过吸附剂时,使各成分互相分离的方法。某实验小组利用薄层层析法监控滤液1加入铁粉过程中溶液的组成,实验结果如下,则还需继续加入Fe粉的是______ (选填编号)。 (3)滤渣2的主要成分是______,滤渣2与稀硝酸反应时,需向装置内通入适量空气,这样做的目的是______。(4)调节溶液pH时选用的物质a可以是______,几种金属离子沉淀的pH范围如图所示,“调pH”时应将溶液pH调至______~______。(5)操作X主要包括______、______、过滤、洗涤、干燥。【答案】粉碎辉铜矿、适当提高温度、不断的搅拌(三个任写一个或其他正确均可) 1:4 AC Cu 将生成的NO、NO2氧化为硝酸,提高硝酸利用率,可以减少污染气体NO、NO2的产生 CuO、Cu(OH)2、Cu2(OH)2CO3(任写一个或其他正确答案均可) 3.2 4.7 蒸发浓缩 冷却结晶 【分析】辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)加入氯化铁和稀硫酸,反应生成硫单质、亚铁离子、铜离子,二氧化硅不反应,过滤得到滤渣为S和SiO2,向滤液中加入适当过量的Fe,充分反应,过滤,滤液主要是亚铁离子,滤渣主要成份是铜单质,还有少量的铁单质,向滤渣中加入稀硝酸,再充入过量的空气,将生成的氮氧化物转化为硝酸,再向溶液中加入氧化铜等物质调节溶液pH值促进铁离子水解,再过滤,将滤液经过一系列过程得到硝酸铜晶体[Cu(NO3)2·6H2O]。【详解】(1)“浸取”时,为了提高浸取率可采取的措施有粉碎辉铜矿、适当提高温度、不断的搅拌等,浸取时生成S发生的反应为Cu2S+4Fe3+=4Fe2++2Cu2++S↓,还原剂为Cu2S,氧化剂为Fe3+,还原剂与氧化剂的物质的量之比为1:4;故答案为:粉碎辉铜矿、适当提高温度、不断的搅拌;1:4。(2)根据题意加入铁粉后,若Fe3+、Cu2+反应完全,则薄层色谱中只会出现一个点,即Fe2+,根据图谱可以看出B中只有Fe2+,而AC中还有Fe3+或Cu2+,因此还需继续加入Fe粉的是AC;故答案为:AC。(3)由于前面加入了适当过量的铁粉,铁置换出铜,因此滤渣2的主要成分是Cu,还有少量的Fe,滤渣2与稀硝酸反应时,金属与硝酸反应生成NO、NO2,向装置内通入适量空气,可以将生成的NO、NO2氧化为硝酸,提高硝酸利用率,可以减少污染气体NO、NO2的产生;故答案:将生成的NO、NO2氧化为硝酸,提高硝酸利用率,可以减少污染气体NO、NO2的产生。(4)调节溶液pH时,主要利用加入的物质消耗铁离子水解生成的氢离子,使其水解程度增大而转化为沉淀,为防止引入新的杂质,物质a可以是CuO或Cu(OH)2或Cu2(OH)2CO3;“调pH”时应将溶液中铁离子全部沉淀,而铜离子不能沉淀,因此要将溶液pH调至3.2~4.7;故答案为:CuO、Cu(OH)2、Cu2(OH)2CO3(任写一个或其他正确答案均可);3.2;4.7。(5)从溶液得到晶体,一般的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;故答案为:蒸发浓缩;冷却结晶。
相关试卷
这是一份热点03 微型工艺流程-2024年高考化学【热点·重点·难点】专练(新高考专用),文件包含热点03微型工艺流程-2024年高考化学热点·重点·难点专练新高考专用原卷版docx、热点03微型工艺流程-2024年高考化学热点·重点·难点专练新高考专用解析版docx等2份试卷配套教学资源,其中试卷共37页, 欢迎下载使用。
这是一份重点3 化学用语- 高考化学专练【热点·重点·难点】,文件包含重点3化学用语-高考化学专练热点·重点·难点解析版doc、重点3化学用语-高考化学专练热点·重点·难点原卷版doc等2份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。
这是一份热点10 新信息反应机理分析- 高考化学专练【热点·重点·难点】,文件包含热点10新信息反应机理分析-高考化学专练热点·重点·难点解析版doc、热点10新信息反应机理分析-高考化学专练热点·重点·难点原卷版doc等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。









