


所属成套资源:2022年高考化学专练【热点·重点·难点】
重点6 制备型实验综合题- 高考化学专练【热点·重点·难点】
展开
这是一份重点6 制备型实验综合题- 高考化学专练【热点·重点·难点】,文件包含重点6制备型实验综合题-高考化学专练热点·重点·难点解析版doc、重点6制备型实验综合题-高考化学专练热点·重点·难点原卷版doc等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
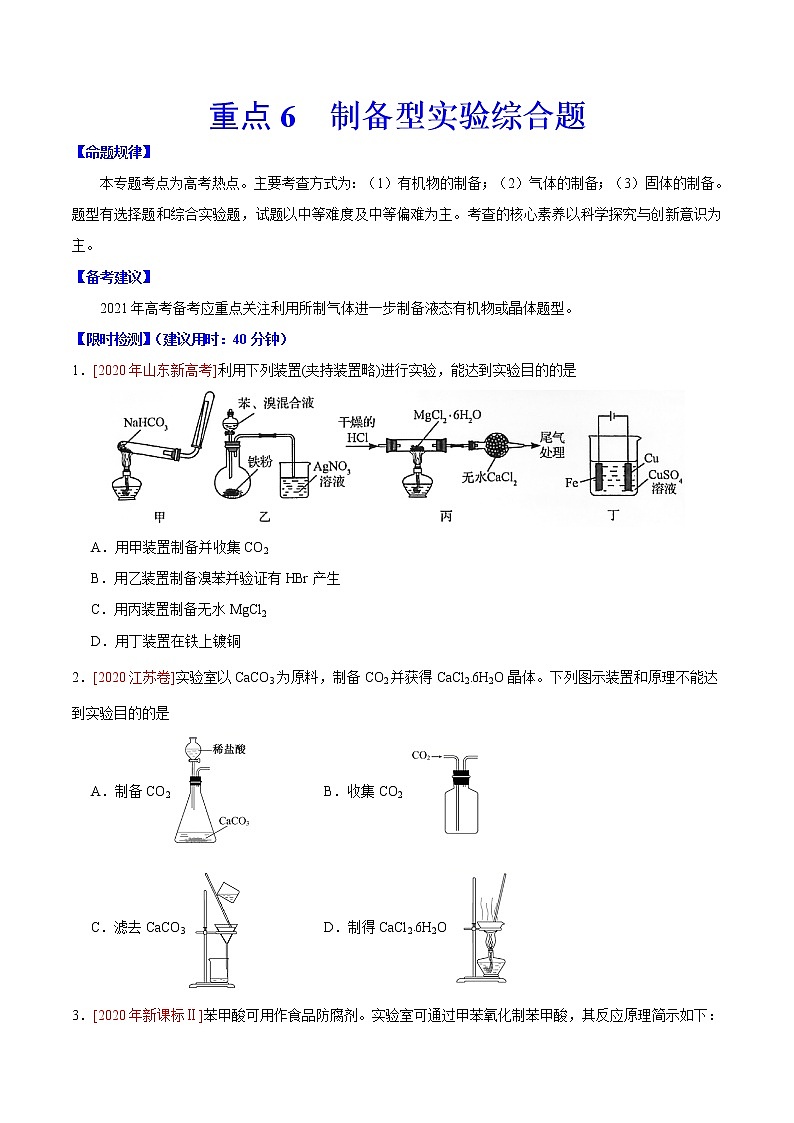
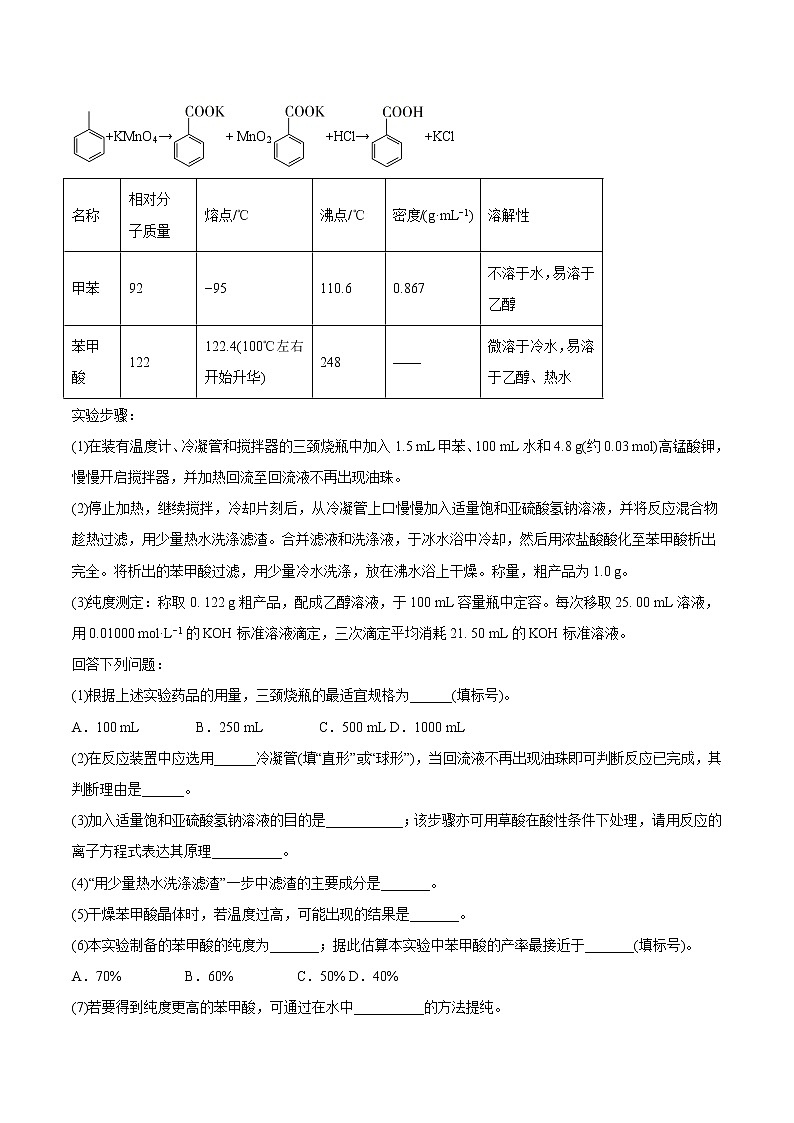
重点6 制备型实验综合题【命题规律】本专题考点为高考热点。主要考查方式为:(1)有机物的制备;(2)气体的制备;(3)固体的制备。题型有选择题和综合实验题,试题以中等难度及中等偏难为主。考查的核心素养以科学探究与创新意识为主。【备考建议】2021年高考备考应重点关注利用所制气体进一步制备液态有机物或晶体题型。【限时检测】(建议用时:40分钟)1.[2020年山东新高考]利用下列装置(夹持装置略)进行实验,能达到实验目的的是A.用甲装置制备并收集CO2B.用乙装置制备溴苯并验证有HBr产生C.用丙装置制备无水MgCl2D.用丁装置在铁上镀铜2.[2020江苏卷]实验室以CaCO3为原料,制备CO2并获得CaCl2﹒6H2O晶体。下列图示装置和原理不能达到实验目的的是A.制备CO2 B.收集CO2C.滤去CaCO3 D.制得CaCl2﹒6H2O3.[2020年新课标Ⅱ]苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:+KMnO4→+ MnO2+HCl→+KCl名称相对分子质量熔点/℃沸点/℃密度/(g·mL−1)溶解性甲苯92−95110.60.867不溶于水,易溶于乙醇苯甲酸122122.4(100℃左右开始升华)248——微溶于冷水,易溶于乙醇、热水实验步骤:
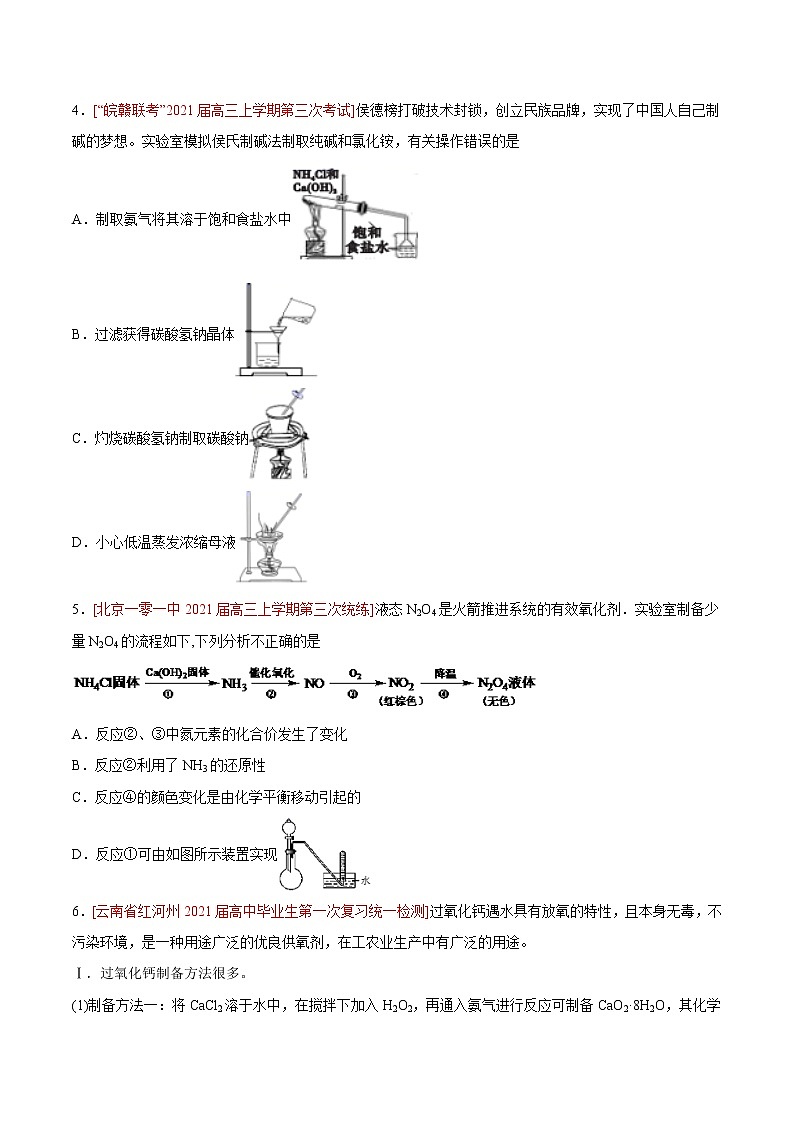
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。(3)纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。回答下列问题:(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。A.100 mL B.250 mL C.500 mL D.1000 mL(2)在反应装置中应选用______冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是______。(3)加入适量饱和亚硫酸氢钠溶液的目的是___________;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理__________。(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是_______。(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是_______。(6)本实验制备的苯甲酸的纯度为_______;据此估算本实验中苯甲酸的产率最接近于_______(填标号)。A.70% B.60% C.50% D.40%(7)若要得到纯度更高的苯甲酸,可通过在水中__________的方法提纯。4.[“皖赣联考”2021届高三上学期第三次考试]侯德榜打破技术封锁,创立民族品牌,实现了中国人自己制碱的梦想。实验室模拟侯氏制碱法制取纯碱和氯化铵,有关操作错误的是A.制取氨气将其溶于饱和食盐水中B.过滤获得碳酸氢钠晶体C.灼烧碳酸氢钠制取碳酸钠D.小心低温蒸发浓缩母液5.[北京一零一中2021届高三上学期第三次统练]液态N2O4是火箭推进系统的有效氧化剂.实验室制备少量N2O4的流程如下,下列分析不正确的是A.反应②、③中氮元素的化合价发生了变化B.反应②利用了NH3的还原性C.反应④的颜色变化是由化学平衡移动引起的D.反应①可由如图所示装置实现6.[云南省红河州2021届高中毕业生第一次复习统一检测]过氧化钙遇水具有放氧的特性,且本身无毒,不污染环境,是一种用途广泛的优良供氧剂,在工农业生产中有广泛的用途。Ⅰ.过氧化钙制备方法很多。(1)制备方法一:将CaCl2溶于水中,在搅拌下加入H2O2,再通入氨气进行反应可制备CaO2·8H2O,其化学方程式为_______________在碱性环境下制取CaO2·8H2O的装置如下:①X仪器的名称为___________②乙中沉淀反应时常用冰水浴控制温度在0 ℃左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高CaO2·8H2O的产率;其二:____________③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验CaO2·8H2O是否洗涤干净的操作为_____________(2)制备方法二:利用反应Ca(s)+O2(g)CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:请回答下列问题:①装置A中橡胶管的作用为_____________________②请选择必要的装置,模拟实验室制备CaO2,按气流方向连接顺序为_____________(填仪器接口的字母编号,装置可重复使用)。Ⅱ.水产运输中常向水中加一定量CaO2·8H2O增加溶氧量(DO),水中溶氧量(DO)是用每升水中溶解氧气的质量来表示,其测定步骤及原理如下:a.固氧:碱性下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH−=2MnO(OH)2↓;b. 氧化:酸性下,MnO(OH)2将I−氧化为I2;c.滴定:用Na2S2O3标准溶液滴定生成的I2:2S2O+I2=S4O+2I−。某同学向100.00mL水中加一定量CaO2·8H2O,取此水样50.00mL,按上述方法测定水中溶氧量(DO),消耗 0.02 mol·L−1 Na2S2O3标准溶液 15.00 mL。(1)滴定过程中使用的指示剂是_______________;(2)请写出步骤 b 中的离子方程式_____________;(3)该水样中的溶氧量(DO)为_________mg·L−1(忽略体积变化)。7.[广东省惠州市2021届高三上学期第一次调研考试]工业上用低品铜矿(主要含CuS、FeO等)制备氯化亚铜(CuCl)的一种工艺流程如图:已知:①CuCl微溶于水,不溶于乙醇,露置于潮湿的空气中易被氧化。②“氧化”时,NO中N元素主要被还原为最低价态,少部分被还原为NO。(1)①“氧化”阶段的温度需控制在65℃,其适宜的加热方式为____;②该步骤中FeO被NH4NO3氧化,其主要反应的离子方程式:____。(2)在实验室进行实验时,“氧化”阶段反应可在如图所示装置中进行:①实验开始时,温度计显示反应液温度低于室温,主要原因是____。②通入氧气的目的是____。③为便于观察和控制产生O2的速率,制备氧气的装置最好选用_______(填字母)。(3)已知常温下CuCl在水溶液中Ksp=1.2×10-6,工艺流程最后一步析出CuCl晶体后的溶液中,如果c(Cl-)=4.0mol·L-1,则c(Cu+)=____。(4)已知pH对CuCl沉淀率的影响如图所示,请设计从“过滤II”所得的滤液中获取CuCl的实验方案:____。(实验中必须使用的试剂有:NaCl溶液、Na2SO3溶液、NaOH溶液、95%乙醇)。8.[湖南省永州市2021届高三第一次模拟]三氯化铬(CrCl3)为紫色晶体,熔点为83℃,易潮解,易升华,不易水解,高温下易被氧气氧化,主要用作媒染剂和催化剂。工业上制取三氯化铬的流程如下:请回答下列问题:(1)用蒸馏水洗涤三氧化二铬是除去_________(填化学式)。(2)650℃时,在反应器反应一段时间后,除产生CrCl3外,还有副产物剧毒的光气(COCl2)生成,该反应的化学方程式是_______________。(3)根据上述工艺原理,实验室用Cr2O3和CCl4(沸点76.8℃)在高温下制备三氯化铬,部分实验装置如图所示(夹持装置略)。①上图中通入的气体X是_________(填化学式)。②装置A的烧杯中盛有________。(4)样品中三氯化铬质量分数的测定Ⅰ.称取样品0.330 0 g,加水溶解并于250 mL容量瓶中定容。Ⅱ.移取25.00 mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量H2SO4酸化,将Cr3+氧化为Cr2O;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+的形式存在。Ⅲ.加入1 mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液24.00 mL(已知:Cr2O+6I-+14H+=2Cr3++3I2+7H2O, 2Na2S2O3+I2=Na2S4O6+2NaI )。①滴定实验可选用的指示剂为______。②样品中无水三氯化铬的质量分数为______%(结果保留三位有效数字)。
相关试卷
这是一份重难点14 性质探究型实验综合题-2024年高考化学【热点·重点·难点】专练(新高考专用),文件包含重难点14性质探究型实验综合题-2024年高考化学热点·重点·难点专练新高考专用原卷版docx、重难点14性质探究型实验综合题-2024年高考化学热点·重点·难点专练新高考专用解析版docx等2份试卷配套教学资源,其中试卷共69页, 欢迎下载使用。
这是一份重难点13 物质制备型实验综合题-2024年高考化学【热点·重点·难点】专练(新高考专用),文件包含重难点13物质制备型实验综合题-2024年高考化学热点·重点·难点专练新高考专用原卷版docx、重难点13物质制备型实验综合题-2024年高考化学热点·重点·难点专练新高考专用解析版docx等2份试卷配套教学资源,其中试卷共68页, 欢迎下载使用。
这是一份重点10 物质结构与性质综合题- 高考化学专练【热点·重点·难点】,文件包含重点10物质结构与性质综合题-高考化学专练热点·重点·难点解析版doc、重点10物质结构与性质综合题-高考化学专练热点·重点·难点原卷版doc等2份试卷配套教学资源,其中试卷共14页, 欢迎下载使用。








