鲁科版 (2019)选择性必修1第3节 化学反应的速率教案
展开
这是一份鲁科版 (2019)选择性必修1第3节 化学反应的速率教案,共5页。
课例编号
学科
化学
年级
高二
学期
第一学期
课题
化学反应的速率(2)
教科书
书名: 选择性必修1 化学反应原理
出版社:山东科学技术出版社 出版日期:2019年 10 月
教学人员
姓名
单位
授课教师
指导教师
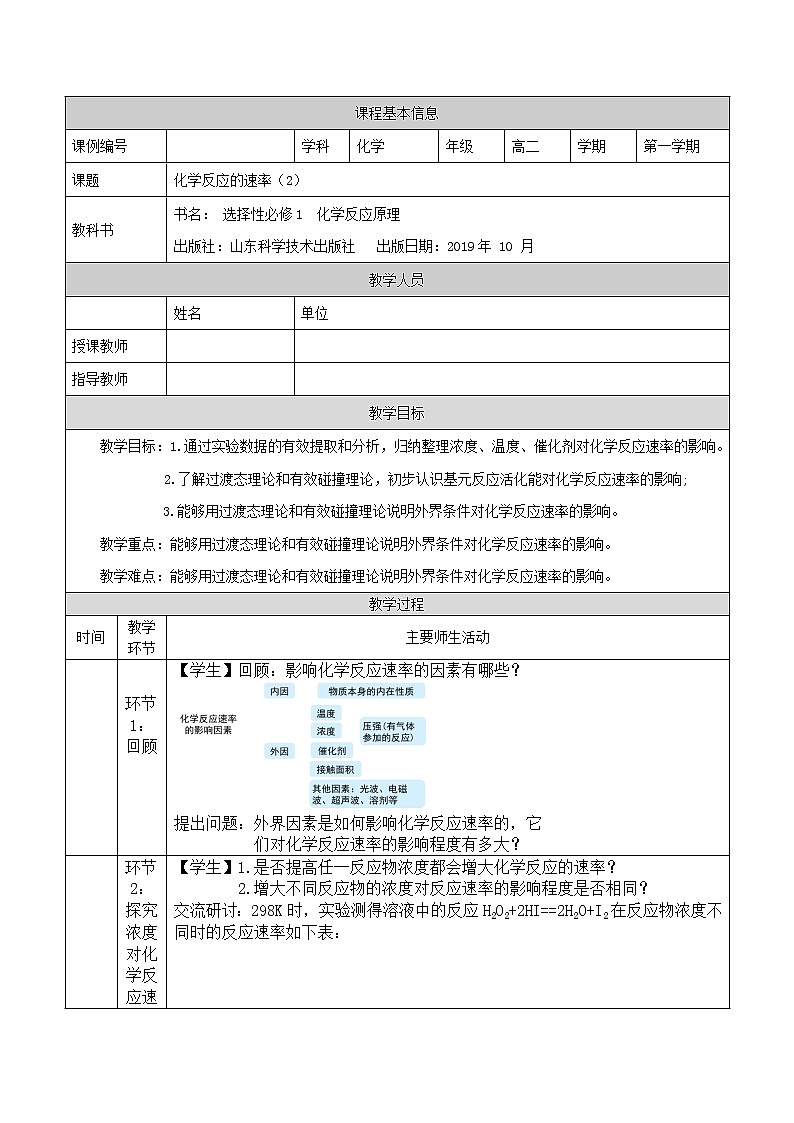
教学目标
教学目标:1.通过实验数据的有效提取和分析,归纳整理浓度、温度、催化剂对化学反应速率的影响。
2.了解过渡态理论和有效碰撞理论,初步认识基元反应活化能对化学反应速率的影响;
3.能够用过渡态理论和有效碰撞理论说明外界条件对化学反应速率的影响。
教学重点:能够用过渡态理论和有效碰撞理论说明外界条件对化学反应速率的影响。
教学难点:能够用过渡态理论和有效碰撞理论说明外界条件对化学反应速率的影响。
教学过程
时间
教学环节
主要师生活动
环节1:回顾
【学生】回顾:影响化学反应速率的因素有哪些?
提出问题:外界因素是如何影响化学反应速率的,它
们对化学反应速率的影响程度有多大?
环节2:探究浓度对化学反应速率的影响
【学生】1.是否提高任一反应物浓度都会增大化学反应的速率?
2.增大不同反应物的浓度对反应速率的影响程度是否相同?
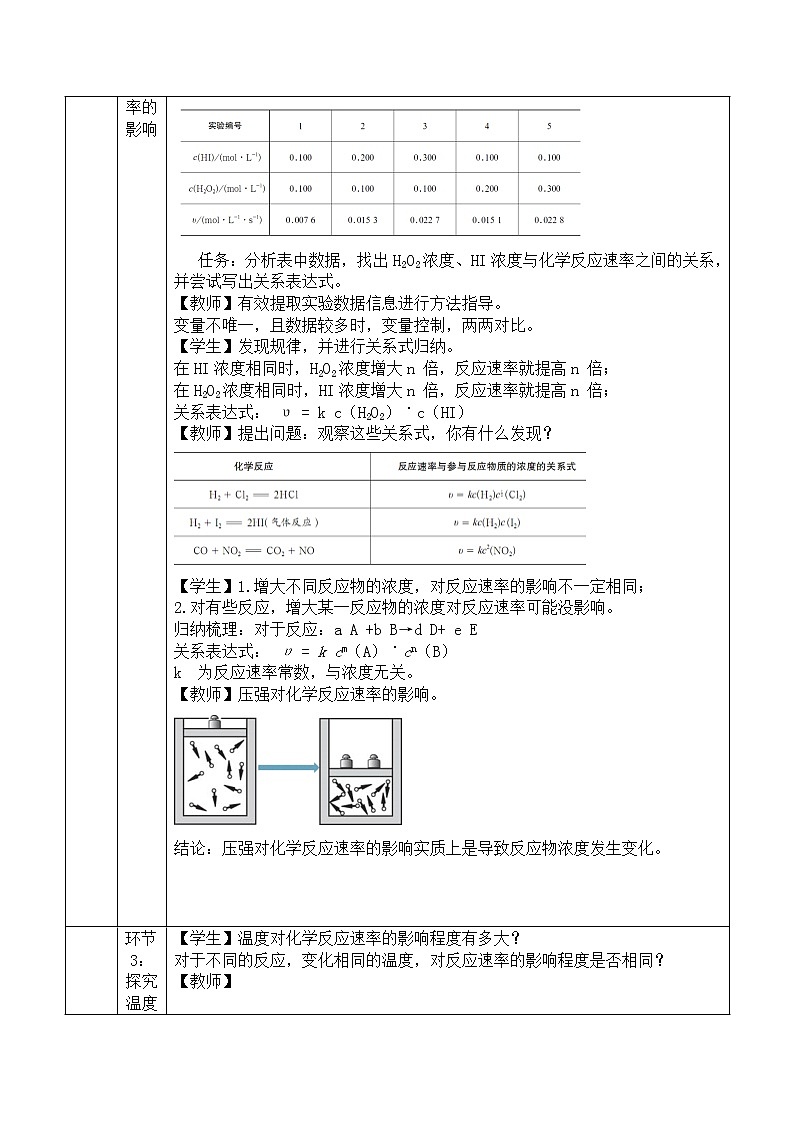
交流研讨:298K时,实验测得溶液中的反应H2O2+2HI==2H2O+I2在反应物浓度不同时的反应速率如下表:
任务:分析表中数据,找出H2O2浓度、HI浓度与化学反应速率之间的关系,并尝试写出关系表达式。
【教师】有效提取实验数据信息进行方法指导。
变量不唯一,且数据较多时,变量控制,两两对比。
【学生】发现规律,并进行关系式归纳。
在HI浓度相同时,H2O2浓度增大n 倍,反应速率就提高n 倍;
在H2O2浓度相同时,HI浓度增大n 倍,反应速率就提高n 倍;
关系表达式: υ = k c(H2O2)˙c(HI)
【教师】提出问题:观察这些关系式,你有什么发现?
【学生】1.增大不同反应物的浓度,对反应速率的影响不一定相同;
2.对有些反应,增大某一反应物的浓度对反应速率可能没影响。
归纳梳理:对于反应:a A +b B→d D+ e E
关系表达式: υ = k cm(A)˙cn(B)
k 为反应速率常数,与浓度无关。
【教师】压强对化学反应速率的影响。
结论:压强对化学反应速率的影响实质上是导致反应物浓度发生变化。
环节3:探究温度对化学反应速率的影响
【学生】温度对化学反应速率的影响程度有多大?
对于不同的反应,变化相同的温度,对反应速率的影响程度是否相同?
【教师】
提出问题:观察上述数据,你能得出哪些结论?
【学生】
结论:其他条件相同时,升高温度,能增大反应速率常数,从而加快化学反应速率;
升高相同温度,不同化学反应速率常数的增大程度不同。
【教师】介绍基元反应是如何进行的。
活化能(Ea)=过渡态的能量-反应物的平均能量
活化能的存在是化学反应通常需要获取能量才能实际发生的原因!
活化能是决定化学反应速率的内因。
资料:
一定温度下,活化能越大,反应速率越小,活化能越小,反应速率越大。
活化能小于40 kJ/ml的反应速度很快,如中和反应,活化能大于400 kJ/ml的反应速率就非常小。
【学生】基于过渡态理论和有效碰撞理论解释“为何升高温度能加快化学反应速率?”
升高温度,可以提高反应物分子的能量,这样单位体积内活化分子数就会增多,发生有效碰撞的频率增大,进而增大反应物分子形成过渡态的比例,因此升高温度,化学反应速率增大。
【教师】科学家在大量实验事实的基础上,发现:
对于不同的化学反应,
改变相同温度,对速率常数的影响是不同的;
Ea越大,改变温度对反应速率常数的影响程度就越大。
环节3:探究催化剂对化学反应速率的影响
【学生】回顾对催化剂的已有认识。
1.在反应前后,质量和化学性质不变,但能够提高反应速率;
2.在反应过程中,催化剂参与反应后再生成。
理论分析:
加入催化剂会改变反应历程,会明显降低反应的活化能,使反应更容易进行,化学反应的速率加快。
【教师】资料:
【学生】结论:催化剂具有选择性;
催化剂对提高化学反应速率具有极为显著的作用!
【教师】催化剂具有选择性的实际应用。
环氧乙烷是一种广谱灭菌剂,广泛应用于医疗用品灭菌。我们现在经常使用的口罩必须经过环氧乙烷灭菌合格后才能投入市场。它由乙烯和氧气反应制得。
主反应
副反应
研究人员开发了一种银催化剂,它能改变反应历程,降低生成环氧乙烷反应的活化能,使得该反应更容易进行,生成环氧乙烷的反应速率明显加快,这样依次和氧气就能更快更多的生成环氧乙烷,有效减少副反应的发生,从而生产效率提高。
同一反应有不同的催化剂。
资料:工业生产与催化剂——“不能没有你”
研制高效催化剂促进工业发展。
【学生】催化剂加入化学反应中是否永久有效?
小结催化剂:
1.在反应历程中,催化剂参与反应后再生成,质量和化学性质
不变
2.催化剂改变反应历程,降低反应活化能,显著提高化学反应
速率
3.催化剂具有高效性、专一性、选择性
4.催化剂不能改变化学反应的平衡常数,不能改变平衡转化率
环节5:课堂小结
相关教案
这是一份2020-2021学年第2章 化学反应的方向、 限度与速率第2节 化学反应的限度教案,共1页。教案主要包含了化学(鲁科版)11等内容,欢迎下载使用。
这是一份化学第1节 水与水溶液教案及反思,共2页。
这是一份鲁科版 (2019)选择性必修1第4节 离子反应教案设计,共1页。