




2022年中考化学酸碱盐专题复习课件PPT
展开
这是一份2022年中考化学酸碱盐专题复习课件PPT,共26页。PPT课件主要包含了学习目标,酸碱盐化学性质关系图等内容,欢迎下载使用。
1、在物质分类视角下,认识混合物、纯净物、单质、化合物各自的组成特点,理解它们之间转化的本质。
2、通过酸碱盐化学性质的复习,加深理解复分解反应的概念和发生条件,在此基础上形成它们之间的相互转化关系,破解它们之间相互转化的奥秘。
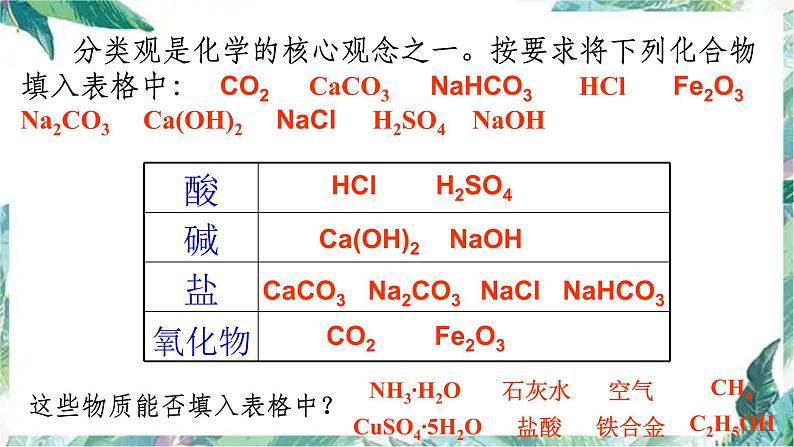
分类观是化学的核心观念之一。按要求将下列化合物填入表格中: CO2 CaCO3 NaHCO3 HCl Fe2O3 Na2CO3 Ca(OH)2 NaCl H2SO4 NaOH
HCl H2SO4
Ca(OH)2 NaOH
CaCO3 Na2CO3 NaCl NaHCO3
CO2 Fe2O3
这些物质能否填入表格中?
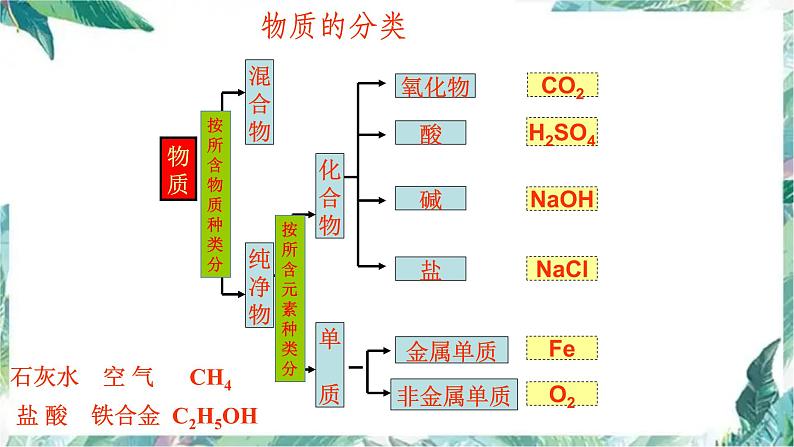
石灰水 空 气 CH4 盐 酸 铁合金 C2H5OH
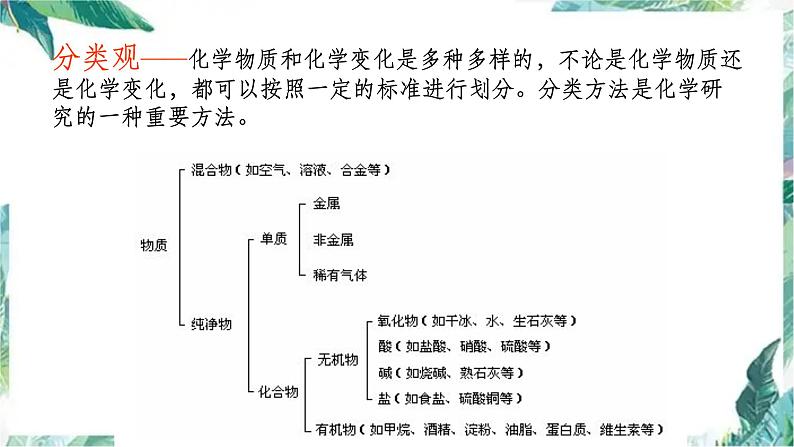
分类观——化学物质和化学变化是多种多样的,不论是化学物质还是化学变化,都可以按照一定的标准进行划分。分类方法是化学研究的一种重要方法。
为什么酸和碱的化学性质都有通性而盐类物质没有?
酸碱盐通常都有哪些化学性质?
1、酸:水溶液中解离时生成的阳离子全部是氢离子的化合物
2、碱:水溶液中解离时生成的阴离子全部是氢氧根离子的化合物
3、盐:解离时生成金属离子(或铵根离子)和酸根离子的化合物
酸的化学性质(通性): 常见的酸—盐酸 硫酸
1、与指示剂反应 酸能使紫色的石蕊溶液变红,无色酚酞溶液不变色。
4、酸 + 碱 → 盐 + 水
5、酸 + 盐 → 新盐 + 新酸
3、酸 +金属氧化物→ 盐 + 水
2、酸 + 活泼金属 → 盐 + 氢气
2020中考化学专题复习-酸碱盐专题复习PPT优秀课件
碱的化学性质(通性):常见的碱—氢氧化钠 氢氧化钙
1、与指示剂反应 碱能使紫色的石蕊溶液变蓝,无色酚酞溶液变红。
3、碱+ 酸 → 盐 + 水
4、碱+ 盐 →新碱 + 新盐
2、碱+非金属氧化物→ 盐+水
2、盐 + 酸 → 新盐 + 新酸
3、盐 + 碱 → 新盐 + 新碱
4、盐 + 盐 → 新盐 + 新盐
盐的一般化学反应规律:
1、盐 + 金属 → 盐 + 金属
小梅同学学习了单质、氧化物、酸、碱、盐性质后,发现许多不同类别的物质反应时能生成盐,于是她构建了如图所示的知识网络图。
请你把图中①②处补充完整,要求不能与图中已有信息重复。① ;
② 。
各类物质间的重要化学反应
1、金属+酸 → 盐 + 氢气
8、碱+ 非金属氧化物→ 盐 + 水
不属于化学反应基本类型
3、酸 + 金属氧化物 → 盐 + 水4、酸 + 碱 → 盐 + 水5、酸 + 盐 →新盐 + 新酸6、碱 + 盐 →新盐 + 新碱7、盐 + 盐 →新盐 + 新盐
2、金属+盐 →新金属 + 新盐
什么是复分解反应?其反应的条件是什么?
反应物:有酸,盐碱可不溶; 无酸,盐碱都得溶。
生成物:有气体或沉淀或水(至少一种)
(在溶液中)两种化合物相互交换成分,生成另外两种化合物的反应,叫做复分解反应。
八大沉淀(四碱四盐):
Cu(OH)2 蓝色↓ Fe(OH)3红褐色↓Mg(OH)2 白色↓ Al(OH)3 白色↓
CaCO3白色↓ BaCO3白色↓AgCl白色↓ BaSO4白色↓
AgCl和BaSO4不仅不溶于水,且不溶于酸
1、离子间反应生成水,不能共存:
2、离子间反应生成气体,不能共存:
3、离子间反应生成沉淀,不能共存:
——实质上是各离子间相遇能否生成水或生成气体或生成沉淀
(1) H+和CO32-(或HCO3-)
(2) NH4+和OH-
(2)OH-和Fe3+
(1)OH-和Cu2+
(5)CO32-和Ca2+
(6)CO32-和Ba2+
(3)OH-和Mg2+
(4)OH-和Al3+
(8)SO42-和Ba2+
破解酸碱盐反应规律的密码:
单质、氧化物、酸、碱、盐相互转化关系图
例1. A~H分别是氢、氧、碳、氮、钠、钙六种元素中的一种或几种组成的初中化学常见物质(如“题20图”所示。箭头表示物质间能转化,实线表示物质间能反应)。请回答下列问题:
(1)若B常温下为固态.则B是_____,F的化学式为___________。(2)若B常温下为气态,则A是_____。(3)G+H反应的化学方程式为___ __ __; 此反应属________反应(填反应类型)。
Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓
例2. 下图表示元素的化合价与物质类别关系。若它表示氮元素的部分关系图。则:
(1)A点对应的物质类别是 ; B点表示物质的化学式为 。(2)某化合物的化学式为KNO3,它代表的点是 (填字母);写出由D点表示的物质与水发生反应生成E的化学方程式 。
N2O5+H2O=2HNO3
例3. 学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其它物质省略),如下图所示。请回答:
(1)若盐是硫酸钾,则①中发生反应的化学方程式为 。(2)若盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有 (填序号)。(3)若盐是硝酸铜,由⑦来实现的化学方程式为: 。
(4)图中⑤处应补充的文字是 (写一种,不能与图中已有信息重复)。
2KOH+H2SO4=K2SO4+2H2O
CuCl2+2AgNO3=Cu(NO3)2+2AgCl↓
或Ba(NO3)2+CuSO4=BaSO4↓+Cu(NO3)2
碱+非金属氧化物(或酸+金属氧化物,或金属氧化物+非金属氧化物)
例4. 下图表示元素的化合价与物质类别的关系,“→”表示物质之间可以转化。A、B、C、D、E、F、G是初中化学所学物质,分别由H、O、S、Cl、K、Ba中的一种、两种或三种元素组成。请回答:
(1)A和E的化学式分别为______和_____。(2)D与G反应的化学方程式为: ____ __,此反应属__________(填基本反应类型)。(3)A—G物质间,发生中和反应的化学方程式为______ ____。
K2SO4+BaCl2=BaSO4↓+2KCl
Ba(OH)2+H2SO4=BaSO4↓+2H2O
例5. 初中化学常见物质A-I分别是下列物质中的一种:锌、氢氧化钠、硫酸铜溶液、稀盐酸、碳酸钠溶液、石灰水、生石灰、石灰石和水。他们之间相互的反应(每种物质只能用一次)恰好包含了化合反应(A+B)、分解反应(C)、置换反应(D+E)、中和反应(F+G)、复分解反应(H+I)等反应类型。试回答下列问题:(1)A+B的反应化学方程式是______________________(2)C的化学式为___________;硫酸铜溶液参加___________反应(填反应类型)。(3)H+I的反应方程式是_________________________________
CaO+H2O=Ca(OH)2
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
相关课件
这是一份2023年中考化学酸碱盐专题复习课件PPT,共17页。PPT课件主要包含了CaCl2,CaCl2和HCl,总结归纳酸的化学性质,实质H+,探究B处溶液,总结归纳碱的化学性质,Na2CO3等内容,欢迎下载使用。
这是一份中考化学复习微专题14酸碱盐__流程问题精讲课件,共18页。PPT课件主要包含了H2O,氯化钠,氯化钡和碳酸钠,玻璃棒,碳酸钙和氢氧化镁,碳酸钡,复分解,NaOH,用作调味品,CaCO3等内容,欢迎下载使用。
这是一份中考化学二轮复习专项突破---酸碱盐专题复习课件PPT,共25页。PPT课件主要包含了学习目标,酸碱盐化学性质关系图等内容,欢迎下载使用。









