
所属成套资源:2022版高考二轮专题冲刺指导方案 化学 (新高考专用)
第二部分 高考填空题专项突破 2022版高考化学二轮专题冲刺指导方案
展开
这是一份第二部分 高考填空题专项突破 2022版高考化学二轮专题冲刺指导方案,共37页。
第二部分 高考填空题专项突破
题型1 化学工艺流程综合分析题
真题·考情
全国 卷
1.[2021·全国卷甲]碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如图所示:
①加入Fe粉进行转化反应的离子方程式为________________________________,生成的沉淀与硝酸反应,生成________后可循环使用。
②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为________________________________________________________________________;
若反应物用量比nCl2nFeI2=1.5时,氧化产物为________;当nCl2nFeI2>1.5后,单质碘的收率会降低,原因是_______________________________________________________________
________________________________________________________________________。
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为________________________________________________________________________。
(3)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1 mol I2,消耗的KI至少为________ mol。I2在KI溶液中可发生反应:I2+I-⇌I3-。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
________________________________________________________________________。
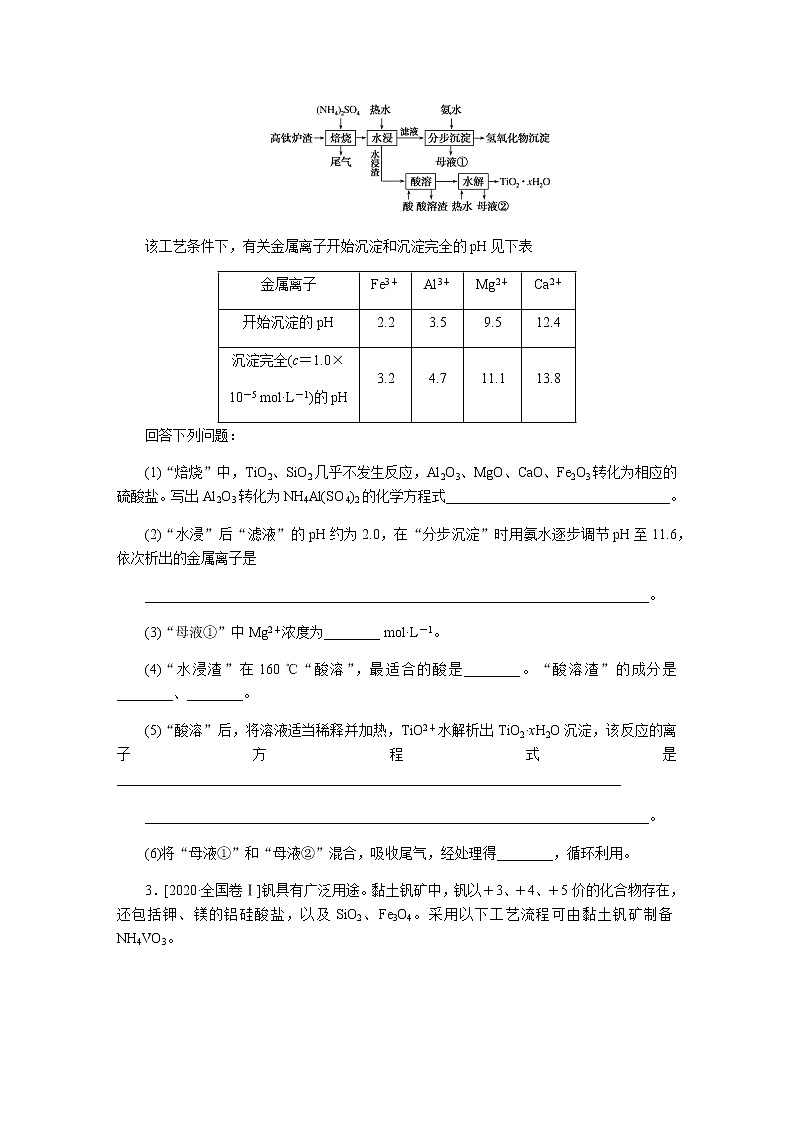
2.[2021·全国卷乙]磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3,为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
金属离子
Fe3+
Al3+
Mg2+
Ca2+
开始沉淀的pH
2.2
3.5
9.5
12.4
沉淀完全(c=1.0×
10-5 mol·L-1)的pH
3.2
4.7
11.1
13.8
回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐。写出Al2O3转化为NH4Al(SO4)2的化学方程式________________________________。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是
________________________________________________________________________。
(3)“母液①”中Mg2+浓度为________ mol·L-1。
(4)“水浸渣”在160 ℃“酸溶”,最适合的酸是________。“酸溶渣”的成分是________、________。
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得________,循环利用。
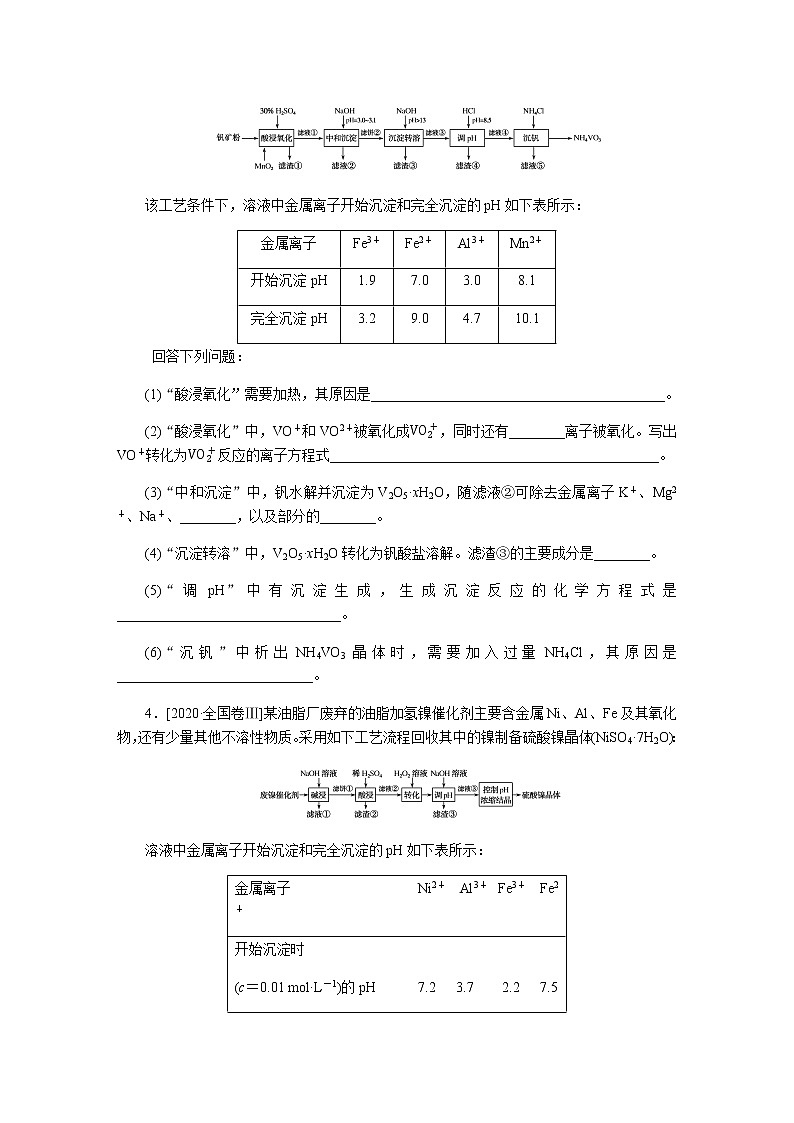
3.[2020·全国卷Ⅰ]钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Fe3+
Fe2+
Al3+
Mn2+
开始沉淀pH
1.9
7.0
3.0
8.1
完全沉淀pH
3.2
9.0
4.7
10.1
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是__________________________________________。
(2)“酸浸氧化”中,VO+和VO2+被氧化成VO2+,同时还有________离子被氧化。写出VO+转化为VO2+反应的离子方程式_______________________________________________。
(3)“中和沉淀”中,钒水解并沉淀为V2O5·xH2O,随滤液②可除去金属离子K+、Mg2+、Na+、________,以及部分的________。
(4)“沉淀转溶”中,V2O5·xH2O转化为钒酸盐溶解。滤渣③的主要成分是________。
(5)“调pH”中有沉淀生成,生成沉淀反应的化学方程式是________________________________。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是____________________________。
4.[2020·全国卷Ⅲ]某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时
(c=0.01 mol·L-1)的pH 7.2 3.7 2.2 7.5
沉淀完全时
(c=1.0×10-5 mol·L-1)的pH 8.7 4.7 3.2 9.0
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______________________________________。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式________________________________________________________________________。
(2)“滤液②”中含有的金属离子是__________________。
(3)“转化”中可替代H2O2的物质是________________。若工艺流程改为先“调pH”后“转化”,即
“滤液③”中可能含有的杂质离子为________。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=__________________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是________。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式____________________________。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是____________________________。
5.[2019·全国卷Ⅰ]硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为____________________________。
(2)“滤渣1”的主要成分有____________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是____________。
(3)根据H3BO3的解离反应:H3BO3+H2O⇌H++BOH4- ,Ka=5.81×10-10,可判断H3BO3是________________酸;在“过滤2”前,将溶液pH调节至3.5,目的是________________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为________________________________________________________________________,
母液经加热后可返回____________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是____________。
6.[2019·全国卷Ⅱ]立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为________(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为__________________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差,其原因是“还原料”表面生成了难溶于水的________(填化学式)。
③沉淀器中反应的离子方程式为______________________________________________。
(3)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.100 0 mol·L-1的I2KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉为指示剂,过量的I2用0.100 0 mol·L-1 Na2S2O3溶液滴定,反应式为I2+2S2O32-===2l-+S4O62-。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为________________,样品中S2-的含量为________________(写出表达式)。
7.[2019·全国卷Ⅲ]高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子
Mn2+
Fe2+
Fe3+
Al3+
Mg2+
Zn2+
Ni2+
开始沉淀的pH
8.1
6.3
1.5
3.4
8.9
6.2
6.9
沉淀完全的pH
10.1
8.3
2.8
4.7
10.9
8.2
8.9
(1)“滤渣1”含有S和________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式________________________________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是______________________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_______________________________________________________________________
________________________________________________________________________。
(6)写出“沉锰”的离子方程式______________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=13时,z=________。
省市 卷
1.[2021·广东卷]对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如下:
已知:25 ℃时,H2CO3的Ka1=4.5×10-7,Ka2=4.7×10-11;Ksp(BaMoO4)=3.5×10-8;Ksp(BaCO3)=2.6×10-9;该工艺中,pH>6.0时,溶液中Mo元素以MoO42-的形态存在。
(1)“焙烧”中,有Na2MoO4生成,其中Mo元素的化合价为________。
(2)“沉铝”中,生成的沉淀X为________。
(3)“沉钼”中,pH为7.0。
①生成BaMoO4的离子方程式为________________________。
②若条件控制不当,BaCO3也会沉淀。为避免BaMoO4中混入BaCO3沉淀,溶液中cHCO3- :cMoO42- =____________________________(列出算式)时,应停止加入BaCl2溶液。
(4)①滤液Ⅲ中,主要存在的钠盐有NaCl和Y,Y为________。
②往滤液Ⅲ中添加适量NaCl固体后,通入足量____________(填化学式)气体,再通入足量CO2,可析出Y。
(5)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。
①该氧化物为________。
②已知:Ga和Al同族,As和N同族。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为________。
2.[2021·湖南卷]Ce2(CO3)3可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等物质。以独居石为原料制备Ce2CO33·nH2O的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为________;
(2)为提高“水浸”效率,可采取的措施有________________________(至少写两条);
(3)滤渣Ⅲ的主要成分是________________(填化学式);
(4)加入絮凝剂的目的是________________________;
(5)“沉铈”过程中,生成Ce2CO33·nH2O的离子方程式为________________________________________________________________________,
常温下加入的NH4HCO3溶液呈________(填“酸性”“碱性”或“中性”)(已知:NH3·H2O的Kb=1.75×10-5,H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11);
(6)滤渣Ⅱ的主要成分为FePO4,在高温条件下,Li2CO3、葡萄糖C6H12O6和FePO4可制备电极材料LiFePO4,同时生成CO和H2O,该反应的化学方程式为________________________________________________________________________。
3.[2021·河北卷]绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr-Fe-Al-Mg的深度利用和Na+内循环。工艺流程如下:
回答下列问题:
(1)高温连续氧化工序中被氧化的元素是________(填元素符号)。
(2)工序①的名称为________。
(3)滤渣Ⅰ的主要成分是________(填化学式)。
(4)工序③中发生反应的离子方程式为_______________________________________。
(5)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为______________________________________________,可代替NaOH的化学试剂还有____________(填化学式)。
(6)热解工序产生的混合气体最适宜返回工序________(填“①”“②”“③”或“④”)参与内循环。
(7)工序④溶液中的铝元素恰好完全转化为沉淀的pH为____________。{通常认为溶液中离子浓度小于10-5 mol·L-1为沉淀完全:AlOH3+OH-⇌AlOH4- K=100.63;Kw=10-14,Ksp[Al(OH)3]=10-33}
4.[2020·山东卷]用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
已知:MnO2是一种两性氧化物;25 ℃时相关物质的Ksp见下表。
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Ksp
1×10-16.3
1×10-38.6
1×10-32.3
1×10-12.7
回答下列问题:
(1)软锰矿预先粉碎的目的是______________________,MnO2与BaS溶液反应转化为MnO的化学方程式为
________________________________________________________________________。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是________________________________________________________________________。
(3)滤液Ⅰ可循环使用,应当将其导入到________操作中(填操作单元的名称)。
(4)净化时需先加入的试剂X为________(填化学式),再使用氨水调溶液的pH,则pH的理论最小值为______(当溶液中某离子浓度c≤1.0×10-5 mol·L-1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为____________________________________________。
5.[2020·江苏卷]实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料αFe2O3。其主要实验流程如下:
(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有________(填序号)。
A.适当升高酸浸温度 B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成________(填化学式);检验Fe3+是否还原完全的实验操作是________________________________________________________________________。
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是________________________________________________________________________
[Ksp(CaF2)=5.3×10-9,Ka(HF)=6.3×10-4]。
(4)沉铁。将提纯后的FeSO4溶液与氨水NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为___________________________________________
________________________________________________________________________。
②设计以FeSO4溶液、氨水NH4HCO3混合溶液为原料,制备FeCO3的实验方案:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
[FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5]。
6.[2020·浙江1月]碘化锂(LiI)在能源、医药等领域有重要应用,某兴趣小组制备LiI·3H2O和LiI,流程如下:
已知:
a.LiI·3H2O在75~80 ℃转变成LiI·2H2O,80~120 ℃转变成LiI·H2O,300 ℃以上转变成无水LiI。
b.LiI易溶于水,溶解度随温度升高而增大。
c.LiI在空气中受热易被氧化。
请回答:
(1)步骤 Ⅱ,调pH=7,为避免引入新的杂质,适宜加入的试剂为________。
(2)步骤Ⅲ,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作。下列说法正确的是________。
A.为得到较大的LiI·3H2O晶体颗粒,宜用冰水浴快速冷却结晶
B.为加快过滤速度,得到较干燥的晶体,可进行抽滤
C.宜用热水洗涤
D.可在80 ℃鼓风干燥
(3)步骤Ⅳ,脱水方案为将所得LiI·3H2O置入坩埚中,300 ℃加热,得LiI样品。用沉淀滴定法分别测定所得LiI·3H2O、LiI样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶中,调pH=6,用滴定管中的AgNO3标准溶液滴定至终点,根据消耗的AgNO3标准溶液体积计算,得LiI·3H2O、LiI的纯度分别为99.96%、95.38%。LiI纯度偏低。
①上述测定过程提及的下列仪器,在使用前一定不能润洗的是________。
A.容量瓶 B.烧杯
C.锥形瓶 D.滴定管
②测定过程中使用到移液管,选出其正确操作并按序列出字母:蒸馏水洗涤→待转移溶液润洗→( )→( )→( )→( )→洗净,放回管架。
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
③LiI纯度偏低,可能的主要杂质是________。
(4)步骤Ⅳ,采用改进的实验方案(装置如图),可以提高LiI纯度。
①设备X的名称是________。
②请说明采用该方案可以提高LiI纯度的理由__________________________________
________________________________________________________________________。
考情分析
考向
考点
考情1
以工业废料及矿物为原料通过分离、提纯、制备物质类工艺流程题
加快浸出速率的操作
实验条件的选择
浸出或除杂过程中涉及到的化学(离子)方程式的书写
陌生物质类别判断、电子式的书写
陌生物质中元素化合价或化学键数判断
考情2
以给定物质为载体的无机化工流程综合题
分离、提纯操作
物质成分判断
分析流程中某一操作目的
转化率的分析判断
Ksp除杂或判断沉淀是否生成中的应用
含量测定
题型·透解
题型角度1 物质制备中的化工流程分析
练1 焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛,回答下列问题:
(1)生产Na2S2O5,通常是由 NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式________________________________________________________________________
________________________________________________________________________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
①pH=4.1时,Ⅰ中为______________________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是____________________________。
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为____________________。电解后,________室的 NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为______________________________________,该样品中Na2S2O5的残留量为______ g·L-1(以SO2计)。
题型角度2 废物利用中有效成分提取的流程分析
练2 一种磁性材料的磨削废料的主要成分是铁镍合金(含镍质量分数约21%),还含有铜、钙、镁、硅的氧化物。由该废料制备氢氧化镍,工艺流程如下:
回答下列问题:
(1)“酸溶”时,溶液中有Fe3+、Fe2+、Ni2+等生成,废渣的主要成分是________;金属镍溶解的离子方程式为________________________________________________________。
(2)“除铁”时H2O2的作用是________________,加入碳酸钠的目的是________________________。
(3)“除铜”时,反应的离子方程式为________________________________________,若用Na2S代替H2S除铜,优点是________________________。
(4)已知除钙镁过程在陶瓷容器中进行,NaF的实际用量不能过多的理由为________________________。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程在“沉镍”过程中,需调节溶液pH约为________时,Ni2+才刚好沉淀完全(离子沉淀完全的浓度≤1.0×10-5 mol/L;lg 2=0.30)。
(6)100 kg废料经上述工艺制得Ni(OH)2固体的质量为31 kg,则镍回收率为________________(列式即可)。
(7)镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:M+Ni(OH)2充电,放电HM+NiOOH(式中M为储氢合金)。写出电池放电过程中正极的电极反应式________________________________________________________________________。
备战高考·要有方案
高考必备基础
一、化工流程中常用术语
术语
释义
研磨、雾化
将块状或颗粒状的物质磨成粉末或将液体雾化,增大反应物接触面积,以加快反应速率或使反应更充分
灼饶(煅烧)
使固体在高温下分解或改变结构、使杂质高温氧化、分解等。如煅烧石灰石、高岭土、硫铁矿
浸取
向固体中加入适当溶剂或溶液,使其中可溶性的物质溶解,包括水浸取、酸溶、碱溶、醇溶等
酸浸
在酸性溶液中使可溶性金属离子进入溶液,不溶物通过过滤除去的过程
蒸发结晶
蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出
蒸发浓缩
蒸发除去部分溶剂,提高溶液的浓度
水洗
用水洗去可溶性杂质,类似的还有酸洗、醇洗等
二、化工流程中的常见操作与思考角度
常见的操作
思考角度
加氧化剂
氧化某物质,生成目标产物或除去某些离子
判断能否加其他物质
要考虑是否引入杂质(或影响产物的纯度)等
分离、提纯
过滤、蒸发、萃取、分液、蒸馏等常规操作
从溶液中得到晶体的方法:蒸发浓缩―→冷却结晶―→过滤―→洗涤、干燥
提高原子利用率
绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用)
在空气中或在其他气体中进行的反应或操作
要考虑O2、H2O、CO2或其他气体是否参与反应;或能否达到隔绝空气、防氧化、防水解、防潮解等目的
控制溶液的pH
①调节溶液的酸碱性,使金属离子形成氢氧化物沉淀析出(或抑制水解)
②“酸作用”还可除去氧化物(膜)
③“碱作用”还可除去油污,除去铝片氧化膜,溶解铝、二氧化硅等
④特定的氧化还原反应需要的酸性条件(或碱性条件)
控制温度(常用水浴、冰浴或油浴)
①防止副反应的发生
②使化学平衡移动;控制化学反应的方向
③控制固体的溶解与结晶
④控制反应速率;使催化剂达到最大活性
⑤升温:促进溶液中的气体逸出,使某物质达到沸点挥发
⑥加热煮沸:促进水解,聚沉后利于过滤分离
⑦趁热过滤:减少因降温而析出的溶质的量
⑧降温:防止物质高温分解或挥发;降温(或减压)可以减少能源成本,降低对设备的要求
洗涤晶体
①水洗:通常是为了除去晶体表面水溶性的杂质
②冰水洗涤:能洗去晶体表面的杂质离子,且防止晶体在洗涤过程中的溶解损耗
③用特定有机试剂清洗晶体:洗去晶体表面的杂质,降低晶体的溶解度、有利于析出,减少损耗等
④洗涤沉淀的方法:往漏斗中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次
三、循环物质与副产品的判断
四、化学工艺流程图审题与答题模版
1.流程图结构特点
2.流程图分析与答题模版
(1)首尾主线分析:原料―→中间转化物质―→目标产物。
分析每一步操作的目的以及所发生的化学反应,跟踪主要物质的转化形式。
(2)依据“题给信息和题中设问”来带动流程中各步骤的细致分析。
步骤分析
高频设问
答题模版
原料处理
如何提高“酸浸率”?
固体粉碎的目的:减小固体颗粒,增大反应速率
升高反应的温度,增大反应速率
增大酸的浓度
分析“浸出率”图表
解释“浸出率”高低变化的因素(“浸出率”升高一般是反应温度升高,反应速率加快;但当“浸出率”达到最大值后,温度升高“浸出率”反而下降,一般是反应试剂的分解或挥发)
选择达到一定较高“浸出率”的时间及温度(注意:一般不止一个答案)
控制条件
除去杂质的方法
加氧化剂,转变金属离子的价态(如Fe2+―→Fe3+)
调节溶液的pH
利用题给金属离子沉淀的pH信息,使特定金属离子以氢氧化物沉淀出来
物质转化的分析
跟踪物质,分析每一步骤中可能发生的化学反应,书写化学方程式或离子方程式
滤渣、滤液中物质的判断:书写物质的化学式或电子式、分析物质中的化学键
确定循环物质
物质分离
过滤、蒸发结晶、重结晶、分液与萃取
仪器的选择(如玻璃仪器的选择)
结晶方法:
①晶体不带结晶水,如NaCl、KNO3等:蒸发结晶
②晶体带结晶水,如胆矾等:将滤液蒸发浓缩、冷却结晶、过滤
③要得到溶解度受温度影响小的溶质,如除去NaCl中少量的KNO3:蒸发浓缩结晶,趁热过滤
④要得到溶解度受温度影响大的溶质,如除去KNO3中少量的NaCl:蒸发浓缩、冷却结晶,过滤
晶体的洗涤
用乙醇等有机溶剂洗涤晶体的目的:可以除去晶体表面可溶性的杂质和水分,利用乙醇的易挥发性,有利于晶体的干燥
含结晶水的晶体不能选用乙醇作为洗涤剂,因为乙醇可以溶解结晶水
化学计算
浸出率计算、产率计算、Ksp计算等简单计算
模考·精练
1.Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为__________________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式________________________________________________________________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃
30
35
40
45
50
TiO2·xH2O转化率/%
92
95
97
93
88
分析40 ℃时TiO2·xH2O转化率最高的原因____________________________________
________________________________________________________________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为________。
(5)若“滤液②”中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3PO42沉淀生成?
________________________________________________________________________
________________________________________________________________________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式________________________________________________________________________。
2.纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。
(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为___________________________________________
________________________________________________________________________。
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。①反应:Cu2S+4FeCl3===2CuCl2+4FeCl2+S,每生成1 mol CuCl2,反应中转移电子的物质的量为________;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为_____________________________。
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是_________________________________________________________。
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4所示,当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是_________________________________。
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为________。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、________、干燥、________等操作可得到Fe2O3产品。
3.TiO2和CaTiO3都是光电转化材料。某研究小组利用钛铁矿(主要成分为FeTiO3,还含有少量SiO2等杂质)来制备TiO2和CaTiO3,并利用黄钾铁矾[KFe3(SO4)2(OH)6]回收铁的工艺流程如图1所示:
回答下列问题:
(1)“氧化酸解”的实验中,控制反应温度为150 ℃,不同氧化剂对钛铁矿酸解率的影响如图2所示。50 min时,要求酸解率大于85%,所选氧化剂应为________________________;
采用H2O2作氧化剂时,其效率低的原因可能是________________________________
________________________________________________________________________。
(2)向“氧化酸解”的滤液①中加入尿素[CO(NH2)2],TiO2+转化为TiO2,写出相应反应的离子方程式:_____________________________________________________________
________________________________________________________________________,
使用尿素而不直接通入NH3的原因是________________________________________
________________________________________________________________________。
(3)写出“高温煅烧”中由TiO2制备CaTiO3的化学方程式:________________________________________________________________________。
(4)Fe3+恰好沉淀完全时,溶液中c(Fe3+)=1.0×10-5 mol·L-1,计算此时溶液的pH=________。[Fe(OH) 3的Ksp=1.0×10-39、水的Kw=1.0×10-14]
(5)黄钾铁矾沉淀为晶体,含水量很少。回收Fe3+时,不采用加入氨水调节pH的方法制取Fe(OH)3的原因是
________________________________________________________________________。
4.钼酸钠(Na2MoO4)是一种冷却水系统的金属缓蚀剂,工业上利用钼精矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如图1所示。
回答下列问题:
(1)如果在空气中焙烧1 mol MoS2时,S元素转移12 mol电子,则MoS2中钼元素的化合价为________;焙烧的另一种产物是________,产生的尾气对环境的主要危害是________。
(2)若在实验中进行操作2,则从钼酸钠溶液中得到钼酸钠晶体的操作步骤是____________、过滤、洗涤、干燥。
(3)钼精矿中MoS2含量测定:取钼精矿25 g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体24.2 g,钼精矿中MOS2的质量分数为____________。(已知MoS2的相对分子质量为160,Na2MoO4·2H2O的相对分子质量为242)
(4)操作3发生反应的离子方程式为_________________________________________
________________________________________________________________________。
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图2所示。b电极的材料为________(填“镍”或“钼”),电极反应为________________________________
________________________________________________________________________。
第二部分 高考填空题专项突破
题型1 化学工艺流程综合分析题
真题·考情
全国卷
1.解析:(1)①悬浊液为AgI的饱和溶液,加入铁粉,发生置换反应2AgI+Fe===2Ag+Fe2++2I-,生成的沉淀为Ag,Ag与硝酸反应生成的AgNO3可循环使用。②还原性:I->Fe2+,通入Cl2的过程中,若氧化产物只有一种,则只有I-被氧化,反应的化学方程式为FeI2+Cl2===FeCl2+I2。若反应物用量比nCl2nFeI2=1.5时,设n(Cl2)=1.5 mol,则n(FeI2)=1 mol,1 mol FeI2中I-先被氧化,消耗1 mol Cl2,Fe2+后被氧化,消耗0.5 mol Cl2,因此FeI2和Cl2恰好完全反应,氧化产物为FeCl3、I2;当nCl2nFeI2>1.5时,过量的Cl2能氧化生成的I2,发生反应5Cl2+I2+6H2O===2HIO3+10HCl,因此碘的收率会降低。(2)题述制备I2的总反应为NaIO3与NaHSO3反应生成I2和SO42-,根据2IO3- 得10e- I2、HSO3- 失2e- SO42-,由得失电子守恒可得2IO3-+5HSO3-―→I2+5SO42-,再根据电荷守恒和原子守恒,配平离子方程式为2IO3-+5HSO3- ===I2+5SO42-+3H++H2O。(3)KI溶液和CuSO4溶液反应生成CuI和I2,配平离子方程式为2Cu2++4I-===2CuI+I2,若生成1 mol I2,消耗的KI至少为4 mol。I2在水中溶解度不大,反应中加入过量KI,使反应I2+I-⇌I3-平衡右移,防止单质碘的析出。
答案:(1)①2AgI+Fe===2Ag+Fe2++2I- AgNO3
②FeI2+Cl2===FeCl2+I2 FeCl3、I2 I2被进一步氧化
22IO3-+5HSO3- ===I2+5SO42-+3H++H2O
(3)4 防止单质碘析出
2.解析:结合题中信息对该流程进行如下梳理:
(1)结合图示及题给信息可知焙烧时Al2O3转化为NH4Al(SO4)2,尾气应为NH3,则Al2O3焙烧生成NH4Al(SO4)2的化学方程式为Al2O3+4(NH4)2SO4 焙烧=== 2NH4Al(SO4)2+6NH3↑+3H2O↑。(2)结合相关金属离子开始沉淀以及沉淀完全时的pH可知,加氨水调节pH至11.6的过程中,Fe3+、Al3+、Mg2+依次沉淀。(3)根据Mg2+沉淀完全时的pH=11.1,可知溶液中c(OH-)=10-2.9mol·L-1时,溶液中c(Mg2+)=1.0×10-5mol·L-1,则Ksp[Mg(OH)2]=1.0×10-5×(10-2.9)2=1.0×10-10.8,母液①的pH=11.6,即溶液中c(OH-)=10-2.4mol·L-1,则此时溶液中c(Mg2+)=KspMgOH2c2OH-=1.0×10-10.810-2.42 mol·L-1=1.0×10-6 mol·L-1。(4)由于常见的盐酸和硝酸均具有挥发性,且水浸渣需在160 ℃酸溶,因此最适宜的酸为硫酸。由于SiO2不溶于硫酸,焙烧过程中得到的CaSO4难溶于水,故酸溶渣的成分为SiO2、CaSO4。(5)酸溶后适当加热能促进TiO2+水解生成TiO2·xH2O,反应的离子方程式为TiO2++(x+1)H2O△=== TiO2·xH2O↓+2H+。(6)结合图示流程可知,母液①中含有氨水、硫酸铵,母液②中含有硫酸,二者混合后再吸收尾气NH3,经处理得到(NH4)2SO4。
答案:(1)Al2O3+4(NH4)2SO4 焙烧=== 2NH4Al(SO4)2+6NH3↑+3H2O↑
(2)Fe3+、Al3+、Mg2+
(3)1.0×10-6
(4)硫酸 SiO2 CaSO4
(5)TiO2++(x+1)H2O△TiO2·xH2O↓+2H+
(6)(NH4)2SO4
3.解析:(1)加热的目的是使反应完全,加快酸浸速率。(2)Fe3O4与硫酸反应生成Fe2+和Fe3+,Fe2+能够被氧化为Fe3+;VO+中钒元素化合价为+3,VO2+中钒元素化合价为+5,VO+被MnO2氧化为VO2+,MnO2被还原为Mn2+,结合得失电子守恒、原子守恒和电荷守恒配平:VO++MnO2+2H+===VO2++Mn2++H2O。(3)pH=3.0~3.1时,Mn2+还未沉淀,所以滤液②中有Mn2+,另外Fe3+、Al3+在该pH范围内没有沉淀完全,部分留在滤液②中。(4)滤饼②中除了有V2O5·xH2O,还有少量Fe(OH)3和Al(OH)3,加NaOH调pH>13,V2O5·xH2O与NaOH反应生成NaVO3,AlOH3与NaOH反应生成NaAl(OH)4,Fe(OH)3不与NaOH反应,所以滤渣③是Fe(OH)3。(5)“调pH”的目的是将NaAlOH4转化为Al(OH)3沉淀除去,反应的化学方程式为NaAl(OH)4+HCl===Al(OH)3↓+NaCl+H2O,则滤渣④为Al(OH)3。(6)加入过量NH4Cl固体,c(NH4+)增大,根据同离子效应,可促进NH4VO3晶体尽可能完全析出。
答案:(1)加快酸浸和氧化反应速率(促进氧化完全)
(2)Fe2+ VO++MnO2+2H+===VO2++Mn2++H2O
(3)Mn2+ Al3+和Fe3+
(4)Fe(OH)3
(5)NaAl(OH)4+HCl===Al(OH)3↓+NaCl+H2O
(6)利用同离子效应,促进NH4VO3尽可能析出完全
4.解析:(1)油脂可在NaOH溶液中发生水解反应生成可溶性的高级脂肪酸钠和甘油,并且NaOH溶液能溶解Al和Al2O3,2Al+2NaOH+2H2O===2NaAlO2+3H2↑、Al2O3+2NaOH===2NaAlO2+H2O,故“碱浸”中NaOH的两个作用分别是除去油脂和溶解铝及其氧化物。“滤液①”中含有Na[Al(OH)4](也可写成NaAlO2),向其中加入稀H2SO4调为中性会生成Al(OH)3沉淀,反应的离子方程式为AlOH4-+H+===Al(OH)3↓+H2O或AlO2-+H++H2O===Al(OH)3↓。(2)“滤饼①”中含有Ni、Fe、NiO、FeO、Fe2O3以及少量其他不溶物,加入稀H2SO4后主要发生反应Ni+2H+===Ni2++H2↑、Fe+2H+===Fe2++H2↑、NiO+2H+===Ni2++H2O、FeO+2H+===Fe2++H2O、Fe2O3+6H+===2Fe3++3H2O,故“滤液②”中含有的金属离子是Ni2+、Fe2+、Fe3+。(3)H2O2的作用是在酸性条件下将Fe2+氧化为Fe3+(2Fe2++H2O2+2H+===2Fe3++2H2O),且在“转化”中不引入新杂质,故可替代H2O2的物质是O2或空气,发生反应4Fe2++O2+4H+===4Fe3++2H2O,也不引入新杂质。加NaOH溶液“调pH”的目的是生成Fe(OH)3沉淀除去Fe3+,为除尽Fe3+而又不生成Ni(OH)2沉淀,需控制pH范围:3.2≤pH
相关试卷
这是一份题型1 化学与STSE 2022版高考化学二轮专题冲刺指导方案,共19页。
这是一份 化学实验基础应用 2022版高考化学二轮专题冲刺指导方案,共31页。试卷主要包含了下列实验装置能达到实验目的的是,解析等内容,欢迎下载使用。
这是一份 有机物的结构、性质、用途 2022版高考化学二轮专题冲刺指导方案,共25页。








