

人教版 (2019)必修 第二册第一节 化学反应与能量变化同步练习题
展开
这是一份人教版 (2019)必修 第二册第一节 化学反应与能量变化同步练习题,共15页。试卷主要包含了单选题,非选这题等内容,欢迎下载使用。
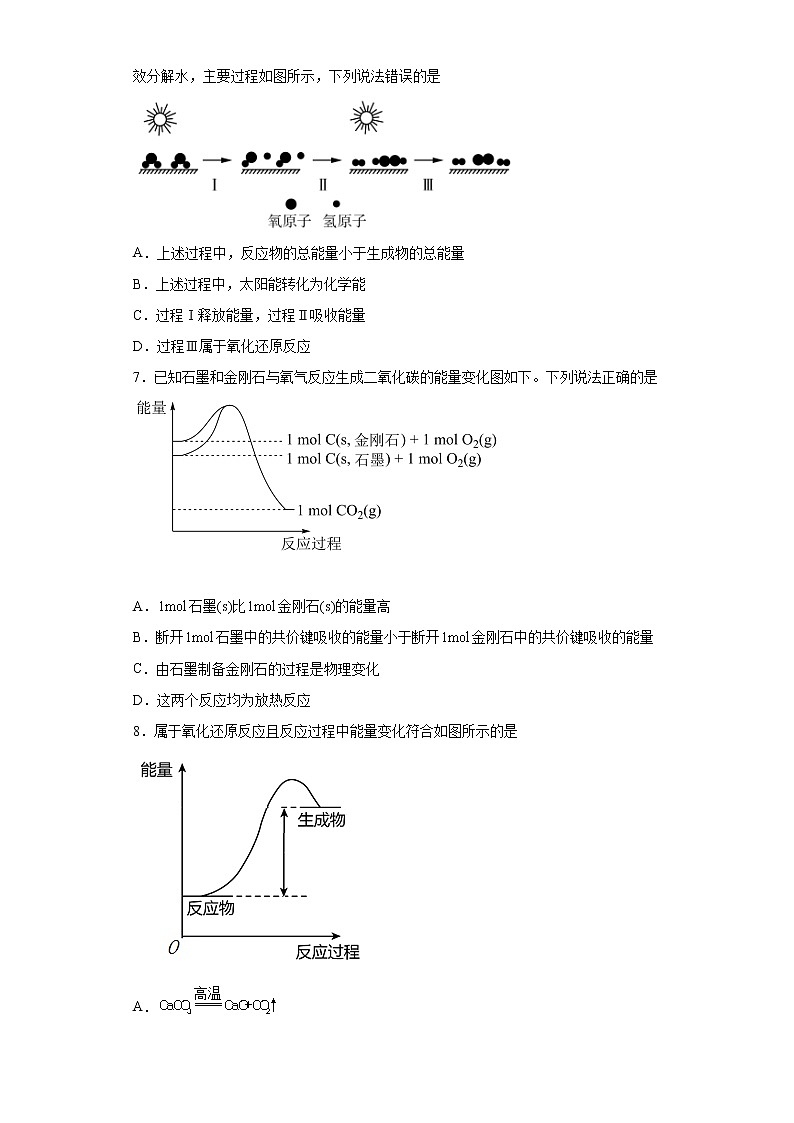
化学反应与热能一、单选题(15题)1.有关化学反应中能量变化的说法正确的是A.任何反应都会吸收或放出热量B.化学反应中一定会有化学键的断裂和生成C.根据能量守恒定律,反应物的总能量与生成物的总能量一定相等D.反应物的总键能大于生成物的总键能,该反应为放热反应2.在相同条件下,质量相等的两份氢气和足量的氧气充分反应,分别生成液态水(反应①)和水蒸气(反应②)。下列说法正确的是A.反应①放出的热量多 B.反应②放出的热量多C.反应①、②放出的热量一样多 D.无法比较反应①、②放出的热量3.已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是A.X的能量一定低于M的能量,Y的能量一定低于N的能量B.因为该反应为吸热反应,故一定要加热反应才能进行C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量D.X和Y的总能量一定低于M和N的总能量4.下列反应既是氧化还原反应,又是吸热反应的是A.铝片与稀反应 B.与的反应C.灼热的炭与反应 D.甲烷在中的燃烧反应5.某反应过程中体系的能量变化如图所示,下列说法错误的是A.反应过程可表示为B.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能C.正反应的热效应ΔH=E1-E2<0,所以正反应为放热反应D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应6.中国研究人员研制出一种新型复合光催化剂,可以利用太阳光在催化剂表面实现高效分解水,主要过程如图所示,下列说法错误的是A.上述过程中,反应物的总能量小于生成物的总能量B.上述过程中,太阳能转化为化学能C.过程Ⅰ释放能量,过程Ⅱ吸收能量D.过程Ⅲ属于氧化还原反应7.已知石墨和金刚石与氧气反应生成二氧化碳的能量变化图如下。下列说法正确的是 A.石墨(s)比金刚石(s)的能量高B.断开石墨中的共价键吸收的能量小于断开金刚石中的共价键吸收的能量C.由石墨制备金刚石的过程是物理变化D.这两个反应均为放热反应8.属于氧化还原反应且反应过程中能量变化符合如图所示的是A.B.C.D.9.已知几种共价键的键能如下:化学键H—NN≡NCl—ClH—Cl键能/kJ·mol-1391946328431 下列说法错误的是A.键能:N≡N>N=N>N-N B.H(g)+Cl(g)=HCl(g)该过程会放出431kJ热量C.H—N键能小于H—Cl键能,所以NH3的沸点高于HClD.该反应为放热反应,说明反应物具有的能量比生成物高10.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是A.该反应是吸热反应B.断裂2molA-B键需要吸收ykJ的能量C.2molAB的总能量高于1molA2和1molB2的总能量D.断裂1molA-A键和1molB-B键能放出xkJ的能量11.下列反应既是氧化还原反应,又是吸热反应的是A.Ba(OH)2•8H2O与NH4Cl混合 B.Al和Fe2O3高温条件下反应C.碳与水蒸气制取“水煤气” D.高温煅烧石灰石12.下列实验现象或图像信息不能充分说明对应的化学反应是放热反应的是选项ABCD反应装置或图像实验现象或图像信息反应开始后,针筒活塞向右移动反应物总能量大于生成物总能量反应开始后,甲处液面低于乙处液面温度计的水银柱不断上升 A.A B.B C.C D.D13.H2与O2发生反应的过程用模型图表示如下(“—”表示化学键)。下列说法错误的是A.过程Ⅰ是吸热过程B.过程Ⅲ是放热过程C.该过程是旧化学键断裂,新化学键形成的过程D.该反应只能以热能的形式进行能量转化14.如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列不正确的是A.过程Ⅰ中断裂极性键C-Cl键B.过程Ⅱ可表示为O3 + Cl = ClO + O2C.过程Ⅲ中O + O = O2是吸热过程D.上述过程说明氟利昂中氯原子是破坏O3的催化剂15.石墨与金刚石都是碳的单质,工业上常用石墨在一定条件下转化为金刚石的反应原理生产人造钻石。已知12g石墨完全转化成金刚石时需要吸收E kJ的能量。则下列说法正确的是 ①金刚石比石墨稳定 ②石墨比金刚石稳定 ③等质量的石墨和金刚石完全燃烧,金刚石放出的热量多 ④等质量的金刚石和石墨完全燃烧,石墨放出的热量多A.①② B.②③ C.①④ D.③④二、非选这题(4大题)16.为了探究化学反应的热效应,某兴趣小组进行了如下实验:(1)将纯固体物质分别装入有水的锥形瓶里(发生化学反应),立即塞紧带形管的塞子,发现形管内红墨水的液面高度如图所示。①如图1所示,发生的反应(假设没有气体生成)是___________(填“放热”或“吸热”)反应,是___________(填两种物质的化学式)。②如图2所示,发生的反应(假设没有气体生成)是___________(填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是___________(填序号)。A.碳的燃烧反应B.的分解反应C.盐酸与溶液的反应(2)如下图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块铝片,再滴入稀溶液。试回答下列问题:①实验中观察到的现象是:铝片逐渐溶解、有大量气泡产生、___________。②产生上述现象的原因是___________。17.实验室利用下列装置模拟工业生产制备少量硝酸。(1)化学实验室中干燥氨气使用的试剂是___________。(2)B中反应的化学方程式为___________。(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700 ℃以上。下列图示中,能够正确表示该反应过程能量变化的是___________(填字母)。(4)高温时,2NO2(g)=2NO(g)+O2(g),因此氨气与氧气反应难以生成NO2.根据下列数据计算,当2 mol NO2分解时,反应会___________(填“吸收”或“放出”)___________ kJ能量。NO2(g) N(g)+2O(g)NO(g) N(g)+O(g)O2(g) 2O(g)18.断裂化学键所需要的能量如表所示,肼()的有关化学反应的能量变化如图所示。化学键氧氧键能量/()a498946391 回答下列问题:(1)与反应生成和放出的能量为____________________。(2)与断键吸收的能量为____________。(3)________________________。(4)当有(1)生成时,放出的能量__________________________(填“>”“<”或“=”)。19.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:请回答下列问题:(1)如图表示某反应的能量变化关系,则此反应为________(填“吸热”或“放热”)反应,其中ΔH=__________(用含有a、b的关系式表示)。(2)若图示中表示反应H2(g)+O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1,则b=_____kJ·mol-1,x=________。(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气。反应的化学方程式为____________________________________。若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol电子转移时,反应的热量变化为________。
参考答案:1.BA.任何化学反应都伴随能量变化,但任何反应不一定都会吸收或放出热量,因为能量的转化还有电能等形式,A错误;B.化学反应的实质是旧键断裂、新键形成,所以化学反应中一定会有化学键的断裂和生成,B正确;C.任何化学反应都伴随能量变化,根据能量守恒定律,反应物的总能量与生成物的总能量一定不相等,C错误;D.断键吸热,形成化学键放热,所以反应物的总键能大于生成物的总键能,该反应为吸热反应,D错误;答案选B。2.A相同物质的液态时能量小于气态时的能量,而氢气和氧气反应又为放热反应,故生成液态时放出的能量多,故选A。3.DA.X+Y=M+N为吸热反应,X和Y的总能量一定低于M和N的总能量,故A错误;B.化学反应的吸放热与反应条件无关,有些吸热反应不需要加热就能进行,故B错误;C.吸热反应,破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,故C错误;D.X+Y=M+N为吸热反应,X和Y的总能量一定低于M和N的总能量,故D正确;选D。4.CA.铝片与稀H2SO4的反应为放热反应,故A不符合题意;B.与的反应为吸热反应,但不属于氧化还原反应,故B不符合题意;C.灼热的炭与CO2的反应中C元素化合价发生变化,属于氧化还原反应,且为吸热反应,故C符合题意;D.甲烷在中的燃烧反应是放热反应,故D不符合题意。答案选C。5.D由图可知反应物总能量大于生成物总能量,则正反应放热,反应热ΔH=E1-E2,其中E1和E2为反应的活化能,A…B…C为中间产物,为过渡态,可认为活化分子,以此解答该题。【详解】A.由图象可知反应过程可表示为A+BC(反应物)→[A…B…C](过渡态)→AB+C(产物),故A正确;B.反应物吸收一定能量成为活化分子,E1为正反应的活化能,故B正确;C.正反应的热效应为ΔH=E1-E2,反应物总能量大于生成物总能量,则正反应放热,故C正确;D.此图中逆反应的热效应ΔH=E2-E1>0,为吸热反应,故D错误;故选D。6.CA.由图可知,太阳能使水分解,水分解吸热,则反应物的总能量小于生成物的总能量,故A正确;B.由图可知,太阳能使水分解,则实现了光能向化学能的转化,故B正确;C.过程Ⅰ断键,吸收能量,过程Ⅱ中生成氢气、过氧化氢,形成化学键,过程Ⅱ放出能量,故C错误;D.过程Ⅲ为O-H键的断裂过程生成氢气和氧气,化学反应为:2H2O2=2H2+O2,属于氧化还原反应,故D正确;故选C。7.DA.从图中可以看出,1mol石墨的能量比1mol金刚石的能量低,故A错误;B.由于1mol石墨的能量比1mol金刚石的能量低,所以石墨比金刚石稳定,断开 1mol 石墨中的共价键吸收的能量大于断开 1mol 金刚石中的共价键吸收的能量,故B错误;C.石墨和金刚石是不同物质,由石墨制备金刚石的过程有新物质生成,是化学变化,故C错误;D.从图中可以看出,石墨和金刚石燃烧反应中,反应物的总能量均高于生成物的总能量,所以这两个反应均为放热反应,故D正确;故选D。8.C如图中,反应物的总能量低于生成物的总能量,为吸热反应。【详解】A.反应为非氧化还原反应,故A不符合题意;B.反应为放热反应,故B不符合题意;C.反应为吸热的氧化还原反应,故C符合题意;D.反应为非氧化还原反应,故D不符合题意;故选C。9.CA.三键键长小于双键键长小于单键键长,键长越短,键能越大,所以键能:N≡N>N=N>N-N,故A正确;B.键能:气态基态原子形成1mol化学键释放的最低能量,表中数据H-Cl键能为:431 kJ•mol-1,H(g)+Cl(g)=HCl(g)该过程会放出431kJ热量,故B正确;C.NH3的沸点高于HCl是由于NH3形成分子间氢键,而HCl不能,与键能无关,故C错误;D.为放热反应,这说明反应物具有的总能量比生成物具有的总能量高,故D正确;故选C。10.B由图可知,断裂化学键吸收的能量小于形成化学键释放的能量,为放热反应,以此来解答。【详解】A.因反应物的能量高于生成物的能量时,反应是放热反应,故A错误;B.因旧键的断裂吸收能量,由图可知断裂2molA-B键需要吸收ykJ能量,故B正确;C.由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故C错误;D.因旧键的断裂吸收能量,而不是释放能量,故D错误;故选B。11.C【详解】A.Ba(OH)2•8H2O与NH4Cl混合反应是吸热反应,但反应中没有元素化合价变化,是非氧化还原反应,A不符合;B.Al和Fe2O3高温条件下反应放热,有元素化合价变化,是氧化还原反应,B不符合;C.碳与水蒸气制取“水煤气”是吸热反应,反应中有元素化合价变化,是氧化还原反应,C符合;D.高温煅烧石灰石是吸热反应,但反应中没有元素化合价变化,是非氧化还原反应,D不符合;答案选C。12.AA.稀硫酸与锌反应产生气体,可导致瓶内压强增大,活塞右移不能判定反应放热,故选A;B.由图示可知,反应物总能量大于生成物总能量,反应为放热反应,故B不选;C.甲处液面低于乙处,说明反应放热导致空气受热膨胀,故C不选;D.温度计示数增大,说明反应放热,故D不选;答案选A13.DA.过程Ⅰ是化学键断键,因此过程Ⅰ是吸热过程,故A正确;B.过程Ⅲ是形成化学键,因此是放热过程,故B正确;C.根据图中信息H2与O2发生反应的过程是旧化学键断裂,新化学键形成的过程,故C正确;D.氢气与氧气反应,该反应不仅以热能的形式进行能量转化,还可能化学能转化为光能,故D错误。故选D。14.CA.根据图示,过程Ⅰ中CFCl3转化为CFCl2和氯原子,断裂极性键C-Cl键,故A正确;B.根据图示,过程Ⅱ可表示为:O3+Cl=ClO+O2,故B正确;C.O+O=O2为原子结合成分子的过程,为放热过程,故C错误;D.根据图示,氟利昂中氯原子在反应前后不变,是破坏O3的催化剂,故D正确;故选C。15.B由石墨完全转化为金刚石时吸热,说明石墨的能量比金刚石低,石墨比金刚石更稳定;则①石墨比金刚石稳定,故①错误;②石墨比金刚石稳定,故②正确;③同质量的石墨和金刚石完全燃烧时,消耗氧气的量相同,生成同样多的二氧化碳,由于金刚石的能量高,所以金刚石燃烧后放出的能量要多。则等质量的石墨和金刚石完全燃烧,金刚石放出的能量多,故③正确;④等质量的石墨和金刚石完全燃烧,金刚石放出的能量多,故④错误;综上所述②③正确;故选B。16. 放热 、 吸热 B 饱和澄清石灰水中出现白色浑浊 铝和溶液反应生成,且该反应是放热反应,的溶解度随温度的升高而降低(1)利用气体的热胀冷缩原理以及根据U形管两端红墨水液面的相对高度可判断出图1为放热反应,图2为吸热反应;(2)铝与强碱反应属于放热反应,然后根据氢氧化钙的溶解度随温度的升高而减小,可判断出观察到的现象除铝片逐渐溶解、有大量气泡产生外,还有饱和澄清石灰水中出现白色浑浊;据此分析解答。【详解】(1)①若如图1所示,体系内压强大于外界大气压,说明体系内气体膨胀,反应放热,遇水放热的物质X可以是、等,故答案为:放热;、;②若如图2所示,体系内压强小于外界大气压,说明体系内气体体积缩小,反应吸热;故答案为:吸热;A.碳的燃烧反应为放热反应,故A不选;B.的分解反应为吸热反应,故选B;C.盐酸与溶液反应为放热反应,故C不选;答案选B。(2)把试管放入盛有饱和澄清石灰水的烧杯中,向试管中放入几小块铝片,再滴入稀溶液,铝和溶液反应生成,且该反应是放热反应,的溶解度随温度的升高而降低,烧杯中的饱和澄清石灰水中会出现白色浑浊,故答案为:饱和澄清石灰水中出现白色浑浊;铝和溶液反应生成,且该反应是放热反应,的溶解度随温度的升高而降低。17. 碱石灰 3NO2+H2O=2HNO3+NO A 吸收 113(1)化学实验室中干燥氨气使用的试剂是碱石灰。(2)B中反应的化学方程式为3NO2+H2O=2HNO3+NO。(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700 ℃以上,说明该反应是放热反应。放热反应中反应物的总能量高于生成物的总能量,所以能够正确表示该反应过程能量变化的是A。(4)2 mol NO2断裂化学键时吸收的总能量为931 kJ×2=1 862 kJ,生成2 mol NO和1 mol O2的化学键放出的总能量是628 kJ×2+493 kJ=1 749 kJ,显然吸收的热量较多,故为吸热反应。因此,当有2 mol NO2分解时吸收的热量为-1749 kJ+1862 kJ =113 kJ。18. 523 2255 193 >(1)由题图可知,与反应生成和放出的能量为,故答案为:523;(2)与断键吸收的能量为,故答案为:2255;(3)化学键断裂吸收能量,化学键生成释放能量,断裂键所需的能量为,则化学键断裂吸收的能量为,解得,故答案为:193;(4)据图可知,与反应生成和放出的能量。(1)放出能量,因此当有(1)生成时,放出的能量大于,故答案为:>。19. 放热 (a-b)kJ·mol-1 926 496.4 O2+4HCl2Cl2+2H2O 放出热量31.4 kJ(1)由图可以知道反应物的总能量大于生成物的总能量,属于放热反应。焓变等于断开反应物中化学键吸收的能量减去形成生成物中化学键释放的能量;(2)b为1mol水中含有的化学键的键能,即为2倍的O-H的键能,根据焓变△H=反应物的键能总和-生成物的键能总和可计算出x数值;(3)用CuCl2作催化剂,在450°C利用空气中的氧气跟氯化氢反应生成氯气和水;先根据△H=反应物的键能总和-生成物的键能总和求出O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)的△H,然后根据转移电子数与焓变的对应比例关系确定热量变化。【详解】(1) 由图可以知道反应物的总能量大于生成物.的总能量,属于放热反应,焓变等于断开反应物中化学键吸收的能量减去形成生成物中化学键释放的能量,因此△H=(a-b)kJmol-1,故答案是:放热;(a-b)kJ·mol-1。(2) b为1mol水中含有的化学键的键能,即为2倍的O-H的键能,因此b=2463 kJ·mol-1=926 kJ·mol-1,根据焓变△H=反应物的键能总和-生成物的键能总和可得:436+-4632=-241.8,求得x=96.4,故答案是:926;496.4。(3) 用CuCl2作催化剂,在450°C利用空气中的氧气跟氯化氢反应制氯气,生成氯气和水,配平书写化学方程式为:O2+4HCl2Cl2+2H2O。由反应方程式可知:当1mol氧气完全反应时转移为4mol电子,放出125.6kJ的热量,所以当1mol电子转移时放出的热量为:125.6k=31.4kJ。故答案:O2+4HCl2Cl2+2H2O;放出31.4kJ热量。
相关试卷
这是一份2021学年第一节 化学反应与能量变化同步训练题,共15页。试卷主要包含了单选题,非选择题,实验题等内容,欢迎下载使用。
这是一份高中人教版 (2019)第一节 化学反应与能量变化综合训练题,共16页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第六章 化学反应与能量第一节 化学反应与能量变化同步练习题,共7页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。










