




人教版九年级下册课题2 酸和碱的中和反应课文ppt课件
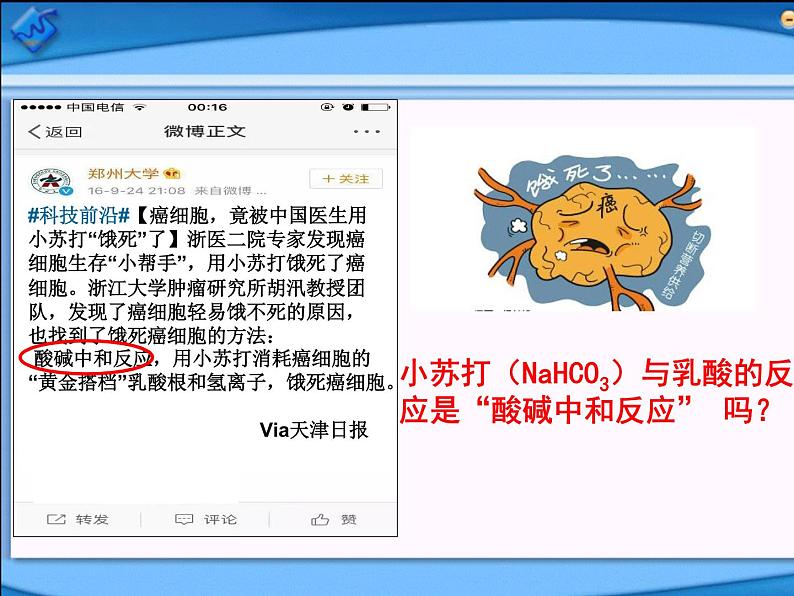
展开#科技前沿#【癌细胞,竟被中国医生用小苏打“饿死”了】浙医二院专家发现癌细胞生存“小帮手”,用小苏打饿死了癌细胞。浙江大学肿瘤研究所胡汛教授团队,发现了癌细胞轻易饿不死的原因,也找到了饿死癌细胞的方法: 酸碱中和反应,用小苏打消耗癌细胞的“黄金搭档”乳酸根和氢离子,饿死癌细胞。 Via天津日报
小苏打(NaHCO3)与乳酸的反应是“酸碱中和反应” 吗?
§10-3 酸和碱的中和反应(第一课时)
(1)能使指示剂变色(2)酸能与金属氧化物反应. (3) 酸还能与活泼金属反应.
(1)能使指示剂变色(2)碱还能与非金属氧化物反应
不同酸的化学性质相似是因为酸在水中解离出的阳离子全都是 。
不同碱的化学性质相似是因为碱在水中解离出的阴离子全都是 。
实验目的:以下三个实验中的酸与碱是否发生反应
蓝色沉淀溶解,溶液由无色变蓝色
氢氧化铜与稀硫酸发生了反应
氢氧化钡与稀硫酸发生了反应
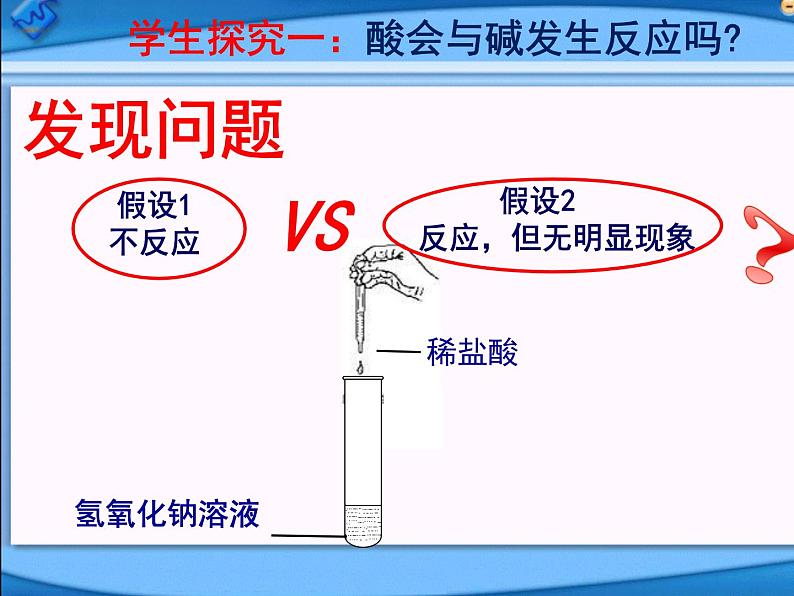
学生探究一:酸会与碱发生反应吗?
假设2反应,但无明显现象
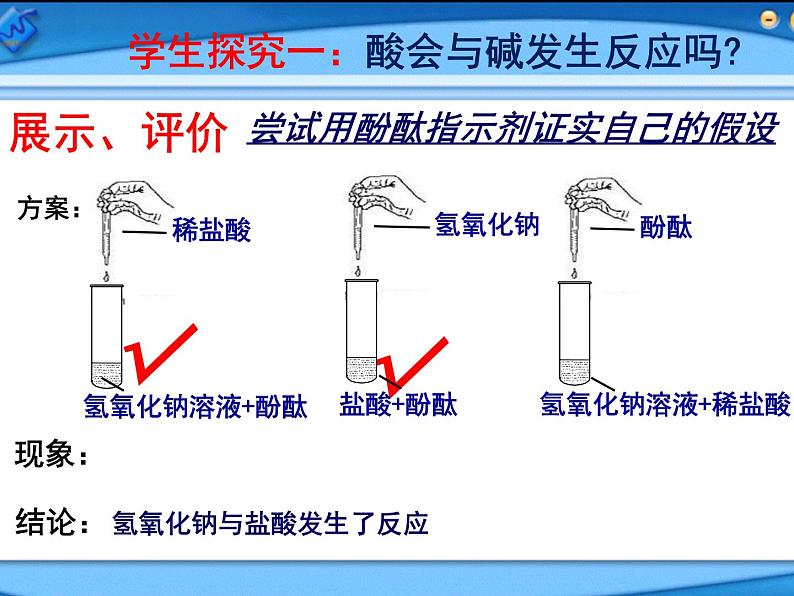
尝试用酚酞指示剂证实自己的假设
1.酚酞只需2至3滴2.向氢氧化钠中滴加盐酸时应缓慢逐滴加入,并边滴边轻晃试管,以便观察现象。
氢氧化钠与盐酸发生了反应
当我们用指示剂探究酸与碱是否发生反应时:“酸+碱+指示剂”“酸+指示剂+碱”、“碱+指示剂+酸”
反应后生成物是什么...
由金属离子和酸根离子构成的化合物。
HCl + NaOH=NaCl+ H2O
一、酸碱中和反应1.定义:酸与碱作用生成盐和水的反应 叫酸碱中和反应。
酸 + 碱== 盐 + 水
概念落实 有人认为生成盐和水的反应都是中和反应,对 吗?试举例。
CO2+2NaOH=Na2CO3 + H2OFe2O3+6HCl=2FeCl3 +3H2O
Ba(OH)2+H2SO4Cu(OH)2+H2SO4HCl + NaOH
为什么不同的酸与碱反应都会生成水呢?
=BaSO4↓+2H2O
=CuSO4+2H2O
学生探究二:中和反应的实质
溶液中酸解离出的H+和碱解出的OH-反应生成水。
水分子在溶液中不易电离。反应后,溶液中减少的离子是 。
2、中和反应的实质:溶液中酸解离出的氢离子与碱解 离出的氢氧根离子结合生成水。 H++OH-=H2O
一、酸碱中和反应1、定义:酸与碱作用生成盐和水的反应叫酸碱中和反应。
#科技前沿#【癌细胞,竟被中国医生用小苏打“饿死”了】浙医二院专家发现癌细胞生存“小帮手”,用小苏打饿死了癌细胞。浙江大学肿瘤研究所胡汛教授团队,发现了癌细胞轻易饿不死的原因,也找到了饿死癌细胞的方法: 酸碱中和反应,用小苏打消耗癌细胞的“黄金搭档”乳酸根和氢离子,饿死癌细胞。 Via天津日报
盐酸+水+防腐剂+香精+色素=洁厕剂
主要成分:氢氧化钠、碳酸钠、次氯酸钠、起泡剂、闪溶速通因子等
为什么皮蛋吃起来有涩味?
怎样才能消除这股涩味?
为什么这样能使涩味消失?
制作过程中加入少量熟石灰
二、中和反应在实际中的应用
假如某田地土壤的酸性主要是由硫酸型酸雨造成的,请书写用熟石灰治理该土壤的反应方程式
Ca(OH)2+ H2SO4=CaSO4 + 2H2O
2. 处理工厂的废水
印染厂的碱性废水含较多氢氧化钠,常用硫酸处理
2NaOH+H2SO4=Na2SO4+2H2O
Al(OH)3 + 3HCl=AlCl3 + 3H2O
胃酸过多的病人,可服用含氢氧化铝药物中和过多的胃酸
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。
答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
当堂训练1、 某同学不小心被黄蜂蛰了(黄蜂毒液呈碱性),为了减 轻疼痛,可以涂抹下列哪种物质( ) A.浓硫酸 B.食醋 C.食盐水 D.苏打水或肥皂水(呈碱性)2、 酸与碱作用生成盐和水的反应,叫作中和反应,它在工 农业生产和日常生活中有广泛的用途,下列应用一定与 中和反应原理无关的是( ) A.服用含Al(OH)3的药物治疗胃酸过量 B.使用熟石灰改良酸性土壤 C.用熟石灰和硫酸铜配制波尔多液 D.用NaOH溶液洗涤石油产品中的残余硫酸
1.中和反应的定义和实质2.判断酸碱是否发生中和反应的实验探究方法3.中和反应的应用
1、某同学不小心被黄蜂蛰了(黄蜂毒液呈碱性),为了减轻疼痛,可以涂抹下列哪种物质( ) A.浓硫酸 B.食醋 C.食盐水 D.苏打水或肥皂水(呈碱性)2、酸与碱作用生成盐和水的反应,叫作中和反应,它在工 农业生产和日常生活中有广泛的用途,下列应用一定与中和反应原理无关的是( ) A.服用含Al(OH)3的药物治疗胃酸过量 B.使用熟石灰改良酸性土壤 C.用熟石灰和硫酸铜配制波尔多液 D.用NaOH溶液洗涤石油产品中的残余硫酸
初中化学第十单元 酸和碱课题2 酸和碱的中和反应图片ppt课件: 这是一份初中化学第十单元 酸和碱课题2 酸和碱的中和反应图片ppt课件,共21页。PPT课件主要包含了提出问题,无明显现象,中和反应,处理工业废水,请听下一讲溶液的PH等内容,欢迎下载使用。
人教版九年级下册课题2 酸和碱的中和反应备课课件ppt: 这是一份人教版九年级下册课题2 酸和碱的中和反应备课课件ppt,共21页。PPT课件主要包含了学习目标,证明反应物被消耗,证明有新物质生成,约2ml,Na+,OH-,H2O,旁观者,Cl-和Na+,酸性土壤等内容,欢迎下载使用。
人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应课前预习ppt课件: 这是一份人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应课前预习ppt课件,共25页。PPT课件主要包含了酸和碱能发生反应,中和反应,用于医疗,改良土壤,处理工厂废水,用于生活等内容,欢迎下载使用。













