



高中化学鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表教课内容ppt课件
展开学习任务1 第3周期Na、Mg、Al失电子能力的比较
NO.1 自主学习·夯实基础
1.元素原子失电子能力的比较依据(1)比较元素的单质与水(或酸)反应置换出氢气的难易程度。置换反应越容易发生,说明元素原子失电子的能力越强。(2)比较元素最高价氧化物对应水化物的碱性强弱。一般来说,碱性越强,说明元素原子失电子的能力越强。
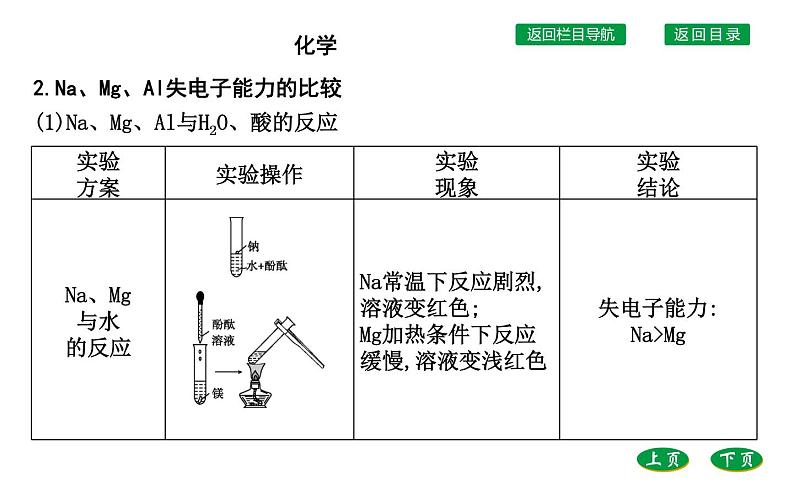
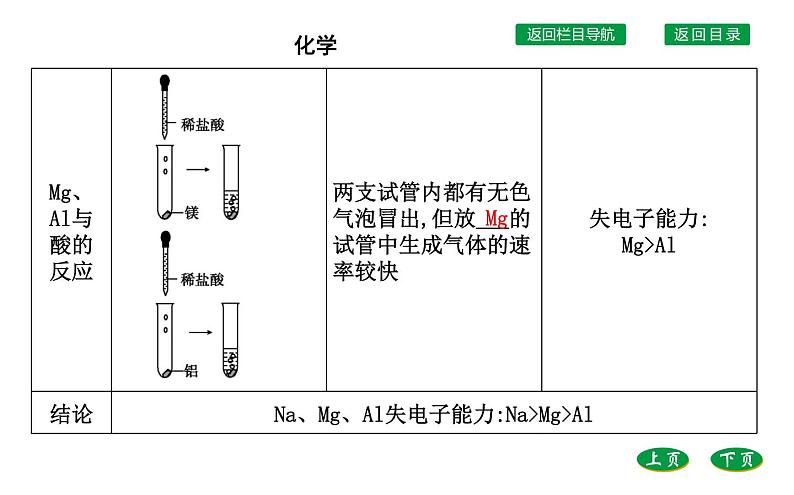
2.Na、Mg、Al失电子能力的比较(1)Na、Mg、Al与H2O、酸的反应
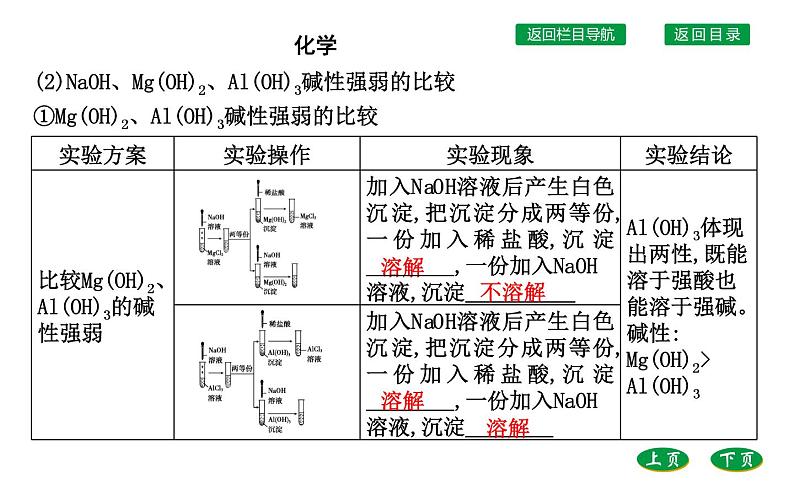
(2)NaOH、Mg(OH)2、Al(OH)3碱性强弱的比较①Mg(OH)2、Al(OH)3碱性强弱的比较
②NaOH、Mg(OH)2、Al(OH)3碱性强弱的比较
3.Al(OH)3的两性(1)类似于Al(OH)3这样既能与强酸反应也能与强碱反应的氢氧化物,叫作两性氢氧化物。
NO.2 互动探究·提升能力
探究 金属元素原子失电子能力的判断问题1:通过前面的实验我们已经知道失电子能力Na>Mg>Al,你能从结构角度解释其原因吗?
金属活动性顺序表是中学化学判断溶液中金属的置换顺序的准则,思考并回答下列问题。
提示:Na、Mg、Al同为第3周期元素,电子层数同为3,但是核电荷数依次增加,原子半径依次减小,原子核对最外层电子的吸引力增强,导致失电子越来越难。
提示:金属的置换反应的实质是氧化还原反应。活泼的金属原子失电子,不活泼金属离子得到电子变为单质,说明活泼金属原子失电子能力更强。所以金属活动性顺序表可以作为判断金属元素原子失电子能力的依据,活泼的金属原子失电子能力强。
问题3:从上述的置换反应可知,还原性Fe>Cu,氧化性Cu2+>Fe2+,失电子能力Fe>Cu,是否可以说金属阳离子的氧化性越弱,对应金属元素原子的失电子能力越强呢?
提示:在大多数情境下,失电子能力、还原性、金属性是一致的。
问题4:元素原子的失电子能力、物质的还原性、金属单质的金属性之间有何关系?
判断物质金属性强弱的依据(1)根据金属活动性顺序判断在金属活动性顺序中,越活泼的金属,其元素的金属性越强,原子的失电子能力越强。(2)根据元素的最高价氧化物对应的水化物(最高价氢氧化物)的碱性强弱判断最高价氢氧化物的碱性越强,对应元素的金属性越强。如NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物,则金属性强弱顺序:Na>Mg>Al。(3)根据金属单质与水或酸反应置换出氢气的难易判断金属单质与水或酸反应置换出氢气越容易、反应越剧烈,则对应元素的金属性越强。如Fe与稀盐酸反应放出氢气,Cu与稀盐酸不反应,则金属性:Fe>Cu。
凝练素养:通过对金属元素原子失电子能力的探究,培养学生对化学现象的理论推导能力,利于判断金属元素原子失电子能力模型的形成。
1.现有金属元素A、B、C,B的最高价氧化物的水化物的碱性比A的最高价氧化物的水化物的碱性强;A可以从C的盐溶液中置换出C。则这三种元素的金属性由强到弱的顺序正确的是( )A.A>B>C B.B>A>CC.B>C>A D.C>B>A
NO.3 应用体验·形成素养
解析:B的最高价氧化物的水化物的碱性比A的最高价氧化物的水化物的碱性强,则元素B的金属性比元素A的强;A可以从C的盐溶液中置换出C,则元素A的金属性比元素C的强。
2.下列不能作为判断金属性强弱依据的是( )A.金属元素单质的沸点高低B.金属活动性顺序表中金属的位置C.金属与水反应置换出氢气的难易程度D.最高价氧化物对应水化物的碱性强弱
解析:A.金属元素单质的沸点高低与金属性无关;B.金属活动性顺序表中,金属的位置越靠前,金属越活泼,金属性越强;C.金属性越强,金属与水反应置换出氢气越容易;D.金属性越强,最高价氧化物对应水化物的碱性越强。
3.对Na、Mg、Al的有关性质的叙述正确的是( )A.碱性:NaOH
解析:Na、Mg、Al金属原子失电子能力逐渐减弱,单质的还原性逐渐减弱,故氧化性:Na+< Mg2+ < Al3+,最高价氧化物对应水化物的碱性逐渐减弱,离子半径:Na+> Mg2+ > Al3+。
学习任务2 第3周期Si、P、S、Cl得电子能力的比较
1.元素原子得电子能力的比较依据(1)比较元素的单质与氢气化合的难易程度,以及所生成的气态氢化物的稳定性。一般来说,反应越容易进行,生成的气态氢化物越稳定,表明元素原子得电子的能力越强。(2)比较元素的最高价氧化物对应水化物的酸性强弱。一般来说,元素的最高价氧化物对应水化物的酸性越强,表明元素原子得电子的能力越强。
2.Si、P、S、Cl得电子能力的比较
3.同周期主族元素原子得失电子能力的递变规律(1)规律:同一周期主族元素中,从左往右,随着原子序数的递增,元素原子的失电子能力逐渐 、得电子能力逐渐 。(2)对于每一个周期,自左至右,随着原子序数的递增,由 元素过渡到不太活泼的金属元素,再过渡到 元素,最后是 元素。(3)理论解释同周期主族元素,从左到右,原子的核外电子层数相同,核电荷数依次 ,原子半径逐渐 ,原子核对核外电子的吸引力逐渐 ,原子的失电子能力逐渐 、得电子能力逐渐 。
探究 非金属元素的非金属性强弱
提示:可以。O2在反应中作氧化剂,所以氧化性O2>N2,表明得电子能力O>N,即非金属性O>N。
问题2:如何通过实验证明H3PO4的酸性强于H2SiO3?
问题3:元素原子得(失)电子数目越多,得(失)电子能力越强吗?
提示:不一定。元素原子得(失)电子能力与得(失)电子的难易有关,而与得(失)电子的多少无关。
问题4:“同一周期非金属元素的氧化物对应水化物的酸性从左到右依次增强”的说法正确吗?
提示:不正确。同一周期,随着原子序数的递增,非金属元素的最高价氧化物对应水化物(即最高价含氧酸)的酸性逐渐增强,但低价含氧酸(如HClO)不符合此规律。
提示:向Na2SiO3溶液中加入H3PO4溶液,产生白色浑浊,则证明H3PO4的酸性强于H2SiO3。
非金属元素的非金属性强弱的判断(1)非金属元素单质的置换反应中,非金属性强的可以置换出非金属性弱的。(2)单质与氢气化合反应越易,其元素的非金属性越强。(3)气态氢化物的稳定性越强,其元素的非金属性越强。(4)最高价氧化物对应水化物的酸性越强,其元素的非金属性越强。(5)元素的简单阴离子还原性越强,其元素的非金属性越弱。
题点一 元素的非金属性强弱的比较1.(2021·江西宜春月考)a、b两元素原子的电子层数相同,如果a原子半径比b的大,则下列判断正确的是( )A.两元素形成的最高价氧化物对应的水化物的酸性应是a强于b B.a的气态氢化物比b的气态氢化物稳定C.a的金属性比b的金属性强D.a的阴离子比b的阴离子还原性弱
解析:由题意分析可知,a的金属性强于b,则两元素形成的最高价氧化物对应的水化物的碱性应是a强于b,A不正确,C正确;由题意分析可知,b的非金属性强于a,则b的气态氢化物比a的气态氢化物稳定,B不正确;由题意分析可知,b的非金属性强于a,即b单质的氧化性强于a单质的氧化性,则a的阴离子比b的阴离子还原性强,D不正确。
2.(2021·甘肃兰州月考)下列叙述不能说明M比N的非金属性强的是( )①非金属单质M能从N的化合物中置换出非金属单质N②熔点:M>N③单质M跟H2反应比单质N跟H2反应更容易④气态氢化物水溶液的酸性:HmM>HnN⑤最高价氧化物对应水化物的酸性:HmMOx>HnNOy⑥M原子比N原子得到的电子数多A.④⑥ B.①③⑤ C.②④⑥ D.全部
解析:①非金属单质M能从N的化合物中置换出非金属单质N,则非金属性M比N强;②熔点高低不能作为元素非金属性强弱的判断依据;③非金属单质越容易与氢气化合,对应元素的非金属性越强,则M的非金属性比N强;④不能利用氢化物的水溶液的酸性比较非金属性的强弱;⑤最高价氧化物对应水化物的酸性:HmMOx>HnNOy,则非金属性M比N强;⑥不能根据得失电子的多少判断元素的非金属性强弱,应该利用得失电子的难易程度进行判断。综上所述,C项符合题意。
题点二 同周期元素性质的递变规律3.(苏教必修第一册P125,T2)在同一周期的元素中(除稀有气体元素外),随着原子序数的递增,下列说法中不正确的是( )A.最外层电子数逐渐增多B.原子半径逐渐减小C.元素原子的失电子能力逐渐增强D.元素的非金属性逐渐增强
解析:同一周期自左至右,随着原子序数的递增,元素原子的失电子能力逐渐减弱,得电子能力逐渐增强,C错误。
4.(2021·湖南长沙期末)对于原子序数依次增大的11~17号元素,下列说法中不正确的是( )A.原子半径逐渐减小B.电子层数逐渐增多C.最高正化合价逐渐增大D.元素的金属性逐渐减弱,非金属性逐渐增强
解析:同周期主族元素自左向右,原子半径逐渐减小,A正确;第3周期元素的核外电子层数均是3,B不正确;同周期主族元素自左向右,最外层电子数逐渐增大,则最高正化合价逐渐增大(O、F除外),C正确;同周期自左向右,元素的金属性逐渐减弱,非金属性逐渐增强,D正确。
同周期主族元素原子结构与性质的递变规律
凝练素养:通过对同周期元素性质的递变规律多角度的考查,明确物质原子结构的改变导致性质的改变,加强宏观辨识与微观探析素养。
1.误认为金属元素原子失掉的电子数越多,其金属性就越强。其实不然,金属元素的金属性强弱与失电子难易程度有关,与失电子多少无关。2.误认为非金属元素的氢化物水溶液的酸性越强,其非金属性越强。其实不然,非金属元素的非金属性强弱可通过比较最高价含氧酸的酸性强弱来判断,与氢化物水溶液的酸性强弱无关。3.误认为酸性H2SO4强于HClO,所以非金属性S比Cl强。其实不然,要比较非金属性强弱需要通过比较最高价含氧酸的酸性强弱。4.误认为同周期主族元素从左到右,随着核电荷数的增加,离子半径依次减小。其实不然,非金属元素原子得电子形成的离子比金属元素离子多一个电子层,半径要更大。
在学习了第3周期非金属元素的非金属性强弱(得电子能力)的比较以后,某校化学研究性学习小组设计了一组实验来探究这一规律。该小组的同学根据元素的非金属性与对应最高价含氧酸之间的关系,设计了如图装置,探究非金属元素的非金属性强弱的比较问题。已知:高锰酸钾在常温下与浓盐酸反应产生氯气;H2SiO3是难溶于水的一种白色沉淀。
(1)如果C中装饱和H2S溶液,A中装浓盐酸,B中装高锰酸钾粉末,则B中反应的离子方程式为 。反应开始后观察到的现象是C中产生淡黄色沉淀,证明氯的非金属性比硫的非金属性 (填“强”“弱”或“无法判断”)。
解析:(2)浓盐酸和高锰酸钾反应产生氯气,氯气将碘离子氧化为碘单质,碘单质遇到淀粉溶液变蓝色。
(2)利用如图装置证明Cl2的氧化性强于I2的氧化性。则A中装浓盐酸,B中装高锰酸钾粉末,C中装淀粉-KI溶液,则C中的现象是 。
答案:(2)淀粉-KI溶液变蓝色
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明非金属性:N>C>Si。C中装试剂 ,实验现象为 。该装置存在不足之处,改进措施为 。
解析:(3)现有浓硝酸、大理石(碳酸钙)、澄清石灰水、硅酸钠溶液,选择试剂用题图装置证明酸性:HNO3>H2CO3>H2SiO3,因此先加入硝酸和碳酸钙反应生成二氧化碳,二氧化碳通入硅酸钠溶液生成硅酸沉淀,则C中装试剂硅酸钠溶液,现象为有白色沉淀生成;浓硝酸具有挥发性,要防止硝酸和硅酸钠反应的干扰,所以应在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶。
答案:(3)硅酸钠溶液 有白色沉淀生成 在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶
化学必修 第二册第3节 元素周期表的应用图片课件ppt: 这是一份化学必修 第二册第3节 元素周期表的应用图片课件ppt,共56页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用课文课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用课文课件ppt,共54页。PPT课件主要包含了NO1,逐渐增加,逐渐减小,逐渐减弱,逐渐增强,NO2,NO3等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用图片ppt课件: 这是一份高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用图片ppt课件,共41页。PPT课件主要包含了[知识梳理],无色气泡冒出,无现象,不反应,注意对比实验现象,不溶解,NaOH,NaMgAl,SiH4,PH3等内容,欢迎下载使用。













