






鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表图片课件ppt
展开
这是一份鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表图片课件ppt,共25页。PPT课件主要包含了讲解内容,答案C,思路点拨,专题集训,答案1碳钠,答案3等内容,欢迎下载使用。
1.元素“位、构、性”的关系所谓的元素“位、构、性”的关系是指元素在周期表中的位置(周期、族)、原子结构(电子层数、最外层电子数)、元素性质(金属性、非金属性等)之间的相互关联及相互推导。其主要类型如下:(1)从元素的原子结构推测元素在周期表中的位置及有关性质。(2)从元素在周期表中的位置推测元素的原子结构及相关性质。(3)元素的一些主要性质能反映元素的原子结构和元素在周期表中的位置。
2.元素“位、构、性”关系模型
(1)原子结构与元素在周期表中位置的关系
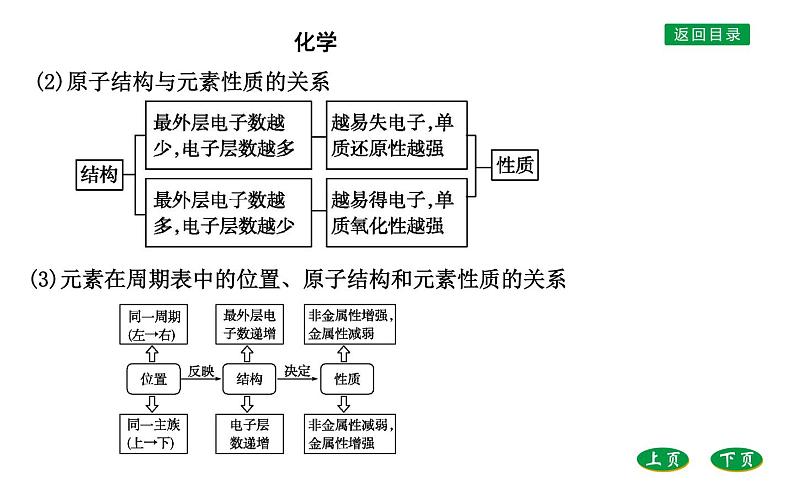
(2)原子结构与元素性质的关系
(3)元素在周期表中的位置、原子结构和元素性质的关系
[典型例题] X、Y、Z均为元素周期表中前20号元素,Xa+、Yb-、Z(b+1)-的电子层结构相同。下列说法正确的是( )A.已知mXa+与nYb-,得m+a=n-bB.离子半径:Yb->Z(b+1)->Xa+C.Z(b+1)-的还原性一定大于Yb-D.气态氢化物的稳定性Hb+1Z一定大于HbY
解析:Xa+、Yb-、Z(b+1)-的电子层结构相同,则Y和Z是位于同一周期相邻位置且Y在右边的非金属元素,X为位于Y和Z的下一周期的金属元素。因为m Xa+与nYb-的电子层结构相同,所以m-a=n+b,A错误;由上述分析可知,原子序数Z Xa+,B错误;Y和Z位于同一周期,Y在右边,所以Y的非金属性强于Z,Y单质的氧化性强于Z单质, Z(b+1)-的还原性强于Yb-,C正确;由C可知,Y的非金属性强于Z,所以气态氢化物的稳定性Hb+1Z一定小于HbY,D错误。
电子层结构相同的简单阴、阳离子,一定处于相邻周期,且阴前阳后。
[跟踪训练1] A、B、C均为短周期元素,它们在周期表中的位置如图所示。已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C两元素的原子序数之和是A元素原子序数的4倍,则符合A、B、C的一组元素是( )A.Be、Na、AlB.B、Mg、SiC.O、P、ClD.C、Al、P
解析:由于A、B、C为短周期元素,从图中A、B、C的位置看,A只能处于第2周期,而B、C处于第3周期。设A的原子序数为x,则B的原子序数为x+8-1=x+7,C的原子序数为x+8+1=x+9,则x+7+x+9=4x,x=8,所以A、B、C的原子序数分别为8、15、17,对应的元素分别为O、P、Cl,代入族序数关系:5+7=2×6成立。
[跟踪训练2] 如图所示,a、b、c、d、e 为元素周期表中前 4 周期的一部分元素。下列有关叙述正确的是( )A.元素 b 位于ⅥA 族,有+6、-2 价两种常见化合价B.五种元素中,元素 e 的性质最稳定C.元素 c 和 d 的最高价氧化物对应的水化物的酸性:c>dD.元素 c 和 e 的气态氢化物的稳定性:c>e
解析:a、b、c、d、e为元素周期表中前4周期的一部分元素,根据元素所在位置,可推知a为He、b为O、c为P、d为Cl、e为As。元素b为氧元素,位于ⅥA族,但氧元素没有+6价,故A错误;五种元素中,元素a(He)的性质最稳定,故B错误;由上述分析可知,非金属性d>c,则最高价氧化物对应水化物的酸性c< d,故C错误;由上述分析可知,非金属性c>e,则气态氢化物的稳定性c>e,故D正确。
1.P、Q均为短周期元素,且aPn-比bQm+的电子层数多。下列说法正确的是( )A.Q可能是第1周期元素B.P和Q—定位于相邻的两个周期C.a一定比b小D.a+m+n-b的值一定为8
解析:P、Q均为短周期元素,aPn-比bQm+的电子层数多,则P、Q可能同为第2周期或第3周期元素,即a+n=10、b-m=2或a+n=18、b-m=10,也可能Q为第1周期元素而P为第2或第3周期元素,即a+n=10、b-m=0或a+n=18、b-m=0,还可能Q为第2周期元素而P为第3周期元素,即a+n=18、b-m=2。通过上述分析知,Q可能为第1周期、第2周期或第3周期元素,A项正确;P和Q可能为同一周期元素,B项错误;a一定比b大,C项错误;a+m+n-b的结果有四种可能:8、10、16、18,D项错误。
2.X、Y、Z、W为4种短周期元素,已知X、Y同周期且X的最外层电子数与Z的内层电子数之和为8,Y2+、Z-、W+三种离子的电子层结构相同。下列叙述正确的是( )A.原子序数:Z > YB.离子半径:W > XC.金属性:Y > WD.气态氢化物的稳定性:X PC.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应D.Z的氧化物既能溶解于Y的最高价氧化物对应水化物的水溶液中,也能溶解于P的氢化物的水溶液中
解析:根据原子半径的递变规律知,X为O,Y为Na,Z为Al,M为Si,N为S,P为Cl。一般来讲,电子层数越多,离子半径越大,所以简单离子半径S2->Al3+,A项错误;非金属性Cl>S,所以简单氢化物的稳定性H2SC>O
(4)B、C、D 三种元素的原子半径从大到小的顺序为 (用元素符号表示)。
相关课件
这是一份高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用课文课件ppt,共47页。PPT课件主要包含了NO1,NO2,点击右图进入等内容,欢迎下载使用。
这是一份苏教版 (2019)必修 第一册第三单元 从微观结构看物质的多样性课前预习课件ppt,共16页。
这是一份鲁科版 (2019)选择性必修2微项目 补铁剂中铁元素的检验——应用配合物进行物质检验备课课件ppt,共28页。PPT课件主要包含了课题探究·素养提升等内容,欢迎下载使用。










