

2021-2022学年辽宁省沈阳市第一二0中学高二上学期第二次质量检测化学试题含答案
展开一、选择题(每题只有一个选项符合题目要求)。
1. 生活中处处有化学,下列有关说法正确的是
A. 天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B. 焊接时用NH4Cl溶液除锈与盐类水解无关
C. 生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D. 在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
2. 下列叙述正确的是
A. 工业制硫酸的接触室中发生反应:。该反应在500℃和催化剂存在下进行,原因是该反应为吸热反应
B. 对于可逆反应N2+3H2⇌2NH3,增大氮气浓度可增加活化分子百分数,从而使反应速率加快
C. 将AlCl3溶液和Al2(SO4)3溶液分别蒸干后再灼烧,所得固体产物均为Al2O3
D. 恒容密闭容器中进行的反应3A(g)⇌B(g)+C(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大
3. 一定温度下,在2 L的密闭容器中发生反应:,反应过程中B、C的物质的量随时间变化的关系如图甲所示;反应达到平衡后,在t1 min、t2 min、t3 min、t4 min分别只改变一种反应条件,逆反应速率随时间变化的关系如图乙所示。下列有关说法正确的是
A. 0~2 min内,v(B)= 0.1 ml/(L·min)
B. t1 min时,改变的条件可能是升高温度
C. t3 min时,改变的条件可能是增大压强,此时c(B)不变
D. t4 min时,可能是使用了催化剂,此时c(B)不变
4. 下列关于反应能量的说法正确的是
A. 一定条件下:①2SO2(g)+O2(g)⇌2SO3(g) ΔH1;②2SO3(g)⇌2SO2(g)+O2(g) ΔH2,则ΔH1<ΔH2
B. 相同条件下,若1 ml H(g)具有的能量为E1,1 ml H2(g)具有的能量为E2,则有2E1=E2
C. 甲烷的燃烧热为890.3 kJ·ml-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·ml-1
D. 已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·ml-1,则含1 ml NaOH的氢氧化钠溶液与含0.5 ml H2SO4的浓硫酸混合放出57.3 kJ的热量
5. 中科院院士董绍俊开辟了电解法分离稀土的新途径,而后她所在的科研小组采用电聚合过程中的掺杂反应研制成电化学传感器,获得同行承认并列入国际上有代表性的“4个研究小组之一”。近日该课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法正确的是
A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. b极的电极反应为MnO2+2H2O+2e-=Mn2++4OH-
D. 若消耗0.01 ml葡萄糖,电路中转移0.02 ml电子
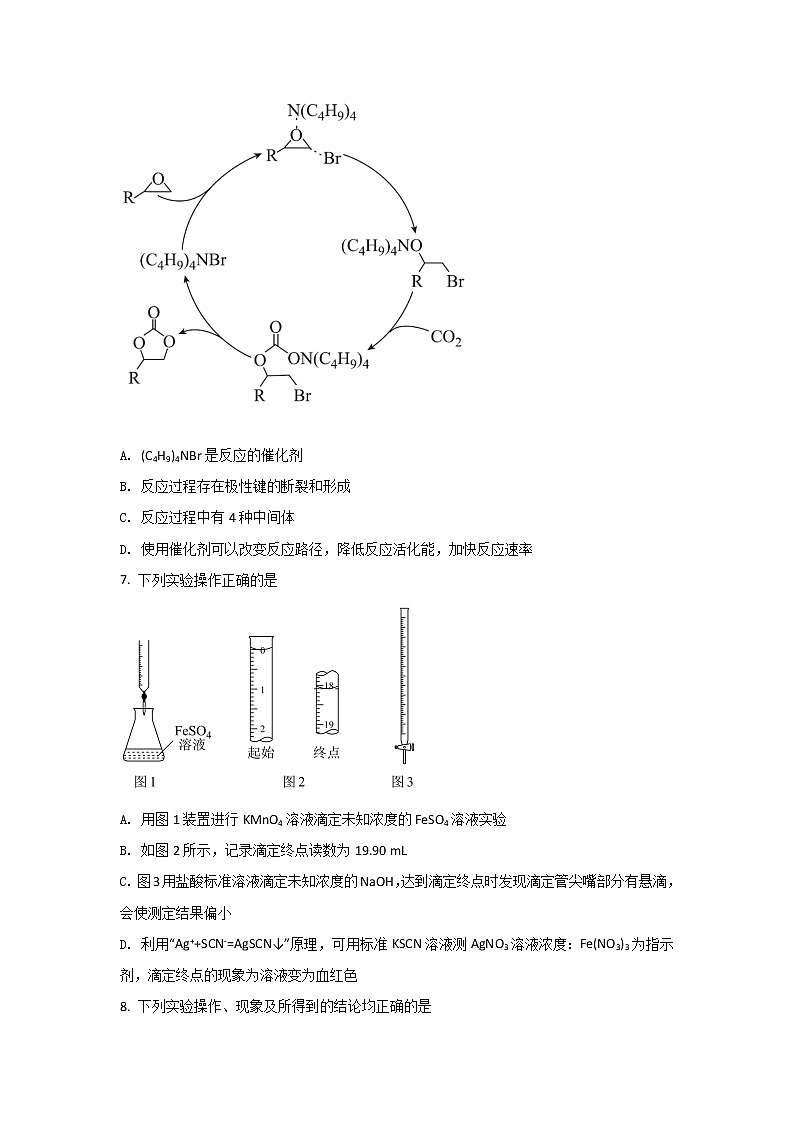
6. 环状碳酸酯广泛用于极性非质子溶剂、电池的电解质等,离子液体研究团队近期报道了一种环氧乙烷衍生物与二氧化碳催化合成环状碳酸酯的反应历程如图所示。已知:R表示烃基。下列说法错误的是
A. (C4H9)4NBr是反应的催化剂
B. 反应过程存在极性键的断裂和形成
C. 反应过程中有4种中间体
D. 使用催化剂可以改变反应路径,降低反应活化能,加快反应速率
7. 下列实验操作正确的是
A. 用图1装置进行KMnO4溶液滴定未知浓度的FeSO4溶液实验
B. 如图2所示,记录滴定终点读数为19.90 mL
C. 图3用盐酸标准溶液滴定未知浓度的NaOH,达到滴定终点时发现滴定管尖嘴部分有悬滴,会使测定结果偏小
D. 利用“Ag++SCN-=AgSCN↓”原理,可用标准KSCN溶液测AgNO3溶液浓度:Fe(NO3)3为指示剂,滴定终点的现象为溶液变为血红色
8. 下列实验操作、现象及所得到的结论均正确的是
A. AB. BC. CD. D
9. 某温度下,向c(H+)=1×10-6 ml·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 ml·L-1。下列对该溶液的叙述错误的是
A. 该温度高于25 ℃
B. 由水电离出来的H+的浓度为1×10-10 ml·L-1
C. 加入NaHSO4晶体抑制水的电离
D. 取该溶液加水稀释100倍,溶液中的c(OH-)减小
10. 已知常温下浓度为0.1ml/L下列溶液的pH如表所示:
下列有关说法正确的是
A. 加热0.1ml/L NaClO溶液测其pH,pH小于9.7
B. 0.1ml/L Na2CO3溶液中,存在关系:
C. 根据上表数据得出三种酸电离平衡常数大小关系为HF>HClO>H2CO3(一级电离平衡常数)
D. pH=2的HF溶液与 pH=12的NaOH溶液以体积比1:1混合,则有c(Na+)=c(F-)>c(H+)=c(OH-)
11. 常温下,向20mL的某稀硫酸溶液中滴入0.1ml·L-1氨水,溶液中水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是
A. 稀硫酸的物质的量浓度为0.05ml·L-1
B. A点时溶液的pH等于7
C. C点时加入氨水的体积为10mL
D. 在V(NH3·H2O)从0到V2的变化过程中,可能出现的离子浓度排序为c(NH)>2c(SO)>c(OH-)>c(H+)
12. 在FeS悬浊液中,存在平衡FeS(s) ⇌Fe2+(aq)+S2-(aq)。欲使FeS固体质量减少,Fe2+浓度不变,可向悬浊液中加入的试剂是
A. CuSO4溶液B. 盐酸C. 蒸馏水D. Na2S
13. t ℃时,已知:Ksp(AgCl)=10-10,Ag2CrO4的沉淀溶解平衡曲线如图所示,则下列说法正确的是
A. t ℃时,Ag2CrO4的Ksp数量级为10-9
B. 无法计算Y点与Z点的Ksp
C. Ag2CrO4(s)+2Cl-(aq)⇌2AgCl(s)+CrO (aq)的平衡常数:K=108
D. 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点变到X点最终变到Z点
14. 丙三酸(用H3A表示)是一种三元有机中强酸。25°C时,向1 ml∙L-1的H3A溶波中遂滴加入NaOH溶液.滴加过程中各种含^微粒的物质的量分数(δ)随溶液pH的变化曲线如图所示,已知醋酸的pKa =4.76(pKa=-lg K,)。下列叙述正确的
A. 25°C时,H3A的第三步电离常数的数量级为10-5
B. b点溶液中,c(Na+)+c(H+)=3c(H2A-)+3c(A3-)+c(OH-)
C. NaH2A的水溶液显酸性,Na2HA的水溶液显碱性
D. 酷酸钠与少量丙三酸反应的离子方程式为3CH3COO-+H3A=3CH3COOH+A3-
15. 有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)2Cl2(g)+2H2O(g) △H。HCl的平衡转化率与Z和T的关系如图所示。
下列说法不正确的是( )
A. △H<0
B. a<4
D. 300 ℃时,该反应平衡常数的值为320
二、填空题
16. 应用化学反应原理知识解决下列问题。
Ⅰ.用0.1ml/L的NaOH溶液滴定未知浓度的醋酸溶液20.00mL,滴定曲线如图,其中点③c(Na+)=c(CH3COO-)+c(CH3COOH)
(1)下列说法正确的是:_______。
A. 点①所示溶液中:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+)
B. 点②所示溶液中:c(Na+)
D 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
(2)点①所示溶液中各粒子浓度(除水分子之外)由大到小的顺序为_______,c(CH3COOH)+c(H+)≈_______。(保留3位有效数字)
Ⅱ.溶度积常数如表
根据表中数据回答下列问题:
(3)废水中含重金属离子Cd2+,除去Cd2+可选用的试剂是_______(填化学式)
(4)常温下,工业氯化铵中含有Fe3+、Al3+等离子,欲除去这两种离子,可加入_______调pH=_______(当溶液中离子浓度小于1×10-6时认为沉淀完全)。
18. 某研究小组进行Mg(OH)2沉淀、溶解和转化的实验探究。
室温下,向3支盛有1 mL 1 ml/L的MgCl2溶液中各加入10滴2 ml/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如表:
(1)2.0ml/L NH4Cl(pH=4)溶液中水电离出来的c(H+)=_______ml/L。
(2)实验ⅱ的目的是:_______。
(3)实验ⅲ的现象是:_______,用化学用语表示该现象的原因:_______。
(4)推测实验ⅰ中沉淀溶解的原因。
推测1:NH4Cl溶液显酸性,溶液中的H+可以结合OH-。
推测2:_______。
(5)为探究ⅰ中沉淀溶解的原因,小组同学继续进行实验:取4 mL 2.0 ml/L NH4Cl 溶液,向其中滴加2滴浓氨水,得到pH=8的混合溶液,再向同样的Mg(OH)2沉淀中加入该溶液,沉淀溶解。上述实验结果证明(4)中_______成立,写出发生反应的离子方程式:_______。
20. 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上用天然气为原料,分为两阶段制备甲醇:
(Ⅰ)制备合成气:CH4(g)+H2O(g) ⇌CO(g)+3H2(g) ΔH= +206.0kJ•ml-1
(Ⅱ)合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) ΔH= -90.67kJ•ml-1
(1)在刚性容器中制备合成气,下列说法中能说明此反应达到平衡状态是_______。
A.体系的压强不再发生变化
B.生成1ml CH4的同时消耗3ml H2
C.各组分的物质的量浓度不再改变
D.体系的密度不再发生变化
E.反应速率v(CH4)=3v(H2)
(2)在一容积可变的密闭容器中充入10ml CO和20ml H2合成甲醇,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
①比较A、B 两点压强大小PA_______PB(填“>、<、=”)
②若达到化学平衡状态 A 时,容器的体积为 10L,如果反应开始时仍充入 10ml CO和20ml H2,则在平衡状态 B 时,容器的体积V(B)=_______L;
(3)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成水蒸气和甲醇,CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)该反应在低温下可自发进行,则ΔH_______0(填“>、=、<”)
②研究表明在二氧化碳合成甲醇的原料气的反应中,保持其它条件不变,采用Ⅰ、Ⅱ、Ⅲ三种催化剂,反应进行相同时间后,CO2的转化率随反应体系的温度变化如图所示;a~d点中反应可能处于平衡状态的点是_______;CO2的转化率a 点比c点高的原因是_______。
③最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示;容易得到的副产物有 CO 和CH2O,其中相对较少的副产物为_______;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的能量变化。
A.*CO → *OCH B.*CO+*OH→*CO+*H2O
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
22. 硼酸(H3BO3)微溶于水,其水溶液显弱酸性,对人体的受伤组织有防腐作用。以硼镁矿(含Mg2B2O5H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及碱式碳酸镁的工艺流程如图:
(1)“滤渣1”的主要成分有_______。
(2)在“过滤2”前,将溶液pH调节至3.5,目的是_______。
(3)H3BO3(一元弱酸)与足量的NaOH溶液反应,生成 NaB(OH)4。写出H3BO3的电离方程式:_______。
(4)用滴定法测定硼酸晶体的纯度。研究结果表明,用0.1ml·L-1NaOH溶液直接滴定硼酸溶液的如曲线①所示,向硼酸溶液中加入多元醇后再滴定如曲线②所示。
请分析,能否用强碱直接滴定硼酸溶液,_______(填“能”或“不能”),理由是:_______。选择合适方法进行滴定,取5g晶体,溶于水配成1L溶液,取出20mL进行滴定,指示剂为_______。平行实验三次,平均消耗0.1ml·L-1NaOH溶液14.10mL,则硼酸晶体的纯度为_______。
(5)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为_______。
答案
1-10 DDDAD CDDDB 11-15 ACCBD
【16题答案】
【答案】(1)ABD (2) ①. c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) ②. 0.0335
(3)Na2S (4) ①. 氨水 ②. 5
【18题答案】
【答案】(1)1×10-4
(2)对比实验 (3) ①. 白色沉淀转变为红褐色沉淀 ②. 3Mg(OH)2(s)+2Fe3+(aq)⇌2Fe(OH)3(s)+3Mg2+(aq)
(4)溶液中c(NH)较大,NH结合OH-使沉淀溶解
(5) ①. 推测2 ②. Mg(OH)2+2NH=Mg2++2NH3·H2O
【20题答案】
【答案】(1)AC (2) ①. < ②. 2
(3) ①. < ②. d ③. a、c点反应正向进行,a 点催化效率高,反应快,相同时间内CO2的转化率大 ④. CH2O ⑤. B
【22题答案】
【答案】(1)、、
(2)转化为,促进析出
(3)
(4) ①. 不能 ②. 没有明显的pH突变区域,无法判断滴定终点,会造成较大误差 ③. 酚酞 ④. 87.42%
(5)选项
实验操作和现象
实验结论
A
向A、B 2支试管中先加入4mL0.1ml·L-1KMnO4酸性溶液,再分别加入2mL0.01ml·L-1H2C2O4溶液和2mL0.02ml·L-1H2C2O4溶液,B试管先褪色
反应物浓度越大,化学反应速率越快
B
室温下,将BaSO4投入饱和Na2CO3溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解有无色无味气体产生
Ksp(BaSO4)>Ksp(BaCO3)
C
向10 mL 0.2 ml·L-1AgNO3溶液中滴入2滴0.1 ml·L-1NaCl溶液,产生白色沉淀后,再滴加2滴0.1 ml·L-1Na2S溶液,有黑色沉淀生成
Ksp(AgCl)>Ksp(Ag2S)
D
在CuCl2溶液中存在如下平衡:[Cu(H2O)4]2+(蓝色)+4Cl-⇌[CuCl4]2-(黄色)+4H2O,加热,该溶液由蓝色变为黄绿色
该反应为吸热反应
溶质
NaF
NaClO
Na2CO3
pH
7.5
9.7
11.6
容器
起始时
T/℃
n(HCl)/ml
Z
Ⅰ
300
0.25
a
Ⅱ
300
0.25
b
Ⅲ
300
0.25
4
化学式
CdCO3
Cd(OH)2
CdS
Al(OH)3
Fe(OH)3
Ksp
5.2×10-12
25×10-14
8.0×10-27
1.0×10-33
2.8×10-38
实验1
实验2:加入试剂
实验现象
取三支试管分别做该实验,再分别作实验2
ⅰ.4 mL 2.0 ml/L NH4Cl 溶液
沉淀溶解
ⅱ.4 mL蒸馏水
沉淀不溶解
ⅲ.10滴0.1ml/L的FeCl3溶液,静置
沈阳市第一二0中学2024届高三上学期第二次质量检测化学试卷(含答案): 这是一份沈阳市第一二0中学2024届高三上学期第二次质量检测化学试卷(含答案),共16页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
辽宁省沈阳市第一二〇中学2023-2024学年高二上学期第二次质量检测化学试题(月考): 这是一份辽宁省沈阳市第一二〇中学2023-2024学年高二上学期第二次质量检测化学试题(月考),共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
辽宁省沈阳市第一二〇中学2023-2024学年高三上学期第二次质量检测化学试题: 这是一份辽宁省沈阳市第一二〇中学2023-2024学年高三上学期第二次质量检测化学试题,共9页。












