



初中化学鲁教版九年级下册第三节 海水“制碱“课文配套课件ppt
展开
这是一份初中化学鲁教版九年级下册第三节 海水“制碱“课文配套课件ppt,共17页。PPT课件主要包含了氨碱法制纯碱,随堂练习等内容,欢迎下载使用。
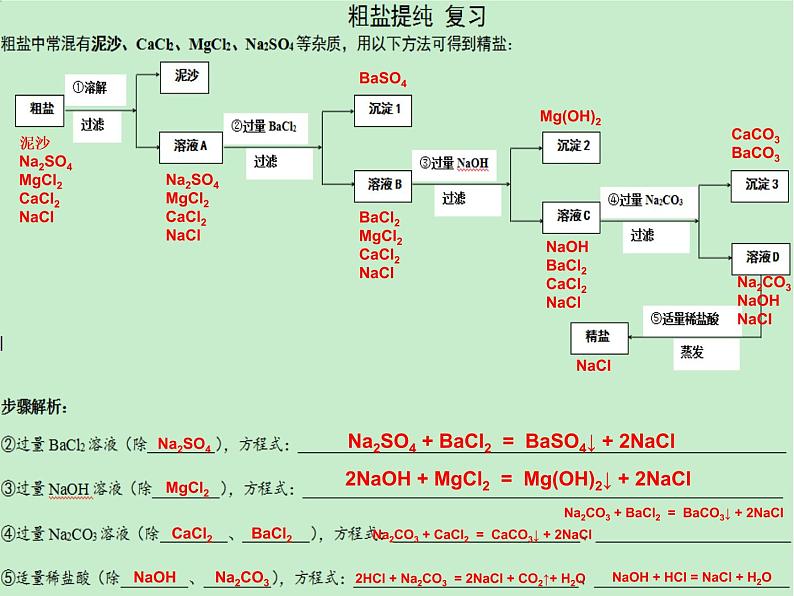
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
2HCl + Na2CO3 = 2NaCl + CO2↑+ H2O
NaOH + HCl = NaCl + H2O
泥沙Na2SO4MgCl2CaCl2NaCl
Na2SO4MgCl2CaCl2NaCl
BaCl2MgCl2CaCl2NaCl
NaOHBaCl2CaCl2NaCl
Na2CO3NaOHNaCl
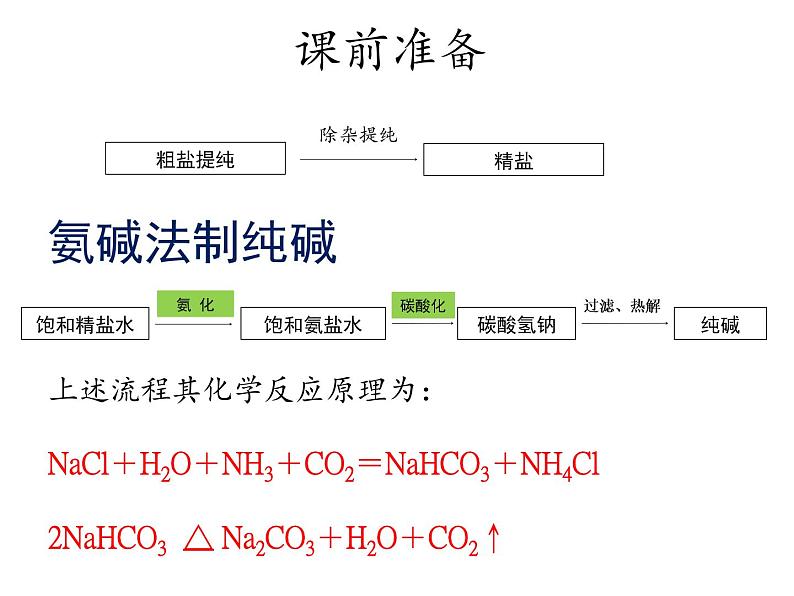
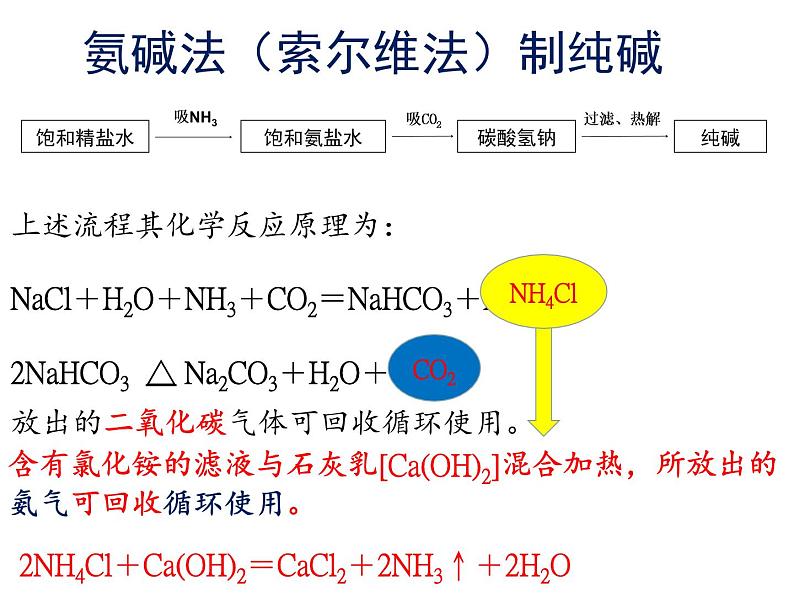
上述流程其化学反应原理为:NaCl+H2O+NH3+CO2=NaHCO3+NH4Cl 2NaHCO3 △ Na2CO3+H2O+CO2↑
碳酸钠(Na2CO3)
(3)用途:玻璃、造纸、纺织和洗涤剂的生产等。
(1)俗名:纯碱、苏打;
(2)纯碱不是碱,是盐(水溶液显碱性);
碳酸氢钠(NaHCO3)(1)俗名:小苏打;(2)性质:能溶于水,受热易分解;(3)用途:灭火、焙制糕点、制造饮料、治疗胃酸过多。
氨碱法(索尔维法)制纯碱
含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
放出的二氧化碳气体可回收循环使用。
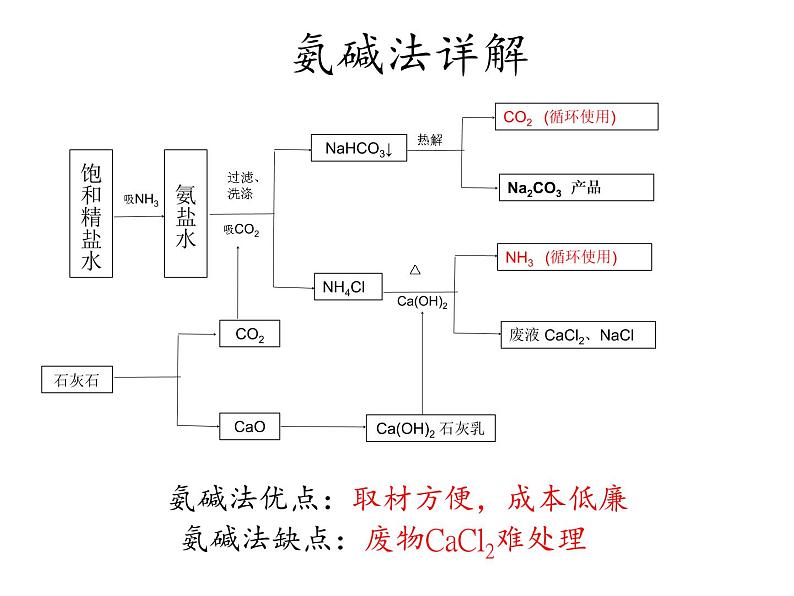
CO2 (循环使用)
废液 CaCl2、NaCl
NH3 (循环使用)
Ca(OH)2 石灰乳
氨碱法优点:取材方便,成本低廉
氨碱法缺点:废物CaCl2难处理
1926年,我国化学家侯德榜在氨碱法的基础上,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法)。侯氏制碱法保留了氨碱法的优点,克服了其缺点,促进了世界制碱技术的发展。
联合制碱(候氏制碱)法详解
联合制碱法优点:无污染,废物再利用
答:氨气是一种极易溶于水的气体,其水溶液显碱性,更易吸收二氧化碳,且吸收的量也较食盐水多。
思考1:为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?
答:碳酸氢钠。因为在同样的条件下,碳酸氢钠的溶解度比氯化铵小,易结晶。
思考2:氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
1.下列有关氨碱法与侯氏制碱法的说法错误的是( )A. 这两种方法都利用了不同物质的溶解能力不同进行分离B. 侯氏制碱法比氨碱法制碱的工艺更绿色环保C. 所用盐水都是除去杂质后的精盐水D. 其产品纯碱是一种用途广泛的碱
2、我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献.下图是侯氏联合制碱法和西方索尔维制碱法的工艺流程.已知有关物质重要反应的化学方程式如下: 2NH4Cl+X═2NH3↑+CaCl2+2H2O NH4Cl △ NH3↑+HCl↑根据以上信息回答下列问题.(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的MgCl2沉淀除去,可以向其中加入过量的烧碱.此时反应的化学方程式为 ,将混合液中不溶物除去的实验方法是 ;溶液中多余烧碱可以加 (填试剂名称)来除去,反应的化学方程式为 .
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl
HCl + NaOH = NaCl + H2O
2、我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献.下图是侯氏联合制碱法和西方索尔维制碱法的工艺流程.已知有关物质重要反应的化学方程式如下: 2NH4Cl+X═2NH3↑+CaCl2+2H2O NH4Cl △ NH3↑+HCl↑(2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通入二氧化碳气体,溶液中会有碳酸氢钠晶体析出.试分析该流程需要“加压”的原因是: .
增大二氧化碳气体的溶解度
2、我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献.下图是侯氏联合制碱法和西方索尔维制碱法的工艺流程.已知有关物质重要反应的化学方程式如下: 2NH4Cl+X═2NH3↑+CaCl2+2H2O NH4Cl △ NH3↑+HCl↑(3)在氨碱工业的历史上,如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”,即在氯化铵溶液中加入物质X (填化学式),产生了可循环使用的氨气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化铵的 ,使氯化铵晶体单独析出得到另一种产品--氮肥.氯化钠溶液则可以循环利用.
相关课件
这是一份初中化学鲁教版九年级下册第三节 海水“制碱“教学ppt课件
这是一份初中鲁教版第三节 海水“制碱“示范课课件ppt,文件包含第八单元第三节海水“制碱”pptx、第八单元第三节海水“制碱”教学设计doc、第八单元第三节海水“制碱”一课一练doc等3份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
这是一份初中化学鲁教版九年级下册第三节 海水“制碱“背景图课件ppt,共15页。PPT课件主要包含了讨论交流等内容,欢迎下载使用。










