






2020-2021学年第二节 盐的性质背景图课件ppt
展开这是一份2020-2021学年第二节 盐的性质背景图课件ppt
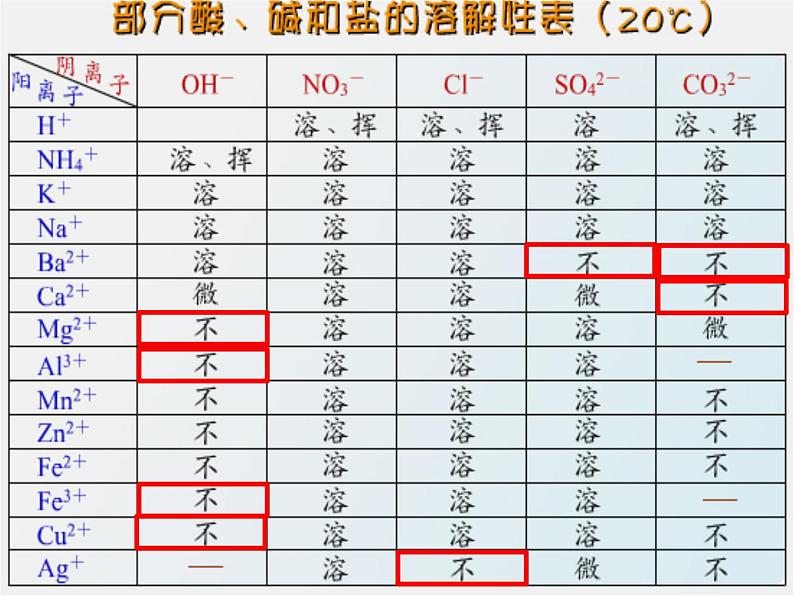
盐的性质☞ 教学目标:1、理解复分解反应的概念2、掌握盐的化学性质☞ 教学重点:盐的化学性质☞ 教学难点:判断复分解反应能否发生硝酸钾 KNO3 硫酸钾 K2SO4硫酸钙 BaSO4 氯化钾 KCl 根据酸碱中和反应生成盐和水的事实,你能说出它们可以用哪些酸和碱反应得到吗? 判断下列盐,哪些不溶?(1) KCl Na2CO3 Cu(OH)2 NH4Cl(2) Ag2SO4 BaCl2 CuSO4(3) AgNO3 AgCl FeCl2 BaSO4(4) BaCO3 Cu(NO3)2 MgSO4☞ 盐的化学性质2AgNO3+Cu = Cu(NO3)2+2AgCuSO4+Fe = FeSO4+Cu反应条件:①反应物盐要溶于水 ②金属要比盐中金属活泼 ③不能用K、Ca、Na(1) 盐+金属 — 新盐+新金属(置换反应)①CuSO4+ Fe = ②BaCl2+ Fe ---- ③CaCO3 +Fe-----④CuSO4+ K ----K Ca Na太活泼CaCO3不溶于水Ba不在金属活动性顺序判断下列反应能否发生?FeSO4 + CuAgNO3 + HCl = AgCl↓+ HNO3(2) 盐 + 酸 — 新盐 + 新酸CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O条件:①所有碳酸盐都能与酸反应 ②符合复分解反应发生条件①BaCl2 + HCl ------②BaCl2 + H2SO4 === ③CuSO4 + HCl -----⑤CaCO3+2HCl == ⑥CaCO3 +H2SO4 ==④CuSO4 + H2SO4 ------⑦AgNO3 + HCl ==判断下列反应能否发生?BaSO4↓+ 2HClCaCl2+CO2↑+H2OCaSO4+H2O+CO2↑AgCl ↓ +HNO3CuSO4+2NaOH = Cu(OH)2 + Na2SO4Na2SO4+Ba(OH)2 = BaSO4 + 2NaOHNH4Cl+NaOH = NaCl+H2O+NH3反应条件:①反应物溶于水; ②符合复分解反应发生条件(3)盐+碱 —— 新盐+新碱③CuSO4+2NaOH ---④CuSO4 + Mg (OH)2 ---- ①BaCl2 + NaOH -----②BaCl2 + Mg(OH)2-----⑤CaCO3 + NaOH ----- ⑥CaCO3 + Mg(OH)2----Mg(OH)2不溶Mg(OH)2不溶CaCO3不溶反应物不溶判断下列反应能否发生?Cu(OH)2↓+Na2SO4AgNO3+NaCl = AgCl +NaNO3BaCl2+CuSO4 = BaSO4 +CuCl2反应条件:①反应物溶于水; ②符合复分解反应发生条件。(4)盐+盐 — 新盐+新盐BaCl2 + CaCO3 -----CuSO4+ CaCO3 -----BaCl2 + CuSO4=== CaCO3不溶CaCO3不溶NaCl + AgNO3 == BaCl2+2AgNO3 == 判断下列反应能否发生?CuCl2+BaSO4↓ AgCl ↓ +NaNO32AgCl ↓+Ba(NO3)2金属新盐+金属酸新盐+新酸新盐+新碱盐新盐+新盐碱小结:对应题型:物质、离子共存问题1、下列物质在水中能大量共存的是( )A、H2SO4 Na2SO4 NaOHB、Ca(OH)2 KCl K2CO3C、NaCl Na2CO3 KNO3D、CuSO4 NaOH Na2SO4 2、在盛有稀硫酸的烧杯中,分别加入下列物质,最终只存在无色液体的是( )A、BaCl2溶液、NaOH溶液B、Na2CO3溶液、KOH溶液C、Fe2(SO4)3溶液、NaNO3溶液D、Cu片、 Na2SO4溶液 1、判断下列化合物属于盐的是( )A、Na2O B、Mg(OH)2 C、H2SO4 D、NH4Cl E、Na2CO3 2、把金属X放入CuCl2溶液中有红色物质析出,放入MgCl2溶液中无现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是( )A.Mg、X、Cu B.Cu、X、Mg C.Mg、Cu、X D.X、Mg、Cu 3、下列四种金属中,有一种金属的盐溶液与其他三种金属都能发生置换反应,这种金属是( )A.Fe B.Ag C.Zn D.Cu4、有一包固体粉末,可能由CaCO3、Na2SO4、KNO3、CuSO4、BaCl2中的一种或几种组成,通过实验得到以下结果:(1)将此固体粉末加到水中,得到白色沉淀,上层清液为无色;(2)该白色沉淀不溶于稀硝酸。从实验中判断,该粉末中一定含有 ,一定不含 ,可能含有 。
相关课件
这是一份初中化学北京课改版九年级下册第二节 盐的性质课堂教学课件ppt,共20页。PPT课件主要包含了教学目标,达标反馈等内容,欢迎下载使用。
这是一份北京课改版九年级下册第二节 盐的性质课前预习ppt课件,共18页。PPT课件主要包含了复分解反应,问题的提出,H2O,H2SO4,CuOH2,SO4,酸+碱盐+水,碱的溶解规律,NO3,酸+盐新酸+新盐等内容,欢迎下载使用。
这是一份2020-2021学年第二节 盐的性质复习课件ppt,共20页。PPT课件主要包含了走进厨房,观察生活,观察生活1,碳酸氢钠和醋酸反应,观察生活2,CaO,CuSO4,H2O,观察生活3,观察生活4等内容,欢迎下载使用。













