






初中化学北京课改版九年级下册第9章 溶液综合与测试复习ppt课件
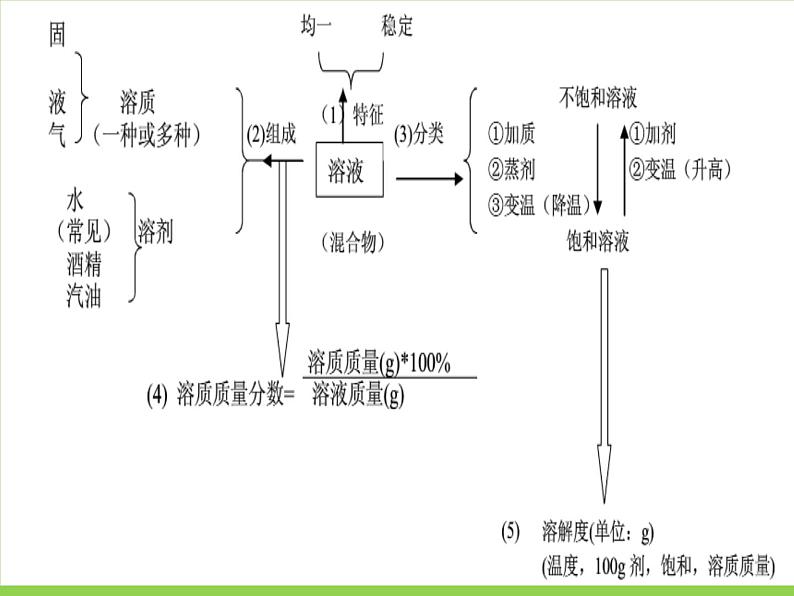
展开这是一份初中化学北京课改版九年级下册第9章 溶液综合与测试复习ppt课件,共42页。PPT课件主要包含了知识回顾,悬浊液,乳浊液,物质的分散,洗涤剂,饱和溶液,不饱和溶液,浓溶液,稀溶液,定量表示等内容,欢迎下载使用。
1.自制汽水十分有趣,但要注意安全。若试剂用量不当,选用的瓶不结实,不能承受一定的压力,可能会发生爆炸事故。注意了用量、选用厚实完好的瓶子,你就不用害怕,大胆地去做。2.碳酸氢钠和柠檬酸应选用食品级的。实验用品:饮料瓶、药匙。凉开水、白糖、小苏打、柠檬酸、果汁。 实验报告:
如图所示,取一只500 ml干净的饮料瓶,向瓶中加入2匙白糖和适量的果汁加入约1.5 g小苏打,注入凉开水,不要太满,再加入约1.5 g柠檬酸,立即旋紧瓶盖,摇匀,放入冰箱。大约半小时后就可以饮用。
自制汽水中涉及到的有关溶液问题:
思考与交流:1、汽水怎么形成的?汽水的特征有哪些?它属于溶液吗?2、若汽水是溶液,那么溶质有那些?影响蔗糖溶解的因素有哪些?设计实验证明?3、有些物质溶解时温度会变化怎么解释?4、为什么不能随意增加柠檬酸和小苏打的用量?5、汽水制作为什么用凉开水?夏天喝汽水为什么可以解热?6、固体溶解度影响因素和气体一样吗?自然界冬捞碱夏捞盐怎么解释?7、配制汽水时,向水中不断加入蔗糖,其溶液浓度怎么变化?问题1解决⑴⑵ 、 问题2解决⑶、 问题7解决⑷ 、 问题4解决⑸
考点1 物质分散过程的过程
[提示] 溶剂判定口诀:固气溶解液为剂,液液互溶多为剂,水多水少总是剂,不指溶剂水为剂。
发生乳化现象,形成稳定的乳浊液
不均一(浑浊)、不稳定(静置出现沉淀)
不均一(浑浊)、不稳定(静置出现分层)
均一(澄清)、稳定(静置无变化)
例:1、下列关于溶液的说法正确的是:
A、均一、稳定的液体都是溶液B、溶液是均一、稳定的纯净物C、溶液是无色透明的液体D、溶液是均一、稳定的混合物
2、下列物质混合能形成溶液的是( )
1植物油---水 2碳酸钙---水 3冰---水 4蔗糖---水 5胆矾------水 6三氧化硫-------水 7少量生石灰----水
例、下列说法正确的是:
A、溶液一定是液体B、在溶液里进行的化学反应,通常比较快 C、50mL酒精和50mL水混合得到100mL溶液D、盐水和糖水都是溶液,两者混合在一起,则不是溶液了
把少量物质分别加入到另一物质中,充分搅拌,可以得到溶液的是 ( )A、碘加入酒精中 B、碳酸钙粉末加入水中 C、牛奶加入水中 D、植物油加入水中。 加入汽油中呢?
练习:13g锌与200g稀硫酸恰好完全反应,在200g稀硫酸中溶质的化学式为( H2SO4 )完全反应后所得溶液的溶质化学式为(ZnSO4)反应后溶液的质量比反应前溶液的质量大(“大”、“小”)
[说明] 溶液的质量等于溶质质量与溶剂质量之和,但溶液的体积不一定等于溶质体积与溶剂体积之和,这是因为在溶解的过程中,构成物质的粒子不停运动,粒子的间隔发生了变化。
如何除去衣服上的油污呢?
[提示] 洗涤油脂的方法有三种,但原理各不相同:(1)用汽油洗涤:溶解油脂。(分子结构相似、有机物易溶于有机溶剂)(2)用洗洁精(洗衣粉/肥皂)洗涤:乳化油脂。(3)用热的纯碱溶液洗涤:与油脂发生化学反应。
考点3 饱和溶液与不饱和溶液
记住特殊: 溶质氢氧化钙
[注意] 1.某饱和溶液是对相应的溶质不能继续溶解的溶液,但还可以溶解其他的物质,如某饱和食盐水中还可以继续溶解硝酸钾固体。2.通过降低温度实现不饱和溶液向饱和溶液的转化,只是针对多数固体溶质而言,对氢氧化钙等溶解度随温度升高而减小的物质是不适用的。3.对某饱和溶液进行降温或蒸发溶剂处理,往往会有溶质从溶液中以晶体形式析出。4.饱和溶液口诀:饱和溶液有条件,确定温度不能变;溶剂定量要注明,不再溶解是关键。
6。有一课外活动小组在饱和的石灰水溶液中,加入少量生石灰,再降至室温,下列对出现的情况,描述完全正确的一组是( ) ①溶液的溶质质量分数不变 ②原饱和溶液的溶剂量减少 ③原饱和溶液的溶质质量减少 ④饱和溶液总质量增加A.① B.①② C.①②③ D.①②③④
[训练2]下列关于溶液的说法正确的是 ( )A.相同温度的NaCl饱和溶液和KNO3饱和溶液充分混合,溶液仍然饱和B.降低温度一定能将某物质的不饱和溶液转化为饱和溶液C.同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大D.不饱和溶液变为饱和溶液,溶质质量分数可能不变
[总结]1.对于不同溶质,浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。2.对于同一物质,相同温度,饱和溶液比不饱和溶液要浓。
在一定温度下,在一定量溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
一种或几种物质分散在另一种物质中,形成的均一的、稳定的混合物
溶质可以是气态、液态或固态
能溶解其它物质的物质叫溶剂
溶剂是液态(水是最常见的溶剂)
一种物质溶解在另一种物质里的能力叫做溶解性
与溶质和溶剂的性质(种类)有关
在一定温度下,在100g溶剂里,当溶液达到饱和状态时,所溶解的溶质的质量
溶解度的大小跟溶质和溶剂的性质(种类)有关。
考点4、物质的溶解性和溶解度
曲线上的点表示某物质在该温度下的溶解度。曲线的交点表示几种物质在该温度下的溶解度相同。
曲线下面所表示的溶液为不饱和溶液。曲线上面(包括曲线)所表示的溶液为饱和溶液。
思考:阴影部分对于A、B 两物质有何意义?
[训练2]右图是A、B两种固体物质的溶解度曲线,根据右图回答下列问题:(1)10℃时,A、B两种物质的溶解度由大到小的顺序为 。(2)溶解度A>B的温度范围为 。(3)20℃时,将20gB物质加入50g水中充分溶解,所形成溶液的质量是 g。(4)若使A物质从它的溶液中大量析出,最适宜的方法是 (填“冷却”或“蒸发”)。(5)50℃时,B物质饱和溶液中溶质的质量分数是 。
【例3】生活中的下列现象不能说明气体的溶解度随温度升高而减小的是( )A.烧开水时,沸腾前有气泡冒 B.喝下汽水时感到有气体冲到鼻腔C.揭开碑酒瓶盖,有大量气泡冒出 D.夏季黄昏,池塘里的鱼常游出水
例.(2014绥化)如图是甲、乙、丙三种固体物质的溶解度曲线,请回答:(1)t2℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是 _________ .(2)P点的含义是 _________ .(3)若将甲物质的不饱和溶液变为饱和溶液,下列说法正确的是 _________ A、溶剂的质量一定变小 B、溶质的质量可能不变C、溶质的质量分数一定变大 D、溶液的质量变大(4)将t2℃时,甲、乙、丙三种物质的饱和溶液,都降温至t1℃时,所得溶液的溶质质量分数由大到小的顺序是 _________ .
[训练1]以下图示中的甲、乙两图分别表示氯化钠在水中的溶解度曲线,丙图表示硝酸钾在水中的溶解度曲线,丁图表示氯化钠在某有机溶剂中的溶解度曲线。 甲 乙 丙 丁请将甲图分别与上述其它曲线对比,回答下列问题。(1)由甲、丁得出:影响固体物质溶解度的因素是 。(2)由甲、丙得出:影响固体物质溶解度曲线陡斜程度的因素是 。因此欲除去硝酸钾中的少量氯化钠,可采用 方法。(3)由甲、乙得出: 也会影响固体物质溶解度曲线的陡斜程度。
当横坐标单位刻度长短不变时,纵坐标单位刻度长短的变化
考点5 溶液组成的表示方法
溶质的质量分数和溶解度比较表
100克 不一定
一定饱和 不一定饱和
克 是比值用%表示
强调:(1)计算溶质质量分数,一般根据定义算 (2)浓溶液的稀释浓缩计算,溶质量不变 (3)有关溶质的质量分数与化学方程式相结合的计算,各物质在化学方程式计算中的质量须是纯净物的质量.
(练习):为测定铜锌合金的组成,某化学小组的同学将150克稀硫酸分三次加入到15克合金中,得出如下数据.请计算: (1)w的值为______.固体中铜的质量是_____ (2)实验所用稀硫酸的质量分数是______
[例2]某温度时,100克稀硫酸与足量的锌充分反应,生成0.2克氢气.反应完全后过滤,计算: (1)硫酸溶液中溶质的质量分数.这些硫酸溶液若用98%(密度为1.84g/cm3)浓硫酸来稀释,则需要浓硫酸和水各多少毫升? (2)反应所得硫酸锌溶液中溶质的质量分数?
根据下表回答问题。(2016上海)① 20℃时,溶解度最大的物质是__________。② 50℃时,100 g水中最多溶解NaCl__________g。③量筒的局部示意见右图,量取水时应沿用__________视线(选填“a”或“b”)进行读数;__________视线(选填“a”或“b”)对应的读数较大。④ A是80℃含有120 g水的KNO3溶液。经过如下操作,得到102 gKNO3固体。A溶液为___________(选填“饱和”或“不饱和”)溶液。对以上过程的分析,正确的是__________(选填编号)。A到B的过程中,溶质质量没有改变B中溶质与溶剂的质量比为 169:100 开始析出KNO3固体的温度在60℃至80℃之间A溶液的质量等于222 g
1.配制步骤:计算、称量、量取、溶解(或稀释)、装瓶存放。[提示] 配制溶液的过程中,一般不用天平称量液体的质量,而是用量筒量取液体的体积。2.主要仪器:托盘天平、药匙、量筒、滴管、烧杯、玻璃棒。
1、结晶:溶液中的溶质形成晶体的过程。2、从溶液中结晶析出晶体的方法主要有:①蒸发溶剂法——— 适用于溶解度受温度影响较小的固体溶质。如蒸发海水获得食盐晶体。②冷却热饱和溶液法——— 适用于溶解度受温度影响较大的固体溶质。如冷却热的硝酸钾饱和溶液获得硝酸钾晶体。
3、注意要点:①析出晶体X后剩余的溶液叫做母液,母液是X的饱和溶液。②采用结晶方法可以对由两种可溶性固体组成的混合物进行分离或提纯。
〖例4〗能依次按溶解、过滤、蒸发三个步骤分离的混合物是( )A、石灰石和食盐 B、水和酒精 C、硝酸钾和氯化钾 D、铁粉和铜粉
〖例5〗现有研细的NaCl和KNO3固体混合物,欲分离得到此2种比较纯净的固体,分离操作的主要步骤是 。按先后次序写出分离操作的四种主要仪器的名称: 。
► 类型三 饱和溶液与不饱和溶液
命题角度:饱和溶液与不饱和溶液的判断与转化。
例3 [泸州] 下列有关饱和溶液的说法中,正确的是 ( )A.饱和溶液的溶质质量分数一定比不饱和溶液的大B.饱和溶液降温析出晶体后的溶液一定是不饱和溶液C.任何饱和溶液升温后都会变成不饱和溶液D.一定温度下,向氯化钠饱和溶液中加入水后会变成不饱和溶液
► 类型四 溶液组成的表示方法
命题角度:联系生产、生活实际,利用溶质质量分数关系式进行简单计算。
例4 对“10%的食盐溶液”含义的解释错误的是 ( )A.100 g水中溶解了10 g食盐B.100 g食盐溶液溶解有10 g食盐C.将10 g食盐溶解于90 g水中所得的溶液D.将食盐与水按1:9的质量比配成的溶液
[解析] “10%”的含义是指100份质量的食盐溶液中含有10份质量的食盐,或10 g食盐溶解于90 g水中得到的溶液为100 g。
变式题 [2012·衡阳] 将80 g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为 ( )A.80 g B.100 gC.200 g D.280 g
[解析] 稀释前后,溶质的质量不变。设需加水的质量为x。80 g×35%=(80 g+x)×10%解得x=200 g,即需加水的质量为200 g。
► 类型五 溶液的配制
命题角度:以实验探究题的形式考查配制溶液所需仪器、操作步骤、操作过程、注意事项及错误操作导致的后果。
(1)需要称取氯化钠的质量是________g,称量时A出现了右盘低的现象,接下来的操作应该是________。①左边的平衡螺母向左调 ②右边的平衡螺母向右调③右盘中减少砝码 ④左盘中增加食盐(2)B中仪器a的名称是________。量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数_______(填“偏大”或“偏小”)(3)C中用玻璃棒搅拌的作用是___________________。(4)D中所贴标签有不妥之处,请划掉不妥的地方,并在方框中写出你认为适合的内容。
相关课件
这是一份化学北京课改版第9章 溶液综合与测试复习课件ppt,共25页。PPT课件主要包含了针对训练,有关溶液的计算,溶质的质量分数,溶质质量等内容,欢迎下载使用。
这是一份化学北京课改版第9章 溶液综合与测试复习ppt课件,共24页。PPT课件主要包含了学习目标,快速抢答,有关溶液的计算,心灵手巧,实验室之旅,第一站溶液的配制,知识小结一,知识小结二,第三站溶解度与结晶,思维导图等内容,欢迎下载使用。
这是一份北京课改版九年级下册第12章 盐综合与测试复习ppt课件,共16页。PPT课件主要包含了走进厨房,观察生活,碳酸氢钠和醋酸反应,观察生活2,CaO,CuSO4,H2O,观察生活3,观察生活4,硫酸亚铁固体等内容,欢迎下载使用。













