






高中化学人教版 (2019)选择性必修1第一节 反应热教学课件ppt
展开2、中和反应反应热的测定
化学反应过程中释放或吸收的热量在生活、生产和科学研究中具有广泛应用。
活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应等
在实际应用中,人们如何定量地描述反应过程中释放或吸收的热量呢?
以盐酸与NaOH溶液的反应为例
如:我们可将盐酸、NaOH溶液及发生的反应等看作一个反应体系,简称体系(又称系统)。
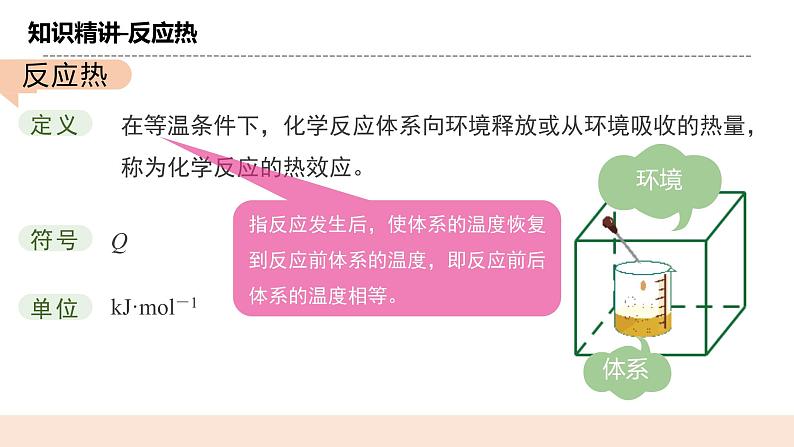
与体系相互影响的其他部分。如:试管、空气等
体系与环境之间存在 交换或 交换。
知识精讲——认识体系与环境
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应。
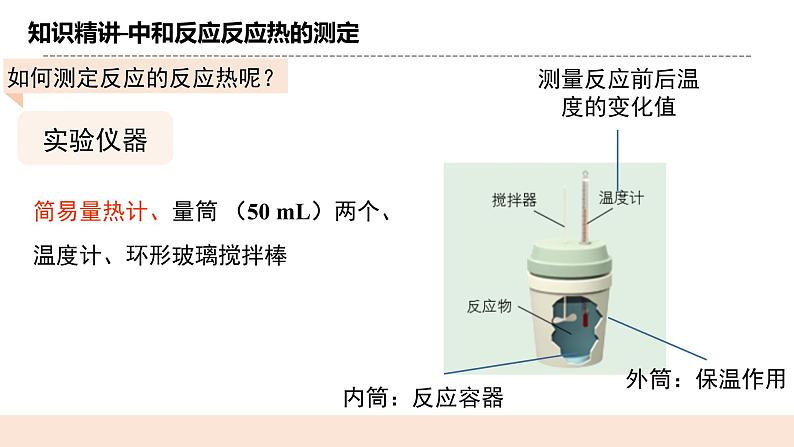
知识精讲——中和反应反应热的测定
Q = mCΔtQ:中和反应放出的热量 m:反应混合液的质量C:反应混合液的比热容 Δt:反应前后溶液温度的差值
50 mL、0.50 ml/L的盐酸50 mL、0.55 ml/L氢氧化钠溶液
测量反应前后温度的变化值
简易量热计、量筒 (50 mL)两个、温度计、环形玻璃搅拌棒
①用量筒量取50 mL 0.50 ml/L盐酸,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取50mL0.55ml/LNaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
即:各反应物温度分别测量,将平均值记为反应前体系的温度(t1)
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)。
Q=(m1+m2) · c · (t2-t1)=0.418(t2-t1)kJ
②反应后生成的溶液的比热容c=4.18J/(g .0C)。
①50 mL盐酸的质量m1=50g, 50 mLNaOH溶液质量m2=50g。
若某次实验的数据与另外两次实验的数据差异明显,将差异明显的数据舍去。
在稀溶液中,强酸跟强碱发生中和反应生成1ml H2O的反应热叫做中和热。
H+(aq)+OH-(aq)=H2O(l); △H = -57.3 kJ/ml
注:由于弱酸、弱碱电离吸热,所以强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1mlH2O放出的热小于57.3kJ.
思考:能否计算出中和热的数值?
思考:化学反应为什么会产生反应热?
这是因为反应前后体系的内能(符号为U)发生了变化。
为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为H)
单位:kJ/ml 或 kJ • ml-1
ΔH=H生成物-H反应物
在等压条件下进行的化学反应,其反应热等于反应的“焓变”
从能量守恒的角度加以分析
反应热:ΔH =H(生成物总能量)-H(反应物总能量)
化学键断裂——吸热 化学键形成——放热
从化学键的角度加以分析
H2(g)+Cl2(g)=2HCl(g)反应的能量变化示意图
ΔH=(436+243)-(431+431) =-183 kJ/ml
高中化学人教版 (2019)选择性必修1第一节 反应热公开课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热公开课课件ppt,共34页。PPT课件主要包含了火箭推进剂,液氢-液氧,煤油-液氧,放热反应,吸热反应,反应热及其测定,学习任务一,中和反应热的测定,-kJ·mol-1,反应热焓变等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第一节 化学反应与能量变化授课课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第一节 化学反应与能量变化授课课件ppt,共25页。PPT课件主要包含了探究一,探究二等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第二节 燃烧热 能源课前预习课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 燃烧热 能源课前预习课件ppt,共31页。PPT课件主要包含了燃烧热,生成物不能继续燃烧,单位kJmol,限定燃料的物质的量,中和热,化石燃料,ADE,思考与交流,随堂练习等内容,欢迎下载使用。














