

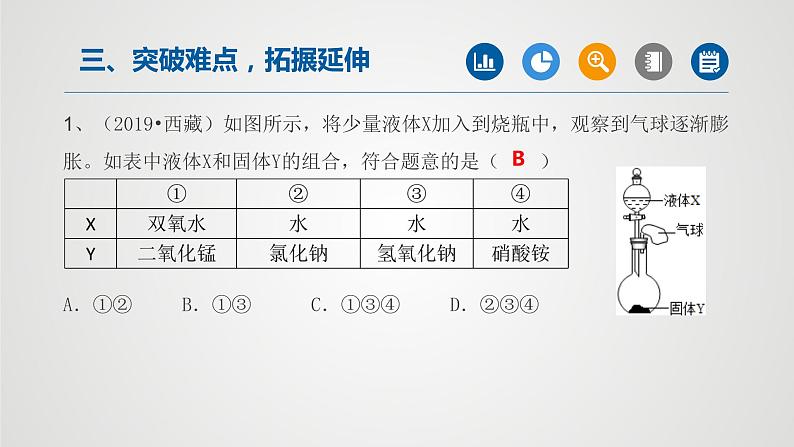


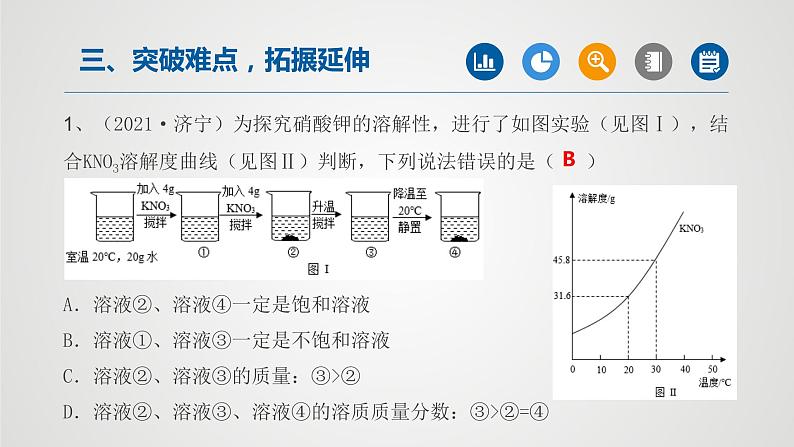
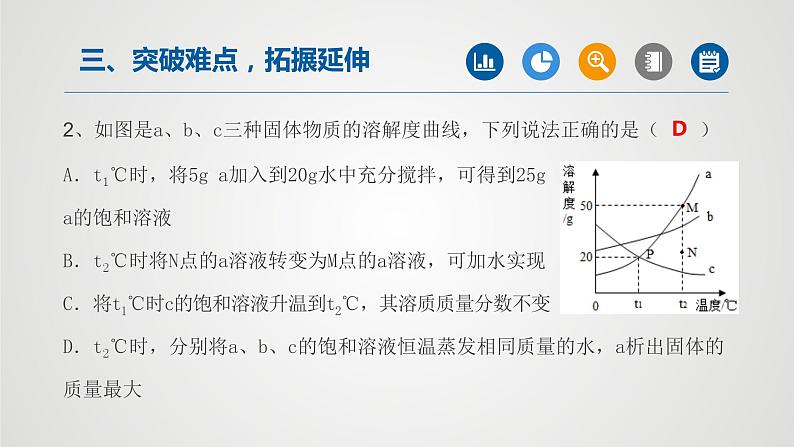

所属成套资源:2022年中考一轮化学【单元复习·夯基】精品课件(人教版)
- 第八单元 金属和金属材料(第3课时)课件PPT 课件 0 次下载
- 第九单元 溶液(第1课时)课件PPT 课件 0 次下载
- 第十单元酸和碱(第1课时)课件PPT 课件 0 次下载
- 第十单元酸和碱(第2课时)课件PPT 课件 0 次下载
- 第十单元酸和碱(第3课时)课件PPT 课件 0 次下载
第九单元 溶液(第2课时)课件PPT
展开
这是一份第九单元 溶液(第2课时)课件PPT,共38页。PPT课件主要包含了溶解度曲线,氯化铜杂质,氢氧化钾水,氯化钾,氢氧化铜,氯化钾水水,氢氧化铜杂质,3g-y,g-y,加溶剂等内容,欢迎下载使用。
三、突破难点,拓搌延伸
1、溶解时的吸热与放热现象:
⑴物质溶解过程中同时存在放热和吸热过程,放热时放出的热被溶液吸收,吸热时吸收溶液的热,放热大于吸热,溶液温度升高,吸热大于放热,溶液温度降低;
⑵溶解时吸热与放热的典型代表: ①放热大于吸热,溶液温度升高的:氢氧化钠、浓硫酸等; ②吸热大于放热,溶液温度降低的:硝酸铵等; ③放热、吸热不明显,温度几乎不变的:氯化钠等。
2、饱和溶液、不饱和溶液:
⑴饱和溶液、不饱和溶液的区分方法 ①溶质全部溶解或没有未溶解的溶质,可能恰好饱和,也可能是不饱和溶液; ②温度和溶剂的量不变若溶液中存在溶质且不再减少,溶液为饱和溶液; ③结晶析出晶体后的溶液为饱和溶液; ④根据溶解度计算进行区分: 某温度下物质溶解度为Sg,则该温度下其饱和溶液中溶质的质量、溶剂的质量、溶液的质量之比为:S:100:(100+S)。
⑵饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系: ①饱和溶液、不饱和溶液与浓溶液、稀溶液分属于两种分类法,饱和溶液、不饱和溶液是按一定温度下、一定量的溶剂里能否继续溶解溶质划分,而浓溶液、稀溶液是按溶液浓度相对大小划分,是相对的。饱和溶液和浓溶液、稀溶液都是交叉关系,不饱和溶液和浓溶液、稀溶液也都是交叉关系;
⑵饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系: ②一定量的溶剂里能否溶解溶质、溶解溶质的多少与温度和物质溶解度大小有关:a.不同溶质在同一温度下溶解度不同,在质量相同的溶剂里,溶解度大的可能没有达到饱和却溶解溶质较多,是浓溶液,溶解度小的达到饱和溶解的溶质较少,是稀溶液;b.同一溶质在不同温度下溶解度也不同,在质量相同的溶剂里,溶解度较大的温度下可能没有达到饱和却溶解的溶质较多,是浓溶液,溶解度较小的温度下达到饱和却溶解的溶质较少,是稀溶液。 由此得出:溶质种类不同、温度不同,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;
⑵饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系: ③温度相同、溶质种类相同,则溶解度一定相同,在相同质量的溶剂里,饱和溶液一定比不饱和溶液里溶解的溶质要多,此时饱和溶液一定比不饱和溶液浓; 由此得出:只有溶质相同、温度相同,饱和溶液才一定比不饱和溶液浓。
(2020•怀化)下列关于溶液的说法正确的是( )A.溶液一定是混合物 B.饱和溶液的浓度比不饱和溶液的浓度一定大C.医用碘酒是碘的水溶液 D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
⑴固体物质结晶方法与提纯方法的选择: ①结晶方法的选择:溶解度随温度升高增大得越快(溶解度曲线撇得越陡),越适合用降温结晶,溶解度随度升高变化越小(溶解度曲线横得越平),越适合用蒸发结晶,溶解度曲线随温度升高减小得越快(溶解度曲线捺得越陡),越适合用升温结晶; ②提纯方法的选择:适合用什么方法结晶的物质,就适合用什么方法提纯。
⑵利用溶解度曲线解题易忽视的三个条件: ①温度:讨论溶解度大小或比较溶解度大小都必须指明在什么温度下; ②溶剂的量:溶解度曲线坐标系内的溶液,溶剂都为100g,溶剂的量都相同,因此利用溶解度曲线上的点解涉及溶液中溶质的质量、结晶析出晶体质量等的题时,一定要注意所给溶液中溶剂的质量或溶液的质量是否相等,否则无意义; ③达到饱和:溶解度曲线上的点都是饱和溶液,因此利用溶解度曲线上的点解一定量溶质加入到一定量的溶剂里、比较溶质的质量分数大小等题时,一定要注意溶液是否会达到饱和或所给的溶液是否是饱和溶液。
⑶利用溶解度曲线比较饱和溶液升温或降温时溶质的质量分数的大小: ①不论是升温还是降温,溶剂的质量均不变,溶解度增大的,溶质质量不变,溶解度减小的,会因结晶析出溶质,溶质的质量减小; ②同一温度下的饱和溶液,溶解度越大,溶质的质量分数越大; ③分析时溶剂的质量均假设为100g,比较溶质的质量分数的大小,只需要比较溶质质量大小即可。
⑷相同质量的溶质配成饱和溶液所需要溶剂质量大小比较: 溶解度越大意味着,相同质量的溶剂里溶解的溶质也就越多,换个说法,溶解度越大,较少的溶剂能溶解较多的溶质; 由此可得出:相同质量的溶剂配成饱和溶液,溶解度越大需要的溶质越多; 相同质量的溶质配成饱和溶液,溶解度越大需要的溶剂越少。
4、有关溶质的质量分数的计算
⑵溶液稀释的计算: ①计算公式: a.浓溶液质量×浓溶液溶质质量分数=稀溶液质量×稀溶液溶质质量分数 b.稀溶液的质量=浓溶液的质量+加入溶剂的质量 ②解题思路: a.根据题目条件,找公式a中的四个量,未知的设为未知数,根据公式列方程,解出未知数; b.根据公式b求出加入溶剂的质量。
①恰好完全反应时溶液为氯化钾溶液,氯化钾为反应生成的,溶液中的水有两个来源,一是向样品中加入的水,二是氢氧化钾溶液中的水;
分析:(1)根据函数图像可知,最终生成氢氧化铜沉淀的质量为9.8g; (2)分析过程:
CuCl2+2KOH═2KCl+Cu(OH)2↓
②反应生成的氯化钾可以通过生成的氢氧化铜的质量计算得出; 氢氧化钾溶液的质量有两种方法可以计算得出:
一是找溶质和溶剂的质量:
溶质的质量为x,水的质量为50g+46.3g-y,得到溶液的质量为x+50g+46.3g-y;
二是通过质量守恒定律计算:
根据反应前后物质的总质量相等,氯化钾溶液的质量=20g+50g+46.3g-9.8g-(20g-y)
4、(2021•百色)往108.8g碳酸钾溶液中加入100g稀盐酸恰好完全反应,生成8.8g二氧化碳气体。求反应后生成的溶液溶质的质量分数。
5、有关溶液配制误差分析
⑵溶质质量分数误差分析实质上就是分析实验过程中所涉及因素会造成溶质、溶剂的质量偏大或偏小。常见的造成溶质、或溶剂质量偏大或偏小的因素有:①砝码生锈 溶质质量 ,溶质质量分数 .②称量氯化钠时天平指针向左偏 溶质质量 ,溶质质量分数 .③氯化钠不纯 溶质质量 ,溶质质量分数 .④氯化钠和砝码放反 溶质质量 ,溶质质量分数 .⑤氯化钠倒入灯杯时撒落到烧杯外 溶质质量 ,溶质质量分数 .⑥量取水时仰视刻度线 溶剂质量 ,溶质质量分数 .⑦溶解前,烧杯内壁沾有水滴 溶剂质量 ,溶质质量分数 .⑧量取水时俯视刻度线 溶剂质量 ,溶质质量分数 .⑨溶液配制完毕,部分溶液未倒入试剂瓶 溶质溶剂质量 ,溶质质量分数 .
(2021·安徽)某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是( )A.用托盘天平称葡萄糖时,砝码放在左盘 B.转移葡萄糖时,纸上有少量残留C.用量筒量取水时,俯视液面 D.配好溶液装入试剂瓶时,有少量洒出
相关课件
这是一份初中化学人教版九年级下册课题2 溶解度多媒体教学课件ppt,共25页。PPT课件主要包含了学具准备,一定温度,继续溶解这种溶质,不能继续溶解,升温和增加溶剂,完全溶解,冷却降温,析出KNO3固体,固体消失,有晶体存在等内容,欢迎下载使用。
这是一份初中化学第九单元 溶液课题1 溶液的形成课文配套ppt课件,共10页。PPT课件主要包含了饱和溶液与不饱和溶液,不能继续溶解,为浓溶液和稀溶液等内容,欢迎下载使用。
这是一份9.第九单元 溶液课件PPT,共60页。








