





- 第八单元 金属和金属材料(第3课时)课件PPT 课件 0 次下载
- 第九单元 溶液(第1课时)课件PPT 课件 0 次下载
- 第九单元 溶液(第2课时)课件PPT 课件 0 次下载
- 第十单元酸和碱(第2课时)课件PPT 课件 0 次下载
- 第十单元酸和碱(第3课时)课件PPT 课件 0 次下载
第十单元酸和碱(第1课时)课件PPT
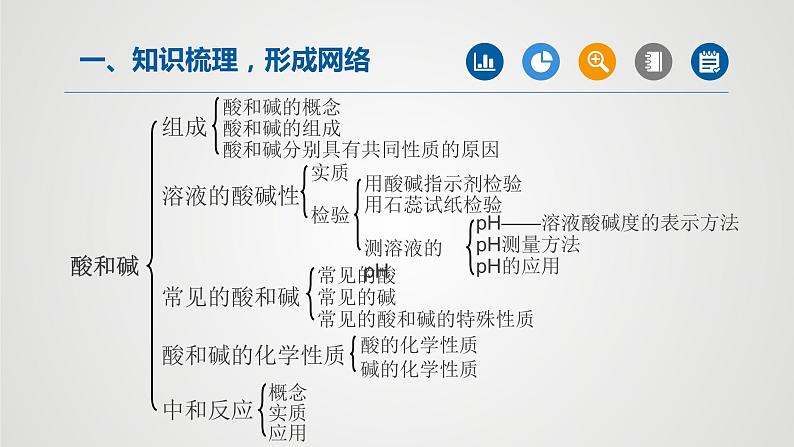
展开一、知识梳理,形成网络
酸和碱分别具有共同性质的原因
pH——溶液酸碱度的表示方法
常见的酸和碱的特殊性质
⑴酸:解离时产生的阳离子 都是 的化合物叫做酸;⑵碱:解离时产生的阴离子 都是 的化合物叫做碱。
二、重点回顾,强化练习
①“全部”:酸解离时阳离子只有氢离子, 其它阳离子;碱解离时的阴离子只有氢氧根离子, 其它阴离子; ②“化合物”:酸和碱都是化合物; ③醋酸解离的表达式:CH3COOH=CH3COO-+H+ 氨水解离的表达式:NH3•H2O=NH4++OH-。
⑴酸是由 和 组成;⑵碱是由 (或 )和 组成。
酸中一定含有 ,不一定含有 (如 );碱中一定含有 ,但不一定含有 (如 )。
3、酸和碱分别具有共同性质的原因
⑴不同的酸具有相似的化学性质的原因:不同酸的溶液中含有相同的 ; 不同的酸具有不同的化学性质的原因:不同酸的溶液中含有不同的 ; ⑵不同的碱具有相似的化学性质的原因:不同碱的溶液中含有相同的 ; 不同的碱具有不同的化学性质的原因:不同碱的溶液中含有不同的 (或是 )。
1、下列有关酸的说法中,正确的是( )A.酸的组成中一定含有氢元素 B.能够导电的溶液是酸C.滴加无色酚酞不变色的溶液是酸 D.能与碱发生反应的物质是酸
2、(2020•上海)酸的组成中一定含有( )A.金属元素 B.氧元素 C.原子团 D.酸根
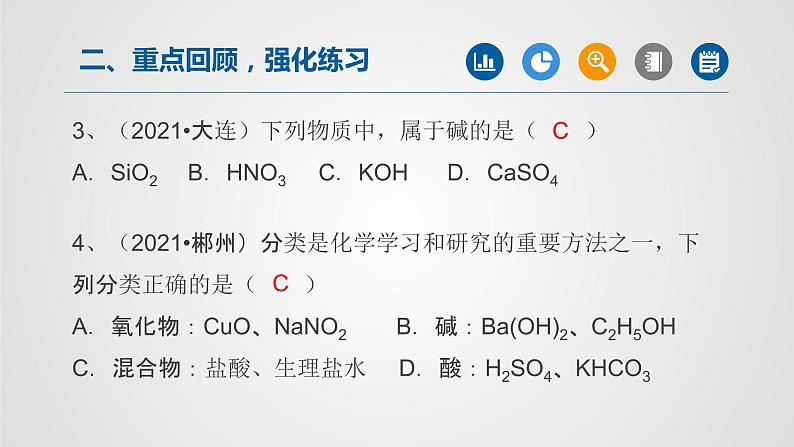
3、(2021•大连)下列物质中,属于碱的是( )A.SiO2 B.HNO3 C.KOH D.CaSO4
4、(2021•郴州)分类是化学学习和研究的重要方法之一,下列分类正确的是( )A.氧化物:CuO、NaNO2 B.碱:Ba(OH)2、C2H5OHC.混合物:盐酸、生理盐水 D.酸:H2SO4、KHCO3
溶液的酸碱性与溶液中氢离子和氢氧根离子的相对多少有关:[H+]>[OH-],溶液显 ;[H+]=[OH-],溶液显 ;[H+]<[OH-],溶液显 。
①[H+]、[OH-]。分别代表氢离子和氢氧根离子的浓度; ②同一溶液中同时存在着氢离子和氢氧根离子; ③酸的溶液显 ,但酸性溶液 是酸的溶液,碱的溶液显 ,但碱性溶液 是碱的溶液,因为 可能显酸性,可能显中性,也可能显碱性。
⑴用酸碱指示剂检验指示剂在酸性、中性、碱性溶液中显示的颜色:
①溶液变色是 变色,而不是 液变色; ②检验酸性溶液用 ,检验碱性溶液最好用 ,一种试剂检验三种性质的溶液用 ; ③能使紫色石蕊变红的溶液 是酸的溶液,能使无色酚酞变红、紫色石蕊变蓝的 是碱的溶液,使无色酚酞显无色的可能是 或 溶液。
能使 石蕊试纸变 的溶液显酸性,能使 石蕊试纸变 的溶液显碱性。
①pH是溶液酸碱度(即溶液酸碱性的强弱程度)的一种表示方法
pH=7,溶液显 ;pH<7,溶液显 ,pH越小 越强, 越弱;pH>7,溶液显 ,pH越大 越强, 越弱。
a.用pH试纸测定 在 上放一小块pH试纸,用 蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH。
①pH试纸 用水润湿,否则相当于将溶液 ,对酸性溶液,则酸性 ,测得的pH ;对碱性溶液,碱性 ,测得的pH ,对中性溶液 ; ②pH试纸 伸入待测液,否则会 待测液; ③测得的pH只能是1到14中的 。
a.用pH试纸测定
b.用pH计测量 测得的pH可能为 。
1、(2021•云南)在pH=10的肥皂水中滴加酚酞溶液,溶液变( )A.无色 B.红色 C.蓝色 D.紫色
3、根据下列实验现象,可以判断其溶液一定呈酸性的是( )A.滴加酚酞试液显红色的溶液 B.滴加石蕊试液显蓝色的溶液C.能够与碱发生反应的溶液 D.常温下,pH<7的溶液
4、根据下列实验现象可以判断某溶液一定呈碱性的是( )A.常温下,测得溶液的pH<7 B.溶液中滴入酚酞显红色C.溶液中滴入石蕊显红色 D.溶液中滴入酚酞不显色
⑴常见的几种酸 .
盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)和醋酸(CH3COOH)
⑴常见的几种碱 .
氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3•HO)
3、常见的酸和碱的特殊性质
⑴特殊性质: ①酸和碱都一定的腐蚀性,HCl、H2SO4、HNO3、NaOH、Ca(OH)2等都具有 腐蚀性; ②浓硫酸具有较强 ,需要 保存,还具有脱水性,强氧化性、溶于水 ; ③浓盐酸具有较强 ,易形成 ,要 保存;
⑴特殊性质:④氢氧化钠具有 ,且能吸收空气中的 变质,要 保存;⑤氢氧化钙也能吸收空气中的 变质,要 保存。
⑵酸碱使用注意事项及浓硫酸的稀释: ①浓酸浓碱使用时不要沾到皮肤或衣物上,若不慎沾到皮肤或衣物上,应立即 ,并涂上碳酸氢钠溶液(酸)或硼酸溶液(碱)。 ②浓硫酸稀释时,一定要将 沿容器壁缓缓倒入 中,并用玻璃棒搅拌,切不可将水倒入浓硫酸。否则可能引起 。
1、(2021•邵阳)下列关于氢氧化钠的描述中错误的是( )A.对皮肤有强烈的腐蚀作用 B.其水溶液能使石蕊溶液变红C.能去除油污,可作炉具清洁剂 D.易溶于水,溶解时放出热量
2、(2021•滨州)“火碱、烧碱、纯碱、苛性钠、小苏打”所代表的物质(或主要成分)共有( )A.一种 B.二种 C.三种 D.四种
3、下列有关物质的性质与用途正确且对应的是( )A.镁粉有金属光泽,可用作照明弹 B.氢氧化钠溶液呈碱性,可治疗胃酸过多C.浓硫酸有吸水性,可用作干燥剂 D.二氧化碳能溶于水,可用于灭火
4、分别将一小烧杯浓盐酸,浓硫酸露置在空气中一段时间后,发生的共同变化是( )A.溶液的质量减小 B.溶液的浓度减小 C.溶质的质量减小 D.溶剂的质量增大
(四)酸和碱的化学性质
⑴与指示剂作用 能使紫色石蕊试液变 ,使无色酚酞试液 (仍显 色); ⑵酸与金属反应生成 (反应条件:金属在金属活动性顺序表中排在 前面,酸为稀盐酸或稀硫酸)
人教版中考化学复习第十单元酸和碱第1课时常见的酸和碱教学课件: 这是一份人教版中考化学复习第十单元酸和碱第1课时常见的酸和碱教学课件,共40页。PPT课件主要包含了刺激性,HCl,干燥剂,CH3COOH,纸上显出黑色字迹,蘸有浓硫酸的部位变黑,腐蚀或脱水,盐+氢气,盐+水,NaCl+H2O等内容,欢迎下载使用。
中考化学复习第十单元酸和碱第1课时常见的酸和碱练习课件: 这是一份中考化学复习第十单元酸和碱第1课时常见的酸和碱练习课件,共29页。PPT课件主要包含了产生气泡的快慢程度,稀硫酸,BaSO4等内容,欢迎下载使用。
中考化学复习第十单元酸和碱第1课时常见的酸和碱作业课件: 这是一份中考化学复习第十单元酸和碱第1课时常见的酸和碱作业课件,共26页。PPT课件主要包含了不正确,除去溶液中溶解的氧气,隔绝氧气或空气,稀硫酸,复分解反应,Fe3O4,pH试纸或紫色石蕊,氢离子和,硫酸钠和氢氧化钠,产生白色沉淀等内容,欢迎下载使用。












