
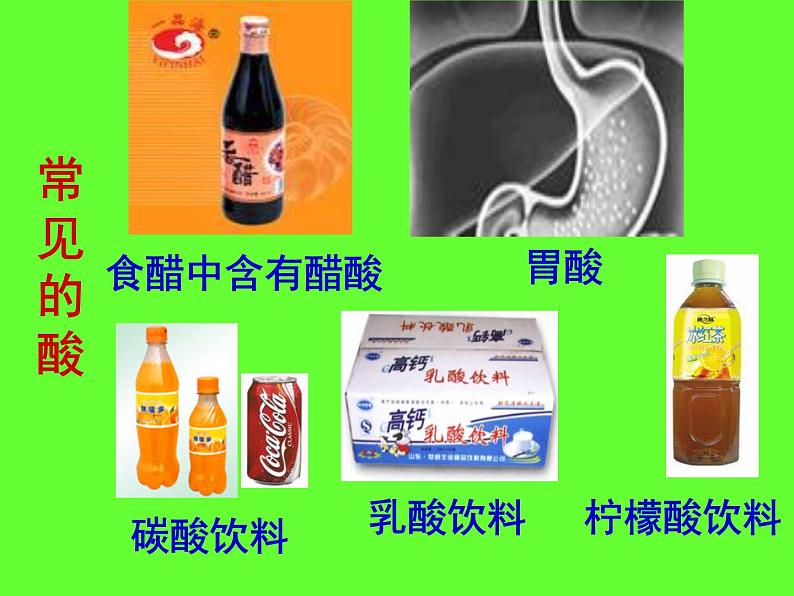




沪教版九年级下册第2节 常见的酸和碱教学课件ppt
展开
这是一份沪教版九年级下册第2节 常见的酸和碱教学课件ppt,共53页。PPT课件主要包含了想一想,Na+OH-,Ca2+OH-,氢氧化钠必,须密封保存,练习A组,练习B组等内容,欢迎下载使用。
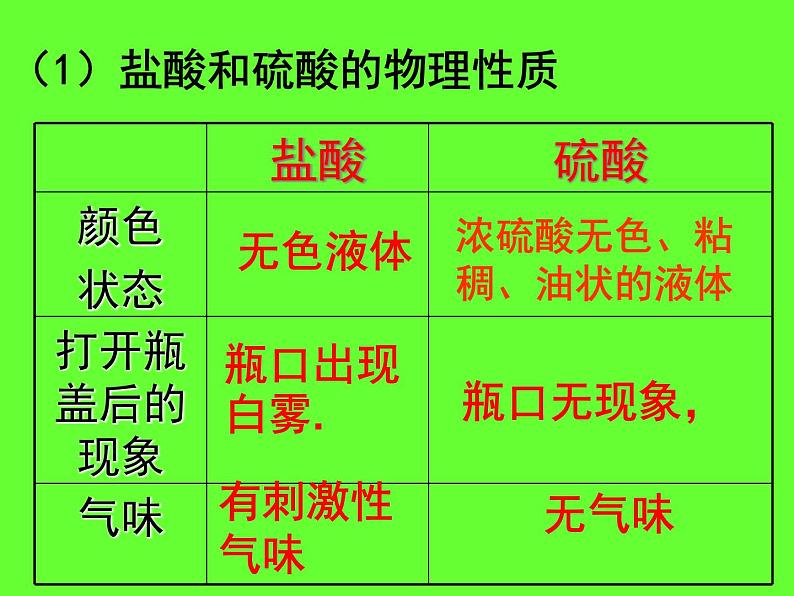
浓硫酸无色、粘稠、油状的液体
(1)盐酸和硫酸的物理性质
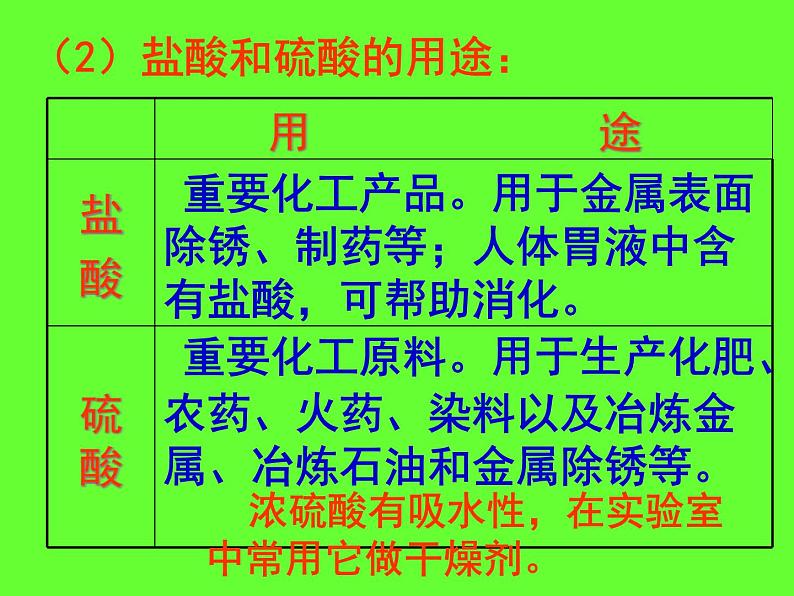
(2)盐酸和硫酸的用途:
浓硫酸有吸水性,在实验室中常用它做干燥剂。
分别盛放浓盐酸和浓硫酸的两个试剂瓶,敞口放置一段时间后(不考虑水分的蒸发),两瓶酸的质量、溶质质量分数各有何变化?应如何保存?
2、浓硫酸强烈的腐蚀性(脱水性)
使用浓硫酸要十分小心!
浓硫酸溶于水会放出大量的热
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并用玻璃杯不断搅拌。切不可将水倒进浓硫酸里。
(如不慎将浓硫酸沾到皮肤或衣服上,应立即用大量的水冲洗,然后涂上3%-5%的碳酸氢钠溶液。)
(1)吸水性:能吸收空气及其他物质中的水分,使浓硫酸变稀。(2)腐蚀性(脱水性):能夺取纸张、木材、棉布、皮肤等有机物(含C、H、O等元素的化合物)组成里的“水分”,生成黑色的炭。
利用浓硫酸的吸水性——干燥气体
⒈ 酸溶液能与指示剂反应:
酸能使紫色石蕊溶液变红,使无色的酚酞溶液不变色
2. 酸溶液能与某些金属反应:
酸能与某些金属反应,生成盐和氢气
Zn+H2SO4=ZnSO4+H2↑
Fe +H2SO4=FeSO4+H2↑
Mg+H2SO4=MgSO4+H2↑
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
3. 酸溶液能与金属氧化物反应:
酸能与金属氧化物反应,生成盐和水
小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……
可是,当他醒来之后,发现铁钉
不见了,你知道为什么吗?用两
个化学方程式表示出来。
Fe2O3+6HCl == 2FeCl3+ 3H2OFe + 2HCl ==FeCl2 + H2↑
铁锈溶解 铁溶解 溶解完全
酸具有相似化学性质的原因:不同的酸溶液中存在相同的H+
酸能使紫色石蕊溶液变红,不能使酚酞溶液变色。
小资料: 盐酸是氯化氢气体的水溶液,氯化氢溶于水时在水分子的作用下解离成H+和Cl-,所以稀盐酸中存在的粒子有: 水分子(H2O)、氢离子(H+)、 氯离子(Cl-)。
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
酸能解离出H+,所以酸能跟排在H前面的金属反应,产生氢气
金属活动性顺序 K Ca Na Mg Al Zn Fe Sn Pb
Cu Hg Ag Pt Au
规律:金属 + 酸 = 盐 + 氢气
注意观察:(1)铁钉表面的铁锈发生怎样的改变?(2)液体的颜色发生怎样的改变?
(1)将1根生锈的铁丝放入试管中,再向试管中加入1~2mL稀盐酸。
(2)将1根生锈的铁丝放入试管中,再向试管中加入1~2mL稀硫酸。
铁锈逐渐消失,溶液变成黄色
Fe2O3+6HCl=2FeCl3+3H2O
酸能解离出H+,所以酸能与金属氧化物反应生成水。
你能写出氧化铜分别与稀盐酸、稀硫酸反应的方程式?
思考:FeCl3溶液呈黄色可能与溶液中的什么粒子有关?
规律:金属氧化物 + 酸 = 盐 + 水
Fe2O3+3H2SO4=Fe2(SO4) 3+3H2O
1、酸能使紫色石蕊溶液变红色, 酸不能使无色酚酞溶液变色。
3、酸能与金属氧化物反应生成水。
2、酸能与活泼金属反应生成氢气。
1.本节课,你学到了哪些新的知识?
2.本节课,你运用了哪些学习方法?
1.生锈的铁器在用稀盐酸或稀硫酸除锈时,能否长时间浸泡?为什么?
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
你能运用“酸的化学性质”解决实际问题吗?
2.水和稀盐酸都是无色的液体,你能设计实验方案鉴别水与稀盐酸吗?
Fe2O3+6HCl=2FeCl3+3H2O
答:稀硫酸受热水分蒸发变成浓硫酸,浓硫酸有强烈的腐蚀性,能夺取纸张里的水分,生成黑色的炭.
Fe2O3+6HCl=2FeCl3+3H2O 黄色
Fe+2HCl=FeCl2+H2↑ 浅绿色
1. 常见的碱
氢氧化钠 NaOH氢氧化钙 Ca(OH)2 白色固体氢氧化钾 KOH氨水 NH3·H2O 液体氢氧化铜 Cu(OH)2 蓝色固体氢氧化铁 Fe(OH)3 红褐色固体
(1)氢氧化钠(NaOH)
吸收空气中的水分,发生潮解
极易溶于水,溶解时放热
俗名:苛性钠、火碱、烧碱
(处理方法:如不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液)
氢氧化钠固体是一种干燥剂
(其溶液无此性质)
干燥范围:NH3、H2、O2、N2等
注意不能干燥以下气体:HCl、CO2、SO2、H2S等
(2)氢氧化钙[ Ca(OH)2 ]
CaO + H2O = Ca(OH)2
注意: 氢氧化钙也有腐蚀性,使用时应注意安全
氢氧化钠、氢氧化钙在组成和性质上有许多共同之处。请你尽可能多地归纳出它们的共同点。
碱能使石蕊试液变蓝色, 酚酞试液变红色
1、如何检验二氧化碳气体?写出化学方程式。2、除去混合气体中的二氧化碳,用什么吸收好?写出相应的化学方程式。
碱溶液 + 非金属氧化物→化合物 + 水如:Ca(OH)2 + CO2 == CaCO3↓ + H2O; 2NaOH + CO2 == Na2CO3 + H2O;
SO3 + Ca(OH)2 =?SO3 + NaOH = ?
SO2 + Ca(OH)2 =?SO2 + NaOH = ?
(2)碱能与某些非金属氧化物反应
将CO2通入NaOH溶液中,无明显的现象出现,难以判断NaOH溶液是否与CO2发生了反应。那么,如何才能知道反应是否发生了呢?请你设计实验证明反应发生了。
从已经学习的知识分析: 将氢氧化钠固体长期露置于空气中会发生什么变化?氢氧化钠固体应该如何保存?
为什么盐酸、硫酸等酸有类似的化学性质;而氢氧化钠、氢氧化钙等碱有类似的化学性质?
盐酸、硫酸氢氧化钠溶液氢氧化钙溶液
说明:盐酸、硫酸氢氧化钠溶液氢氧化钙溶液
HCl = H+ + Cl_
H2SO4 = 2H++SO42-
NaOH=Na++ OH-
Ca(OH)2 = Ca2++ 2 OH-
导致酸有类似的化学性质
导致碱有类似的化学性质
判断下列物质哪些是酸,哪些是碱?
KOH H2CO3 Mg(OH)2 Al(OH)3 Na2CO3 HNO3 HCl H2SO4 NaHCO3 AlCl3 H3PO4
1、下列气体中,可以用氢氧化钠干燥的是 (A) H2 (B) SO2 ( ) (C) CO2 (D) HCl 2、用天平称量固体氢氧化钠时,应把氢氧化钠直接放在 ( ) (A) 天平的托盘上 (B) 滤纸上 (C) 小烧杯内 (D) 试管中
3、下列物质暴露在空气中,质量增加且变质的是( ) (A) 浓硫酸 (B) 火碱 (C) 水 (D) 浓盐酸
4、盛有盐酸、水、氢氧化钠的三瓶无色液体,请选用一种试剂将它们区别开来 。
1、取样 2、操作方法或加入试剂 3、看到的现象4、得出结论
回答鉴别题的一般方法:
分别取三种液体样品2mL于三支小试管中,再分别滴入紫色石蕊试液,若溶液变红色,则样品为盐酸;若溶液不变色,则样品为水;若溶液变蓝色,则样品为氢氧化钠。
1、右图中,锥形瓶内充满气体X,挤压滴管胶头, 使NaOH溶液滴入瓶中,一会儿可见导管内水面上升,则X气体是:( )(A) O2 (B) CO(C) CO2 (D) H2
2、如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡。经过一段时间后,下列有关叙述正确的是( )A.指针偏左,食盐溶液一定变稀,烧碱潮解B.指针偏右,食盐溶液一定饱和,烧碱潮解C.指针偏左,食盐溶液一定变浓,烧碱潮解D.指针偏右,食盐溶液一定变浓,烧碱潮解
3、新鲜的鸡蛋是有生命的,用石灰水浸泡后,可以在较长时间内保鲜,试用化学方程式表明其原理: .
4、(1) 检验氢气中是否混有二氧化碳,通常用氢氧化钙溶液而不选氢氧化钠溶液,其理由是_________________________________ (2)现有等质量的饱和氢氧化钠溶液和氢氧化钙溶液,要除去混有二氧化碳气体,最好选用前者,其理由是_________________________________________
NaOH与CO2反应时无明显现象,不适宜检验
Ca(OH)2是微溶于水的物质,溶液中溶质的含量较少,不能吸收大量的CO2
CO2 + Ca(OH)2 = CaCO3↓ + H2O
23、(7分)X是两种金属氧化物组成的混合物,为了研究混合物的成分,进行了如图所示的实验;已知金属氧化物与盐酸反应生成氯化物和水;C是两种金属单质的混合物。
(1)x中含有的金属元素是 ______,F是__________。(2)写出X中一种成分与盐酸反应的化学方程式:_____。(3)若Y为固体,写出Y与X中一种成分反应的化学方程式 ______________;若Y为气体,Y还可以是__________(填化学式)。
28.(8分)用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验.
【查阅资料】①无水硫酸铜为白色固体,遇水变成蓝色。②浓硫酸具有吸水性,可做干燥剂。请根据资料回答:(1)在实验中,乙装置的作用是 .
检验氢气中水分是否全部被吸收
相关课件
这是一份初中化学沪教版九年级下册第2节 常见的酸和碱图片课件ppt,共35页。PPT课件主要包含了常见的酸,常见的碱,酸碱的定义,酸碱指示剂,酸桔子,生活中,“尝起来酸酸的”,“摸起来滑滑的”,变蓝色,变红色等内容,欢迎下载使用。
这是一份沪教版九年级下册第2节 常见的酸和碱备课ppt课件,共20页。PPT课件主要包含了学习目标,交流讨论,变红变红,不变色不变色,酸与指示剂作用,点滴板,酸的化学性质,酸与碳酸盐反应,不能反应速率太快,1酸与铁锈反应等内容,欢迎下载使用。
这是一份初中化学沪教版九年级下册第7章 应用广泛的酸、碱、盐第2节 常见的酸和碱教学演示ppt课件,共20页。PPT课件主要包含了学习目标,交流讨论,酸的组成,硫酸没有挥发性,盐酸有挥发性,长管进短管出,浓硫酸的特性,吸水性,物理变化,脱水性等内容,欢迎下载使用。









