






2021学年第三单元 酸和碱课题1 常见的酸和碱图文ppt课件
展开九年级化学总复习第一轮
3、掌握酸的通性、碱的通性及有关化学方程 式。
1、掌握盐酸、硫酸的物理性质和化学性质。
2、掌握氢氧化钠、氢氧化钙物理和化学性质
1、知道酸的定义2、熟记硫酸、盐酸的物理性质和化学性质3、掌握酸的通性3、会书写有关的化学方程式
在水溶液中电离产生的阳离子全都是氢离子的化合物
如: 硫酸 盐酸 硝酸 碳酸 醋酸 .
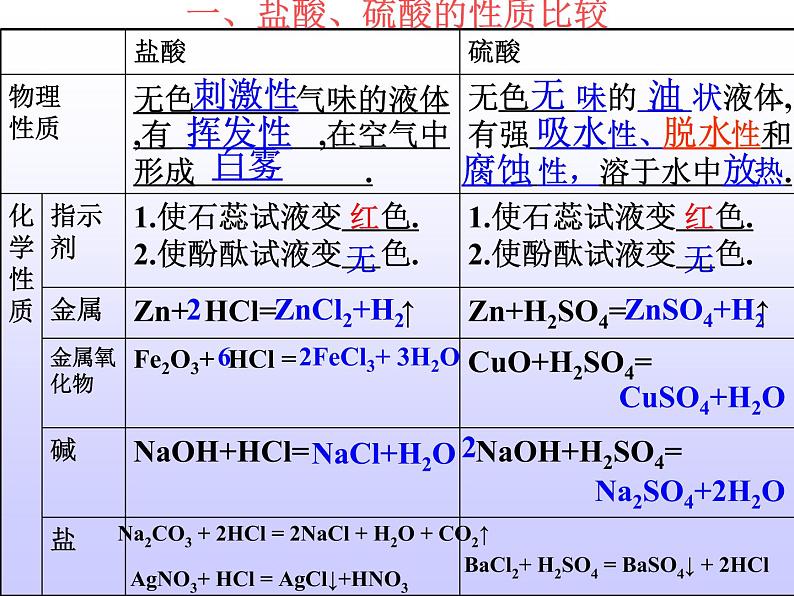
一、盐酸、硫酸的性质比较
2FeCl3+ 3H2O
Na2SO4+2H2O
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
AgNO3+ HCl = AgCl↓+HNO3
BaCl2+ H2SO4 = BaSO4↓ + 2HCl
2.酸+金属=盐+氢气
3.酸+金属氧化物=盐+水
4.酸+碱=盐+水(中和反应)
5. 酸+盐=新酸+新盐
酸能使石蕊变红, 能使酚酞变色 ,使PH试纸变棕--红色
条件:(1)金属指排在H前面的活泼金属
Zn+H2SO4=ZnSO4+H2↑Fe +H2SO4=FeSO4+H2↑
CuO+H2SO4=CuSO4+H2O Fe2O3+6HCl=2FeCl3+3H2O
NaOH+HCl=NaCl+H2O Cu(OH)2+H2SO4=CuSO4+2H2O
小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……
可是,当他醒来之后,发现铁钉 不见了,你知道为什么吗?用两 个化学方程式表示出来。
1、 Fe2O3+6HCl == 2FeCl3+ 3H2O2、 Fe + 2HCl ==FeCl2 + H2↑
铁锈溶解 铁溶解 溶解完全
“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是( )A.先变蓝后变紫B.变红后颜色不再改变C.先变无色后变红 D.先变红后变紫
提示: 雪碧中含碳酸H2CO3,它能使紫色石蕊溶液变红色,但加热时碳酸分解:H2CO3==H2O+CO2↑ 所以石蕊溶液又变回原来的紫色.
苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强,下列对苯甲酸性质的推测,不合理的是( )A、苯甲酸能使石蕊试液变红色B、苯甲酸不能使酚酞变色C、苯甲酸溶液的pH>7D、苯甲酸溶液的pH<7
消石灰、熟石灰、石灰浆
1、白色块状固体, 2、易溶于水,放出热量, 3、易吸水而潮解,可以用作 干燥剂 4、有腐蚀性
1、白色粉末状固体, 2、微溶于水,水溶液俗称石灰水 3、也有腐蚀性
使石蕊试液变——色,使酚酞试液变——色
使石蕊试液变——色 使酚酞试液变——色
CO2+NaOH——SO2+NaOH——
CO2+Ca(OH)2 —
Ca(OH)2 + HCl—
= CaCO3 ↓+ H2O
= Na2CO3 + H2O
= Na2SO3 + H2O
= NaCl + H2O
2HCl + Ca(OH)2 = CaCl2+2H2O
2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4
Na2CO3 + Ca(OH)2 = CaCO3 ↓+2NaOH
2.碱+非金属氧化物=盐+水
3.碱+酸=盐+水(中和反应)
4.碱+盐=新碱+新盐
CO2+Ca(OH)2=CaCO 3↓ +H2OCO2+2NaOH=Na2CO3+H2OSO2 +2NaOH=Na2SO3+H2O
使紫色的石蕊试液变——色,使无色的酚酞试液变——色
NaOH+HCl=NaCl+H2O Cu(OH)2+H2SO4=CuSO4+2H2O
3NaOH + FeCl3 == Fe(OH)3↓ + 3NaCl
成份:氢氧化铝、碘甲基蛋氨酸等
3HCl + Al(OH)3 == AlCl3 + 3H2O
用化学方程式表示斯达舒治疗胃酸过多症的原理:
敞口的氢氧化钠固体质量会变化吗?
答案: 会增大。因为氢氧化钠易吸水且与CO2反应:2NaOH + CO2 === Na2CO3 + H2O 80 44 106 18
1、把纯水、稀硫酸和氢氧化钠三种无色溶液区别开的最简单的方法是( )A:滴入酚酞试液 B:滴入石蕊试液C:滴入氯化钡溶液 D:通入二氧化碳气体
2、下列物质不能和氢氧化钠溶液反应生成盐和水的是( )A:三氧化硫 B:二氧化碳 C:氧化镁 D:稀硫酸
2、混有少量水蒸气的下列气体,能用氢氧化钠固体干燥的是( ) A: CO2 B: H2 C: SO2 D: HCl
3、下列物质长期露置在空气中,质量会减少的是( )A:浓盐酸 B:固体烧碱C:大理石 D:浓硫酸
氢氧化钠又名苛性钠,这是因为它有强烈的_________。氢氧化钠必须密封保存,是因为它能吸收空气中的_____,并能跟空气中的_____________起反应。
2NaOH+ CO2=== Na2CO3 + H2O
5、下列物质与稀硫酸反应不能产生氢气的是( ) A: 镁 B:银 C:铁 D:铝
根据金属活动性顺序表知道: 镁>铝>铁>(氢)>银 银排在氢之后,所以它不能和稀硫酸反应.
6、“物质的组成与结构决定物质的性质”是化学学科中的重要观点。按照这一观点讨论:酸溶液具有一些共同的化学性质,是因为酸溶液中都含有 ;碱溶液也具有一些共同的化学性质,是因为碱溶液中都含有 。
取NaOH溶液适量于小烧杯中,滴入几滴酚酞试液,然后再向该溶液中逐滴滴入稀HCl。
溶液先由无色变红,再由红变无色。
氢氧化钠溶液能与稀盐酸反应。
一定条件下,同一化学反应进行的快慢与反应物的质量分数成正比。现用100克溶液质质量分数为30%的盐酸溶液与过量的锌粉反应,为了使反应慢点进行而又不生成氢气的总量,可向所用的盐酸中加入适量的( )。A、氢氧化钠 B、水C、氧化镁 D、碳酸钙
现有白纸和几种溶液,有人用这些材料设计了一个名为“雨落叶出红花开”的趣味实验。实验的过程如下:先用洁净的毛笔蘸 (填序号,下同)在白纸上画上花,再用 画上叶,将白纸挂上墙壁,晾干后用 向纸上喷即成。A、酚酞试液 B、石蕊试液C、氢氧化钠溶液 D、稀盐酸
用锌粒和盐酸反应制取的氢气中,常混有水蒸气和氯化氢气体,为了除去气体杂质,可使混合气体通过右图A、B两装置,气体通过两瓶的导管顺序正确的是( ) A、abcd B、dcba C、cdab D、bacd
a b c d
A B
下列四种物质中,能和其他三种物质反应的是( )。A、盐酸 B、锌C、铁锈 D、氢氧化铜
下列四种物质中,能和其他三种物质反应的是( )。A、盐酸 B、二氧化碳C、硫酸铜 D、氢氧化钠
稀盐酸、稀硫酸的化学性质:
0——7——14 酸红—中黄—碱蓝
金属活动性顺序表(强到弱)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
煤是重要的化工原料,用煤做燃料,不仅是极大的浪费,而且因燃煤中含有硫的化合物燃烧时生成SO2气体造成环境污染。 假设一个有30万户居民的中等城市,每户每天烧煤5千克,这种煤中含硫的90%转化为SO2,则该城市每年排放到空气中的SO2的质量约为2.6吨。 试分析:我们可以采取哪些措施以减少SO2对空气的污染?
初中化学人教版 (五四制)九年级全册第三单元 酸和碱课题1 常见的酸和碱课前预习课件ppt: 这是一份初中化学人教版 (五四制)九年级全册第三单元 酸和碱课题1 常见的酸和碱课前预习课件ppt,共50页。PPT课件主要包含了第十单元┃酸和碱,化学·新课标RJ,挥发性,不变色,吸水性,脱水性和强腐蚀性,浓硫酸,玻璃棒,中和反应,氢氧化钙或熟石灰等内容,欢迎下载使用。
初中化学人教版 (五四制)九年级全册课题1 常见的酸和碱图片课件ppt: 这是一份初中化学人教版 (五四制)九年级全册课题1 常见的酸和碱图片课件ppt
初中化学人教版 (五四制)九年级全册课题1 常见的酸和碱教案配套ppt课件: 这是一份初中化学人教版 (五四制)九年级全册课题1 常见的酸和碱教案配套ppt课件













