





初中化学第7章 应用广泛的酸、碱、盐第2节 常见的酸和碱教学ppt课件
展开
这是一份初中化学第7章 应用广泛的酸、碱、盐第2节 常见的酸和碱教学ppt课件,共24页。PPT课件主要包含了学习目标,想一想说一说,化合物,试一试填一填等内容,欢迎下载使用。
知道哪些物质之间能发生复分解; 掌握复分解反应发生的条件; 学会正确书写复分解反应的化学方程式; 掌握利用复分解反应的条件解决具体问题 的思路方法。
. 什么是复分解反应?
两种化合物相互交换成分,生成两种新的化合物的反应。
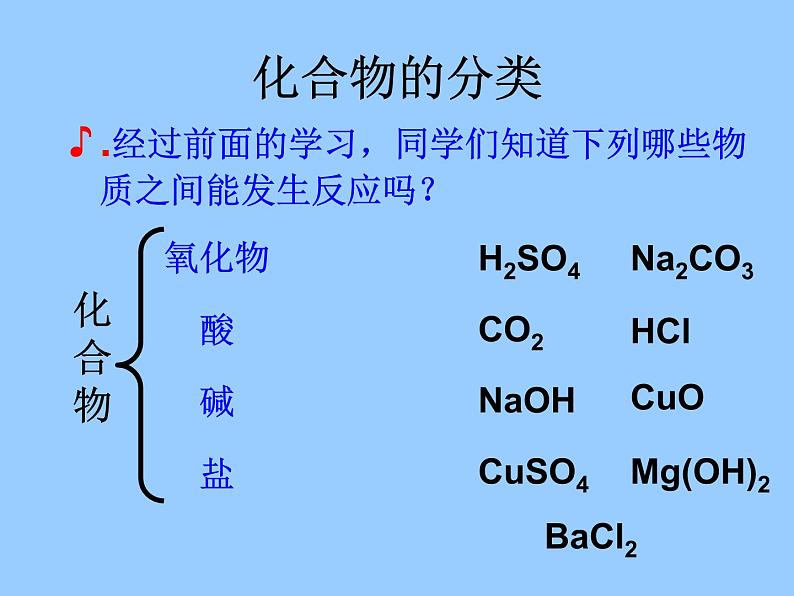
.经过前面的学习,同学们知道下列哪些物质之间能发生反应吗?
金属氧化物+酸 → 盐 + 水碱 + 酸 → 盐 + 水盐 + 酸→ 新盐 + 新酸碱 + 盐→ 新碱 + 新盐盐 + 盐→ 新盐 + 新盐
复分解反应的发生和进行是不是需要什么条件呢?
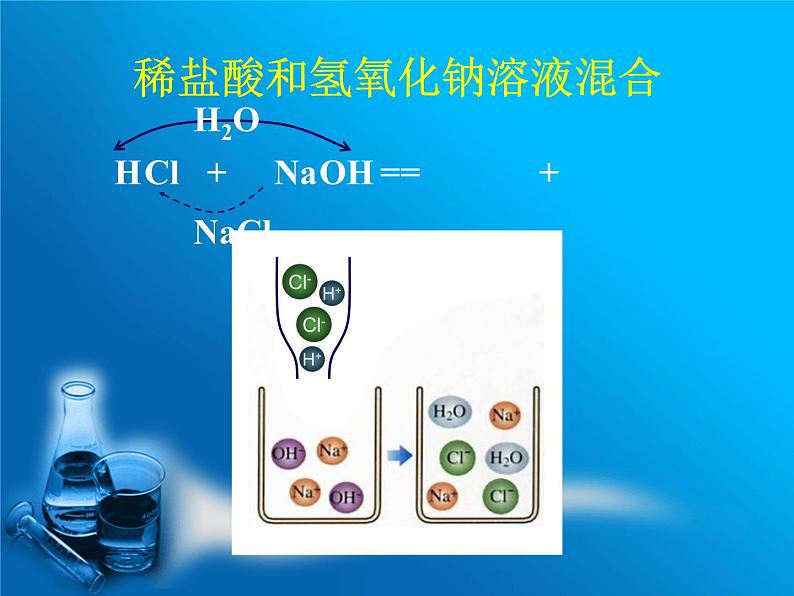
稀盐酸和氢氧化钠溶液混合
稀盐酸和碳酸钠溶液混合
2HCl+Na2CO3 ==
氢氧化钠溶液和硫酸铜溶液混合
CuSO4 +2NaOH ==
Na2SO4 + Cu(OH)2↓
氢氧化钠溶液和氯化钡溶液混合
BaCl2 + NaOH ==
仔细研究不难发现,我们所学过的复分解反应中,要么有水、要么有沉淀、要么有气体生成,有的甚至水、沉淀、气体兼而有之,这是为什么呢?复分解反应的实质是:发生复分解反应的两种物质在水溶液中相互交换离子,结合成难电离的物质:沉淀、气体、水,使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行。如果几种离子混合后,离子的浓度不发生变化,那么,反应也就没有发生。
小 资 料 通常情况下,化学反应的动力都是来自于一个共同的原因,即:使整个反应体系变得更加稳定。对于酸碱盐的水溶液来说,怎样才能使体系变得稳定呢?那就是通过反应使体系内自由移动的离子的浓度不断减小。 ——摘自:人教网2010>>初中化学>>学生中心>>同步学习资源>>课堂在线>>九年级下册
金属氧化物+酸 → 盐 + 水碱 + 酸 → 盐 + 水盐 + 酸 → 新盐 + 新酸碱 + 盐 → 新碱 + 新盐盐 + 盐 → 新盐 + 新盐
完成条件(生成物):有沉淀或气体或水
发生条件(反应物):有酸可不溶,无酸需都溶
若连线两端的离子能结合生成沉淀、气体、或水,请你完成填充。
[Fe3+ Mg2+]
甲乙两个工厂排放的废水中一共有H+、K+、Ag+、Ba2+、OH-、C1-、NO3-、CO32-八种离子,现向甲厂废水中滴入紫色石蕊试液后,溶液变成蓝色。据此推知乙厂废水中的离子应该是 。
H+ K+ Ag+ Ba2+
OH- C1- NO3- CO32-
想一想,填一填
反应,有气泡,固体溶解
反应,有氨臭味气体产生
反应,有气泡和白色沉淀
注意:本表格中若生成微溶物,也看作沉淀。
1.实验室有三瓶失去标签的稀溶液,分别是稀盐酸、碳酸钠溶液、氢氧化钡溶液,请你设法将他们鉴别出来。(1)若让你从实验室另选一种其它试剂来鉴别它们,你会选下列哪种试剂?( ) A. 酚酞试液 B. 稀硫酸 C. K2CO3溶液 D. NaNO3溶液(2)有同学发现,不选用其它任何试剂,也能鉴别它们,你知道他是怎样做到的吗?
2.完成下列化学方程式,体会复分解反应的方程式的书写特点。 (1)________+Na2CO3= 2NaOH +_________(2)BaCl2 +________= BaSO4↓+________(3)_______+ 2HCl=_______+_______+CO2↑(4)_______+ NaOH =_______+_______+NH3↑
Ca(OH)2 CaCO3↓
Na2 SO4 2NaCl
Na2 CO3 2NaCl H2O
NH4 NO3 NaNO3 H2O
3.用方程式表示除去下列物质中的杂质:(括号里的物质是杂质) (1)KNO3(KCl)(2)NaOH(Na2CO3)(3)NaCl(NH4Cl)(4)HNO3(H2SO4)(5)KCl(KOH)(6)NaNO3(CuSO4)
KCl +AgNO3= KNO3 + AgCl↓ ;
Na2CO3 +Ca(OH)2= 2NaOH+ CaCO3↓ ;
H2SO4 +Ba(NO3)2= 2HNO3+ BaSO4↓ ;
2KOH+CuCl2= 2KCl+ Cu(OH)2↓ ;
CuSO4 +Ba(OH)2= Cu(OH)2 ↓ + BaSO4↓
NH4Cl+KOH=NaCl+ H2O+NH3↑ ;
4.现有A、B、C、D四种无色溶液,它们分别是稀盐酸、氯化钡、硫酸钠和碳酸钠中的某一种。试根据以下实验现象,写出四种溶液中溶质的化学式,并完整书写能反应的化学方程式。A+B→白色沉淀 A+C→无变化A+D→无变化 B+C→白色沉淀B+D→无变化 C+D→无色气体
HCl BaCl2 Na2SO4 Na2CO3
5.有一种固体混合物,可能由CaCO3,CuSO4,BaCl2,KCl,Na2CO3中的一种或几种物质组成。现取该混合物进行如下实验:(1)将固体混合物投入水中,搅拌后完全溶解,得到无色溶液;(2)往此溶液中滴加盐酸,产生一种能使澄清石灰水变浑浊的无色无味的气体。 由上述实验现象可知:该固体混合物中一定不存在的是_________,一定存在的是_________,不能确定的是_____________。
BaCl2和Na2CO3不能同时有
6.有H2SO4、 BaCl2、 NaOH、CuSO4、NaCl这五种物质,相互之间最多能发生的反应个数为( ) A. 3个 B. 4个 C. 5个 D. 6个
7. 只需要加入 ①Fe2(SO4)3 ②Na2CO3 ③AgNO3 ④石蕊 四种溶液中的一种,就能将BaCl2、HCl、NaOH三种无色溶液一次性鉴别出来的有( )。 A.①②③ B.②③④ C.①②④ D.①③④
8. 甲乙两个工厂排放的废水共有H+、K+、Ag+、Ba2+、OH-、C1-、NO3-、CO32-八种离子,现向甲厂废水中滴入紫色石蕊试液后,溶液变成蓝色。据此推知乙厂废水中的离子应该是 。
相关课件
这是一份中考化学复习高频考点集中练9复分解反应的应用课件,共15页。PPT课件主要包含了有白色沉淀产生等内容,欢迎下载使用。
这是一份2023年中考化学复习--复分解反应的应用课件PPT,共28页。PPT课件主要包含了随堂练习等内容,欢迎下载使用。
这是一份初中化学沪教版九年级下册第7章 应用广泛的酸、碱、盐综合与测试课文课件ppt,共20页。PPT课件主要包含了复分解反应,⑴酸+碱=盐+水,⑵酸+盐=新酸+新盐,⑶碱+盐=新碱+新盐,⑷盐+盐=新盐+新盐,不反应,CaCO3不溶于水,BaCO3不溶于水,复分解反应的应用,1离子的共存等内容,欢迎下载使用。









