






2021学年实验活动8 粗盐中难溶性杂质的去除课文内容ppt课件
展开
这是一份2021学年实验活动8 粗盐中难溶性杂质的去除课文内容ppt课件,共31页。PPT课件主要包含了复分解反应的概念,+CB,有水生成,有气体生成,有沉淀生成,酸碱盐的溶解性口诀,学习目标,学习重点,学习难点,自主探究一等内容,欢迎下载使用。
CaCO3+2HCl=CaCl2+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
CO32-检验方法:向待测物中滴加稀盐酸,并将产生的气体通入澄清的石灰水,石灰水变浑浊。
Na2CO3 + Ca(OH)2 = CaCO3 ↓ + 2NaOH
产生大量气泡澄清的石灰水,石灰水变浑浊。
Fe+CuSO4=Cu+FeSO4
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应 。
表达式:AB + CD→
特 点:双交换,价不变
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
五、复分解反应发生的条件:
根据课本114页的附表判断
以上三个条件必须有一个复分解反应才能发生。
1、钾、钠、硝酸、铵盐都溶2、盐酸盐不溶氯化银,其它的都溶3、硫酸盐不溶硫酸钡,硫酸钙硫酸银微溶,其它的都溶4、碳酸盐只溶碳酸钾、碳酸钠、碳酸铵,碳酸镁微溶,其它的都不溶5、碱能溶氢氧化钾、氢氧化钠、氢氧化钡、氢氧化钙微溶,其它的都不溶6、常见五酸都易溶
第十一单元 盐 化肥
课题1 生活中常见的盐
1、通过观察实验归纳酸碱盐的通性。
2、会检验Cl-、CO32-、SO42-。
观察稀盐酸,氯化钠,氯化钾与硝酸银的反应.flv完成下列问题:
盐能与盐反应生成两种新盐
NaCl + AgNO3 == AgCl ↓ +NaNO3
KCl + AgNO3 == AgCl ↓ +KNO3
滴加硝酸银溶液产生白色沉淀,再加稀硝酸沉淀不溶解。
观察硫酸钠与氯化钡反应.flv和硫酸铜与氯化钡反应.flv完成下列问题:
CuSO4 + BaCl2 — BaSO4↓ + CuCl2
2、怎样检验SO42-?
1、写出有关反应的化学方程式
滴加氯化钡或硝酸钡溶液产生白色沉淀,再加稀硝酸沉淀不溶解。
Na2SO4 + BaCl2 — BaSO4↓ +2 NaCl
1、 向某无色溶液中加入稀HCl,产生气体,将气体通入澄清的石灰水中,石灰水变浑浊,证明原溶液中可能有_______离子。2、向某无色溶液中加入硝酸银溶液,出现白色沉淀,再加几滴稀硝酸,沉淀不消失,证明原溶液中有________离子。
3、无色溶液中加BaCl2溶液,出现白色沉淀,再加入几滴稀硝酸,沉淀不消失,证明原溶液中含有 离子;沉淀消失,则原溶液中可能含有 离子。
观察硫酸铜氯化铁与氢氧化钠反应.flv完成下列问题:
FeCl3 + 3NaOH =Fe(OH)3↓ + 3NaCl
2、怎样检验Cu2+和Fe3+?
Cu2+溶液呈蓝色滴加NaOH溶液产生蓝色沉淀。
CuSO4 + 2NaOH=Cu(OH)2↓ + Na2SO4
Fe3+溶液呈黄色滴加NaOH溶液产生褐红色沉淀。
1、与金属反应
Fe + CuSO4 — Cu + FeSO4 2、与酸反应
CaCO3 + 2HCl — CaCl2 + H2O + CO2↑3、与可溶性碱反应
硫酸铜氯化铁与氢氧化钠反应.flv 2NaOH+ CuSO4 — Cu(OH)2 ↓+ Na2SO44、与另一种可溶性盐反应生成两种新盐
NaCl + AgNO3 — AgCl↓+ NaNO3 CuSO4 + BaCl2 — BaSO4↓ + CuCl2
试液变红 产生可燃性气体
滴加石蕊试液 加Zn,、Fe等金属
滴加硝酸银溶液,稀硝酸
滴加硝酸钡溶液,稀硝酸
滴加盐酸(硝酸),产生气体通入 澄清石灰水
红褐色不溶物
1、蓝色溶液一定含Cu2+
2、棕黄色溶液一定含Fe3+
3、加碱产生的蓝色沉淀一定是Cu(OH)2
Cu2+ +2OH- === Cu(OH)2 ↓ (蓝色)
4、加碱产生的红褐色沉淀一定是Fe (OH)3
Fe3+ +3OH- === Fe(OH)3 ↓ (红褐色)
5、不溶于稀硝酸的白色沉淀有Ag Cl和BaSO4
Ag+ +Cl- === AgCl ↓ (白色)
Ba2+ +SO42- === BaSO4 ↓ (白色)
6、溶于稀硝酸产生气体的白色沉淀有CaCO3和BaCO3
Ca2+ +CO32- === CaCO3 ↓ (白色)
Ba2+ +CO32- === BaCO3 ↓ (白色)
CO32- + 酸=== CO2↑
7、溶于稀硝酸不产生气体的白色沉淀有Mg(OH)2
Mg2+ +2OH- === Mg(OH)2 ↓ (白色)
浅绿色溶液一定含Fe2+
⑵酸与活泼金属反应生成盐和氢气
酸溶液能使紫色石蕊溶液变______,遇无色酚酞溶液_______。
Zn+2HCl==ZnCl2+H2↑
Zn+H2SO4==ZnSO4+H2↑
现象:产生大量气泡,点燃,产生爆呜声。
2Al+6HCl==2AlCl3+3H2↑
2Al+3H2SO4==Al2(SO4)3+3H2↑
⑶酸与金属氧化物反应生成盐和水
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
现象:铁钉表面锈被除去,溶液由无色变为黄色。
(4)酸与盐反应生成新盐和新酸
AgNO3+HCl=AgCl↓+HNO3
BaCl2+H2SO4=BaSO4 ↓ +2HCl
现象:产生不溶于稀硝酸的白色沉淀。
2、跟非金属氧化物的反应生成盐和水
3、跟酸的反应生成盐和水
4、跟某些盐反应生成新碱和新盐
碱能使石蕊试液变成蓝色,使酚酞试液变成红色。
Na2CO3+Ca(OH)2=2NaOH+CaCO3 ↓ (白色)
NaOH+HCl= NaCl+H2O
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
CuSO4+2NaOH=Na2SO4 + Cu(OH)2↓(蓝色)
FeCl3+3NaOH=3NaCl + Fe (OH)3↓(红褐色)
1、实质:就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。
2﹑附加隐含条件的应用规律︰
(1)、溶液无色透明时,溶液中肯定没有有色离子 Cu2+、Fe3+、Fe2+、MnO4-等 :
(2)、酸性溶液中,肯定不存在与H+起反应的离子 OH-、CO32-
(3)、碱性溶液中,肯定不存在与OH-起反应的离子 Mg2+、Fe2+、Al3+、Cu2+及NH4+等,
溶液中不能大量共存的离子有:
H+—OH- NH4+—OH- H+—CO32- Ag+—Cl- Ba2+—SO42-
Mg2+、Al3+、Fe2+、Fe3+、Cu2+—OH-
Ba2+、Ca2+—CO32-
1、下列各组物质能够共存的是: ( ) A、FeCl3溶液、NaOH溶液B、Ca(OH)2溶液、Na2CO3溶液C、BaCl2溶液、HCl溶液 D、CaCO3、稀HNO3
2.下列各组物质能同时存在于同一溶液中的是( )A.AgNO3、NaCl、KNO3B.CuSO4、KNO3、Na2CO3C.NaOH、KCl、Fe(NO3)3D.KCl、NaOH、Na2CO3
3.在氯化钠、碳酸钠、硫酸铜三种固体中,通常用来调味的是_____________,通常用作家用洗涤剂的是_____________,农业上用来配制波尔多液的是_____________,溶液呈蓝色的是_______________,溶液呈现碱性的是_______________。
4、按下列要求,从①烧碱 ②盐酸 ③熟石灰 ④固体二氧化碳 ⑤硫酸中选出适当的物质,填在相应的横线上(填标号):
(1)少量存在于人体的胃液中,能帮助消化的物质是____;
(2)能降低土壤酸性和用于配制农药波尔多液的是____;
(3)既有强烈的腐蚀性和极易溶于水的性质,又可作某些气体干燥剂的固体物质是___;
(4)可用作致冷剂的是___。
5、鱼胆弄破后会使鱼肉粘上难溶解于水的胆汁酸(一种酸)而变苦,要减少这种苦味,用来洗涤的最佳物质是( )。A、水 B、食盐C、纯碱 D、食醋
8、食用松花皮蛋时常感到有涩味,是因为制作过程中用到了熟石灰和纯碱等原料。为了减轻涩味,可在食用时添加调味品,这种调味品最好( )。A、食盐 B、酱油C、香油 D、食醋
6、苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强,下列对苯甲酸性质的推测,不合理的是( )A、苯甲酸能使石蕊试液变红色B、苯甲酸不能使酚酞变色C、苯甲酸溶液的pH>7D、苯甲酸溶液的pH
相关课件
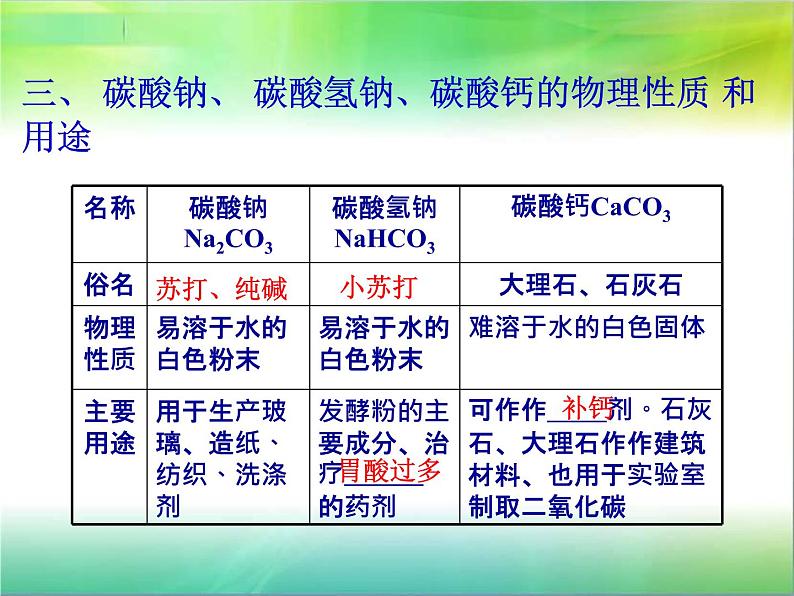
这是一份初中化学人教版九年级下册课题1 生活中常见的盐课文ppt课件,共22页。PPT课件主要包含了洗涤剂,俗称小苏打,发酵粉,治疗胃酸过多,建筑材料,补钙剂,知识回顾,探究实验,稀盐酸,澄清石灰水等内容,欢迎下载使用。
这是一份人教版九年级下册实验活动8 粗盐中难溶性杂质的去除教课内容ppt课件,共33页。PPT课件主要包含了复分解反应的概念,学习目标,学习重点,学习难点,复分解反应的类型等内容,欢迎下载使用。
这是一份初中化学人教版九年级下册课题1 生活中常见的盐课文内容ppt课件,共16页。PPT课件主要包含了学习目标,学习重点,学习难点,纯碱苏打,小苏打,大理石石灰石,②作补钙剂,NaHCO3,CaCO3,Na2CO3等内容,欢迎下载使用。











