




原电池(高考化学一轮复习)课件PPT
展开考纲要求:1、了解原电池的工作原理,能写出电极反应和电池反应的方程式;2、了解常见化学电源的种类及其工作原理;3、理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
锌表面无气泡,铜表面有气泡,电流表发生偏转。
1.H+得到的电子是Cu失去的吗?2.电子从Zn到H+经历了哪些途径? 3.在这个过程中Cu起什么作用? 4.你认为这个过程能量是如何转化的?
Cu起传导电子的作用。
Zn + 2H+ = Zn 2+ +H2↑
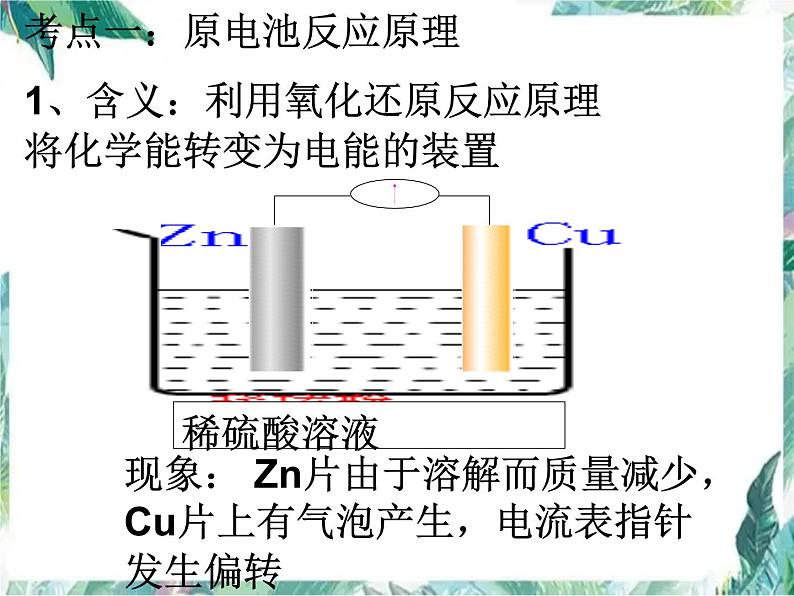
考点一:原电池反应原理1、含义:利用氧化还原反应原理将化学能转变为电能的装置
现象: Zn片由于溶解而质量减少,Cu片上有气泡产生,电流表指针发生偏转
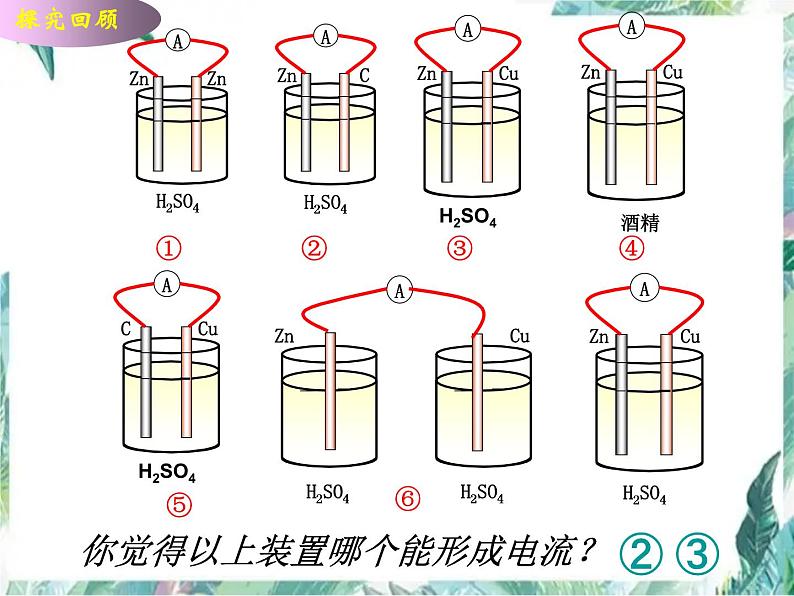
你觉得以上装置哪个能形成电流?
① ② ③ ④
稀硫酸 硫酸铜溶液 稀硫酸
酒精溶液 氯化钠溶液
讨论:从电极材料, 电解质溶液,电极连接方式三方面分析构成原电池的条件
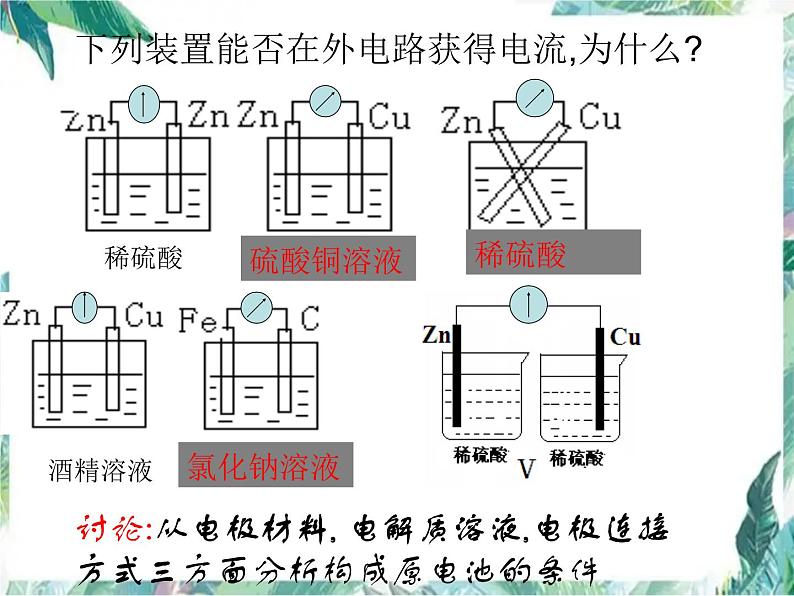
下列装置能否在外电路获得电流,为什么?
问题:氧化还原反应的实质是什么?
分析下列氧化还原反应:Zn + H2SO4 == ZnSO4 + H2↑指出发生氧化反应和还原反应的物质以及电子转移的情况
氧化反应: Zn → Zn2+还原反应:H+ → H2
要产生电流,必须的条件是什么?
1.有两种活泼性不同的金属(或非金属)作电极
3.能自发地发生氧化还原反应
4.两极相连形成闭合回路
2.电极材料均插入电解质溶液中
下列装置中能组成原电池形成电流的是( )
一般是相对活泼的金属发生氧化反应的一极电子流出的一极电流流入的一极质量减少的一极(溶解、变细)阴离子流向的一极一般与电解质反应的一极
相对不活泼的金属或非金属的一极发生还原反应的一极电子流入的一极电流流出的一极质量增加的一极(变粗、固体析出)有气泡冒出的一极阳离子流向的一极
外电路:电子从负极出发经导线流向正极
内电路:溶液中的阳离子(H+)移向正极,阴离子(SO42-)移向负极
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 ( )A.a > b > c > d B.a > c > d > b C.c > a > b .> d D.b > d > c > a
考点二:电极反应式的书写
(锌片) Zn - 2e- = Zn2+ 氧化反应
(铜片) 2H+ + 2e- = H2↑
请写出图片中原电池的电极反应式和电池反应方程式。
(铜片) 2Cu2+ + 2e- = Cu
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
2H++2e-=H2↑
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
Zn-2e- =Zn2+
2H++2e- =H2↑
Fe-2e - =Fe2+
Cu2++2e- =Cu
Fe+Cu2+=Fe2++Cu
Fe+CuSO4=Cu+FeSO4
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
或 Zn+CuSO4=ZnSO4+Cu
2、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
A. 铁圈和银圈左右摇摆不定B. 保持平衡状态C. 铁圈向下倾斜,银圈向上倾斜D. 银圈向下倾斜,铁圈向上倾斜
请根据反应: Zn + CuSO4 = ZnSO4 + Cu设计一个单液原电池,并进行实验。
电流表指针发生偏转,但不稳定。
两个电极上都有红色物质生成
思考:如何才能得到持续稳定的电流?
分析:由于锌片与硫酸铜溶液直接接触,锌片失去的电子一部分经导线传递到铜片表面,另一部分电子直接传递给硫酸铜溶液中的Cu2+,铜在锌片表面析出,锌片表面也构成了原电池,进一步加速铜在锌表面析出,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,不再构成原电池,也就没有电流产生。
盐桥的作用:Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极。
导线传递电子,沟通外电路;而盐桥则传递正负离子,沟通内电路。 盐桥保持溶液电中性,使两个烧杯中的溶液连成一个通路。
此原电池是由两个半电池组成的(锌和锌盐溶液构成锌半电池,铜和铜盐溶液构成铜半电池);半电池中的反应就是半反应,即电极反应。
Fe-2e- =Fe2+
Fe+2H+= Fe2++H2↑
或 Fe+H2SO4=FeSO4+H2↑
失e,沿导线传递,有电流产生
Cu2++2e- =Cu
1、Cu、Fe作两极,稀硫酸作电解质溶液的原电池中:①Cu作____极, ②Fe作____极电极反应式是:负极____________ 正极_____________总反应式是___________________________如将稀硫酸改为浓硝酸则:①Cu作____极, ②Fe作____极电极反应式是:负极____________ 正极_____________________总反应式是_______________________________
Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑ +2H2O
Fe-2e-=Fe2+
2H++2e-=H2↑
Fe+H2SO4=FeSO4+H2↑
Cu-2e-=Cu2+
2NO3-+4H++2e-==2NO2 ↑ +2H2O
2、 实验室氢气选用纯锌粒好还是选用粗锌好?为什么?
选用粗锌好,形成原电池可加快反应。一般先把锌用硫酸铜溶液浸泡一下。
Mg Al
(NaOH溶液)负极:2Al+8OH- -6e- =2AlO2-+4H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑
正极:6H2O+6e- =3H2↑+6OH-
(稀硫酸)负极:Mg -2e- =Mg2+ 正极:2H++2e- =H2↑
原电池原理应用在哪些方面呢?
考点三:原电池原理的应用
学生交流讨论:原电池原理都应用在哪些方面?
电极:负极是Cu,正极可以是Ag或C等。
负极:Cu – 2e- = Cu2+ 正极:2Ag+ + 2e- = 2 Ag
电解质溶液: AgNO3 或者: Cu(NO3)2 、AgNO3
1、根据氧化还原反应电子转移判断电极反应。
2、根据电极反应确定合适的电极材料和电解质溶液。
巩固练习:X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为( )A.X>Y>ZB.X>Z>YC.Y>X>ZD.Y>Z>X
3、比较金属活动性强弱
形成原电池能够加快化学反应速率
下列反应速率最快的一组( )A、纯Zn与1ml/L H2SO4B、纯Zn与18ml/L H2SO4C、纯Zn与4ml/LHNO3D、粗Zn与4ml/LHClE、粗Zn与2ml/L H2SO4,加入几滴CuSO4
2024届高考化学一轮复习原电池化学电源课件: 这是一份2024届高考化学一轮复习原电池化学电源课件,共35页。PPT课件主要包含了考点二化学电源,链接高考等内容,欢迎下载使用。
2024年高考化学一轮复习原电池化学电源课件: 这是一份2024年高考化学一轮复习原电池化学电源课件,共1页。
人教版高考化学一轮复习6.2原电池化学电源课件: 这是一份人教版高考化学一轮复习6.2原电池化学电源课件












