


高考化学 电化学二轮复习 (1)课件PPT
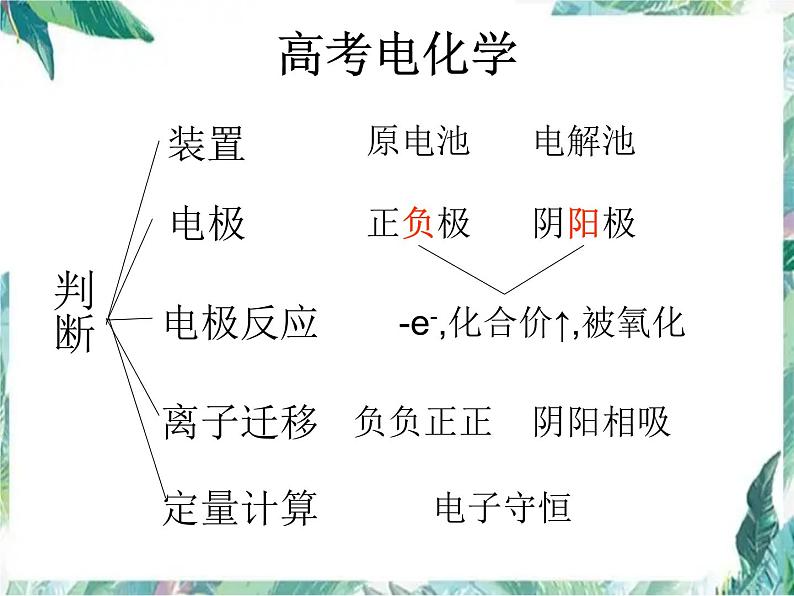
展开这是一份高考化学 电化学二轮复习 (1)课件PPT,共15页。PPT课件主要包含了电极反应式判断,离子迁移判断,介质判断,二次电池,电解池,后续反应,定量计算,原电池,电极判断,电极反应等内容,欢迎下载使用。
(高考真题)镍氢电池(NiMH)目前已经成为混合动力 汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是: Ni(OH)2 + M = NiOOH + MH 已知:6NiOOH + NH3 + H2O + OH-=6 Ni(OH)2 + NO2- 下列说法正确的是( )A.电池放电过程中正极的电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH-B.电池充电过程中OH-离子从阳极向阴极迁移C.电池充电过程中阴极的电极反应式:H2O + M + e-= MH + OH-,H2O中的H被M还原D.NiMH电池可以用KOH溶液、氨水等作为电解质溶液
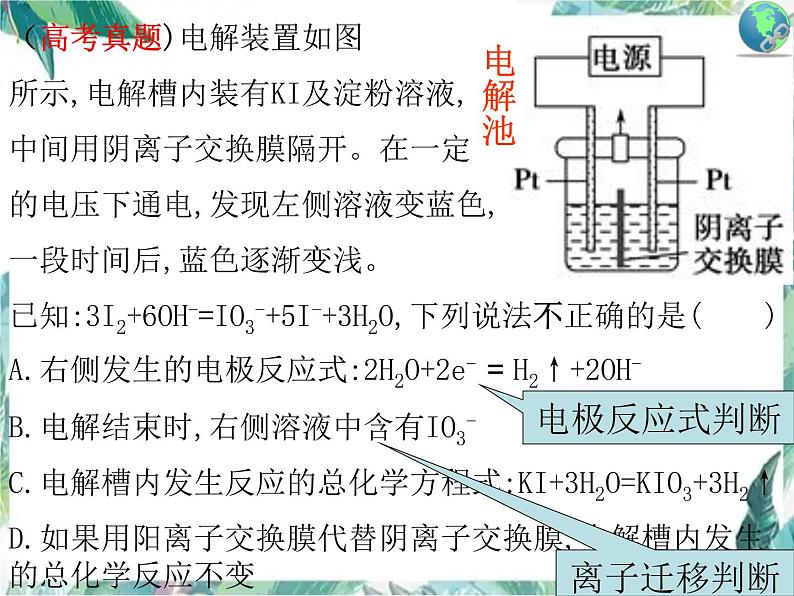
(高考真题)电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法不正确的是( )A.右侧发生的电极反应式:2H2O+2e- = H2↑+2OH-B.电解结束时,右侧溶液中含有IO3-C.电解槽内发生反应的总化学方程式:KI+3H2O=KIO3+3H2↑D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变
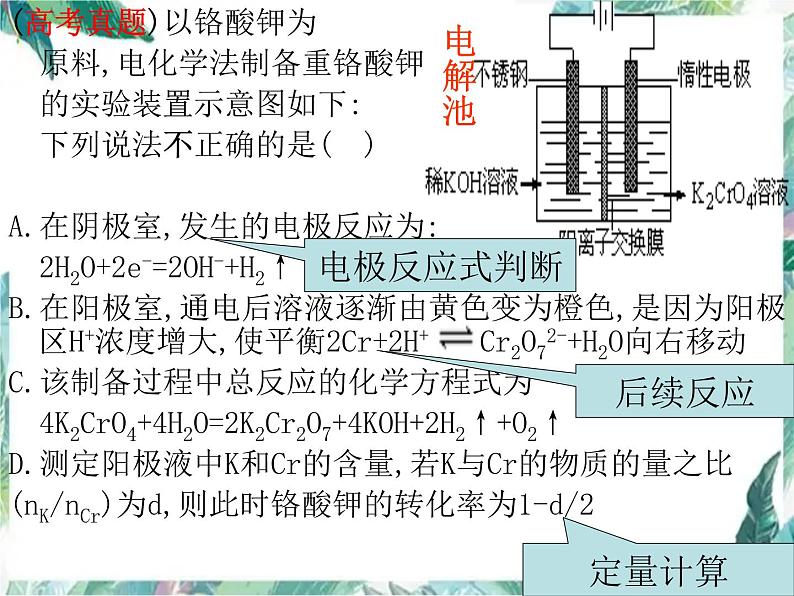
(高考真题)以铬酸钾为 原料,电化学法制备重铬酸钾 的实验装置示意图如下: 下列说法不正确的是( )A.在阴极室,发生的电极反应为: 2H2O+2e-=2OH-+H2↑B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2Cr+2H+ Cr2O72-+H2O向右移动C.该制备过程中总反应的化学方程式为 4K2CrO4+4H2O=2K2Cr2O7+4KOH+2H2↑+O2↑D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1-d/2
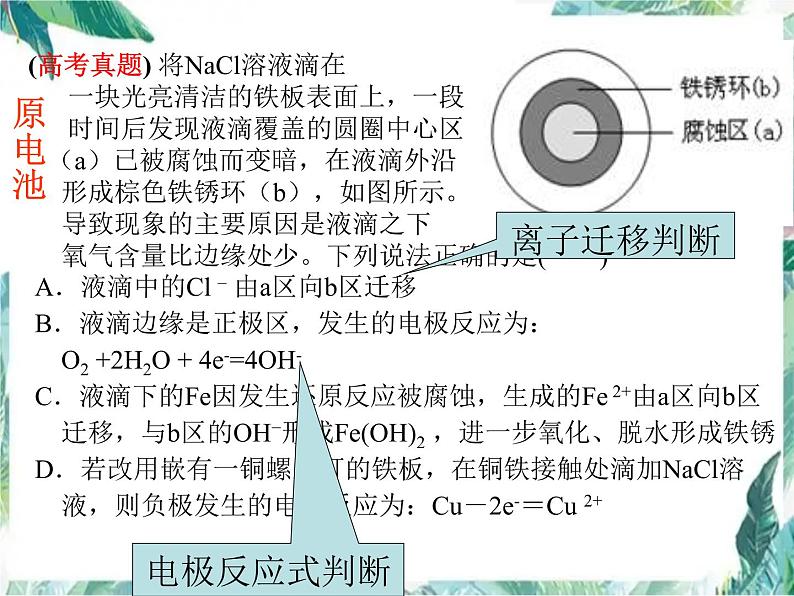
(高考真题) 将NaCl溶液滴在 一块光亮清洁的铁板表面上,一段 时间后发现液滴覆盖的圆圈中心区 (a)已被腐蚀而变暗,在液滴外沿 形成棕色铁锈环(b),如图所示。 导致现象的主要原因是液滴之下 氧气含量比边缘处少。下列说法正确的是( ) A.液滴中的Cl – 由a区向b区迁移 B.液滴边缘是正极区,发生的电极反应为: O2 +2H2O + 4e-=4OH- C.液滴下的Fe因发生还原反应被腐蚀,生成的Fe 2+由a区向b区 迁移,与b区的OH−形成Fe(OH)2 ,进一步氧化、脱水形成铁锈 D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶 液,则负极发生的电极反应为:Cu-2e-=Cu 2+
(高考真题) Li-Al/FeS电池是一种正在开发 的车载电池,该电池中正极的电极反应式为: 2Li++FeS+2e-=Li2S+Fe有关该电池的下列说 中,正确的是( ) A.Li-Al在电池中作为负极材料,该材料中Li的 化合价为+1价 B.该电池的电池反应式为:2Li+FeS=Li2S+Fe C.负极的电极反应式为Al-3e-=Al3+ D.充电时,阴极发生的电极反应式为: Li2S+Fe-2e-=2Li++FeS
例1:发展混合动力车是实施节能减排的重要措施之一。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。混合动力车的电动机目前一般使用的是镍氢电池,它采用镍的化合物为正极,储氢金属(以MHn表示)为负极,KOH为电解液,其充放电总反应式为:H2+2NiOOH 2Ni(OH)2。下列说法正确的是 (不定项选择)( ) A.在上坡或加速时,甲电极为负极, 其中的M被氧化 B.在上坡或加速时,乙电极周围 溶液的pH将增大 C.在上坡或加速时,溶液中的K+ 向甲电极迁移 D.在刹车和下坡时,甲电极的电极 反应式为:2H2O+2e-=H2↑+2OH- E.在刹车和下坡时,乙电极增重
各类数码产品中的锂离子电池
例2:液态锂离子电池已经成为新一代实用化的二次电池,广泛应用于手机、电脑等数码产品。正极采用锂化合物Li1-xCO2 (0<x≤1),负极为锂原子嵌入石墨形成的复合材料LiC6,电解质为溶解有锂盐LiPF6、LiAsF6等的有机溶液,电池反应为: Li1-xCO2+LiC6 LiCO2+Li1-xC6。下列有关说法不正确的是( )A.将LiCO2改写成为氧化物的形式为Li2O·C2O3 B.锂离子电池放电时电池内部Li+向正极移动C.电流充电时,LiCO2发生还原反应 D.电池放电时,负极反应为:LiC6-xe-=Li1-xC6+xLi+
例3.工业上电解法处理含镍酸性废水并得到单质Ni的原 理如图。下列说法不正确的是(不定项选择)( ) 已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度) A. 图2中左侧通入的气体为CH4,发生的电极反应为: CH4 + 4CO32- - 8e- =5CO2 + 2H2O B.若2中电池能持续放电,则该隔膜为阳离子交换膜 C. A中碳棒为阳极,发生的电极反应为: 4OH--4e-=O2↑+2H2O D.为了提高Ni的产率,电解过程中需要控制废水pH E.若去掉1中阳离子膜,将A、B两室合并,则电解总反 应式方程式改变 F.电解过程中,若消耗2中CH4 280mL(标况下),此 时A的质量变化为3.1g,B中NaCl溶液的物质的量浓度 约为0.1ml∕L
相关课件
这是一份2023届高考化学二轮复习电化学原理课件,共31页。PPT课件主要包含了考情预测,Content,电极的判断方法,其他新型电池,电解精炼铜,化学腐蚀与电化学腐蚀,金属的防护,典例集训等内容,欢迎下载使用。
这是一份2022版《导与练》高考化学二轮复习 区间五 电化学课件PPT,共58页。PPT课件主要包含了命题点1,新型化学电源,命题点2,命题点3,命题点4,命题点5,金属的腐蚀与防护,命题点6,考情分析与预测,知能点1等内容,欢迎下载使用。
这是一份电化学 高考二轮复习课件PPT,共30页。PPT课件主要包含了变式训练等内容,欢迎下载使用。












