






中考化学二轮复习专项突破---酸碱盐专题复习课件
展开初步学会物质鉴别、框图推断、除杂题的解题思路和方法。
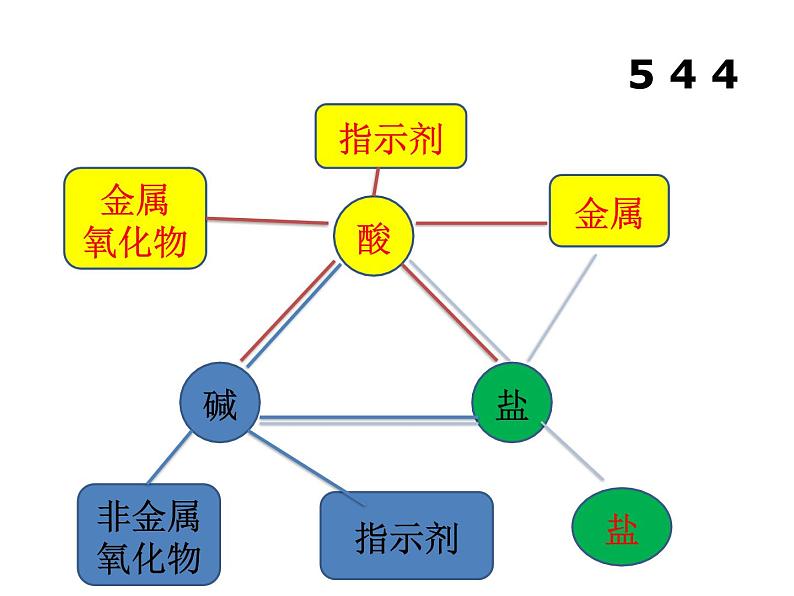
系统梳理酸碱盐的化学性质,能快速判断各类物质间发生的化学反应。
一、酸碱盐的化学性质5 4 4
二、物质的鉴别: 1.解题原则:依据物质的性质和离子(CO32-、 Cl-、SO42-) 的鉴别方法逐一鉴别;
2.思路:1)先给被鉴物质分类,若是酸碱首选酸碱 指示剂;若是同类物质则根据离子鉴别; 2)若用水鉴别则是根据物质的溶解性和溶解 过 程中的热量变化(NaOH、NH4NO3)来鉴别。
3.步骤: 取样→操作→ 现象→ 结论
4.要求:最简单的操作 最明显的现象 最明确的结论
解题基础:“两酸两碱”的鉴别
HCl、H2SO4
先鉴别硫酸,再鉴别盐酸
NaOH 、Ca(OH)2
通入CO2 或加入Na2CO3溶液
4.题型:
1)任选试剂的鉴别:根据物质的性质选择试剂
2)只用一种试剂一次性的鉴别:加入的试剂有几种物质就要出现几个现象 如何鉴别氢氧化钠、盐酸和氯化钠溶液?
3)不用其他任何试剂的鉴别:先观察溶液颜色,鉴出有色溶液;然后将每一次鉴出物作为试剂加入其余物质逐一鉴别。
如何鉴别①氢氧化钠②硝酸钾③氯化铁④氯化镁四瓶溶液?
3)不用其它试剂的鉴别: 不用其它试剂,用最简捷的方法鉴别:①氢氧化钠②硫酸镁③硝酸钡④氯化铁⑤氯化钾五种溶液,则被鉴别出来的物质的正确的顺序是( ) A.①②③④⑤ B.④①②③⑤ C.④③①②⑤ D.②③①④⑤
题型:框图推断题分值: 8分左右,占分值的12%;题号:近十年中考化学卷第14题。
紫红色单质: (一般用作导线);
红棕色粉末: (赤铁矿、铁锈)。
2.溶液颜色——“铜蓝铁黄亚铁绿”
3.沉淀颜色——“五白一蓝一红褐”
黑色:C粉、CuO、MnO2、Fe3O4、Fe粉;
蓝色: 、CuCl2等含Cu2+的溶液;
浅绿色: 、FeCl2等含Fe2+的溶液 ;
棕黄色: 、Fe2(SO4)3含Fe3+的溶液。
蓝色: ; 红褐色: ;
白色:(可溶酸)CaCO3、BaCO3、Mg(OH)2,
(不溶酸) 、 。
3.人体胃液中帮助消化的物质(酸)是 ;
1.能使澄清石灰水变浑浊的气体是 ;
2.有剧毒、与血红蛋白结合的气体是 ;
4.常用的食品干燥剂是 ;
5.一种重要的调味品,常用来腌渍蔬菜的是 ;
6.能跟水反应,且反应放出热量的常见金属氧化物是
7.改良酸性土壤的碱是 ,俗名为纯碱的是 。
8.作糕点发酵粉的盐是 ;为建筑材料的主要成分
,常用作补钙剂的盐是 。
NaCl
11. 组成元素相同的物质: 液体: 。 气体: 。
9.常温下是液体且相对分子质量最小的氧化物 ;
10.最轻的气体是 ;最简单的有机物是 ;
1.A B+C,A一般是 ,生成H2和O2。
2.A B+C,A一般是 ,生成CaO和CO2。
3. A+B C+D,一般是CO炼铁,C还原CuO 。
若A、B有一种为气体或红色粉末,一般是CO炼铁。
若A、B均为黑色固体,一般为C还原CuO。
A + B C,A、 B一般是CO2和C,生成 。
2H2O ═ 2H2↑+ O2 ↑CaCO3 ═ CaO + CO2↑ 3CO+ Fe2O3 ═ 2Fe + 3CO2 (高炉炼铁) C+ 2CuO ═ 2Cu + CO2↑
A(赤铁矿) C 浅绿色溶液E
A B C 白色沉淀
A B 有色溶液C 蓝色沉淀
A(红色) 有色溶液B 红褐色沉淀C
A(黑色) 无色气体C 剧毒气体D
例(平凉中考真题) A~H是初中化学常见物质。 ◆ A是人体胃液中帮助消化的物质, ◆ B用于改良酸性土壤。
(2)A转化为E的化学方程式为 ,其反应基本类型属于 ;B转化为H的化学方程式为 。
(1)D的化学式为: 。
(3)分别写出物质F和H的一种用途 ; 。
Fe + 2HCl ==FeCl2+ H2↑
Ca(OH)2 + Na2CO3 ===CaCO3↓+ 2NaOH
解题原则:不增、不减、易分离。①“不增”:加入的除杂试剂只能跟杂质反应且不能引入新的杂质;②“不减”:除杂试剂不能与被提纯物质反应。 ③“易分离”:除杂后的生成物及除杂试剂和被提纯的物质易分离,即生成物要为气体或沉淀。
2023年中考化学二轮复习专项突破课件---与酸碱盐反应有关的图像分析: 这是一份2023年中考化学二轮复习专项突破课件---与酸碱盐反应有关的图像分析,共14页。PPT课件主要包含了专项精讲,专项精练等内容,欢迎下载使用。
中考化学二轮复习专项突破---溶液的酸碱性及中和反应课件PPT: 这是一份中考化学二轮复习专项突破---溶液的酸碱性及中和反应课件PPT,共1页。
中考化学二轮复习专项突破---酸碱盐专题复习课件PPT: 这是一份中考化学二轮复习专项突破---酸碱盐专题复习课件PPT,共25页。PPT课件主要包含了学习目标,酸碱盐化学性质关系图等内容,欢迎下载使用。












