



初中化学人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应图片课件ppt
展开【教学目标】知识与技能目标 1、知道酸和碱之间能发生中和反应,能写出有关的化学方程式,并初步领会中和反应的实质。 2、初步学会借助指示剂判断物质是否发生化学反应。 3、了解中和反应在生活生产中的应用。过程与方法目标 1、通过学生自主的实验探究,初步学会判断化学反应是否发生的方法。 2、通过合作探究、讨论交流,培养学生发现问题、解决问题以及动手实践和团结协作的能力。情感态度与价值观目标 1、进一步增强学习化学的兴趣。 2、培养学生实事求是的科学精神。 3、通过中和反应在生活中的应用,体会化学与社会的密切关系,增强学生对社会的责任感。
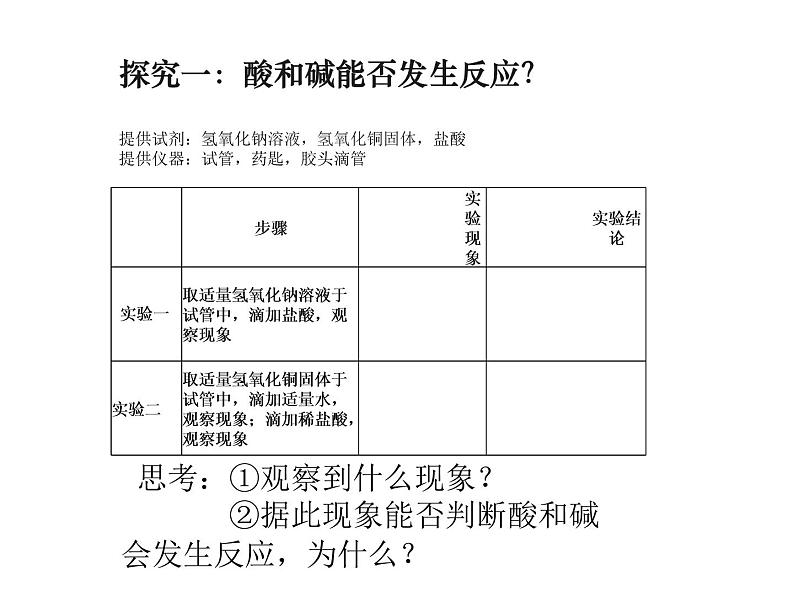
提供试剂:氢氧化钠溶液,氢氧化铜固体,盐酸提供仪器:试管,药匙,胶头滴管
思考:①观察到什么现象? ②据此现象能否判断酸和碱 会发生反应,为什么?
探究一:酸和碱能否发生反应?
讨论并设计实验方案验证: 氢氧化钠和稀盐酸发生了化学反应
思考:①加酚酞和石蕊的作用是什么? ②反应过程中溶液颜色为什么会发生变化? ③如何操作才能使酸和碱恰好完全反应?
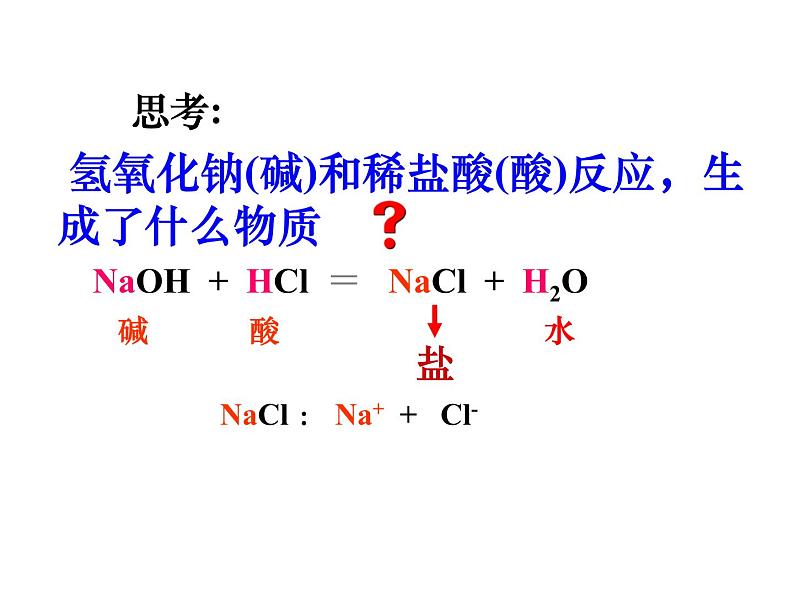
氢氧化钠(碱)和稀盐酸(酸)反应,生成了什么物质
NaOH + HCl = NaCl + H2O
NaCl : Na+ + Cl-
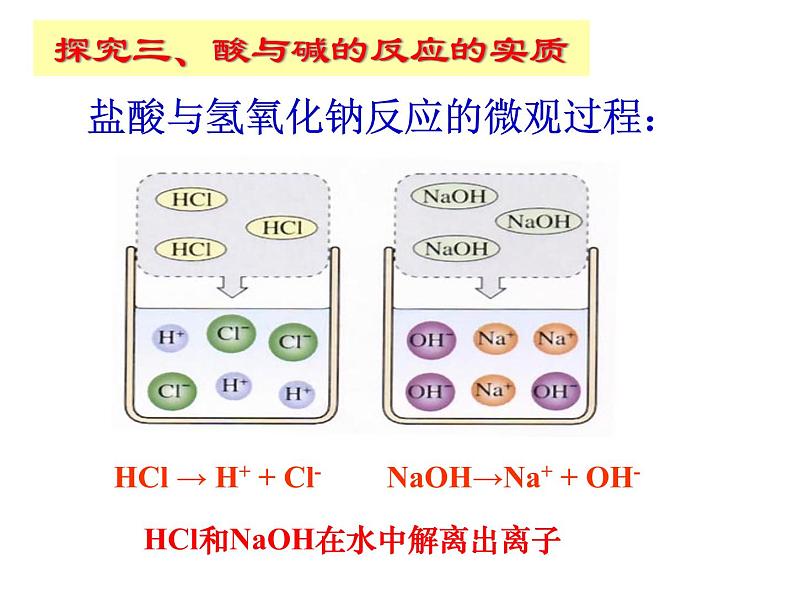
盐酸与氢氧化钠反应的微观过程:
HCl → H+ + Cl-
NaOH→Na+ + OH-
HCl和NaOH在水中解离出离子
探究三、酸与碱的反应的实质
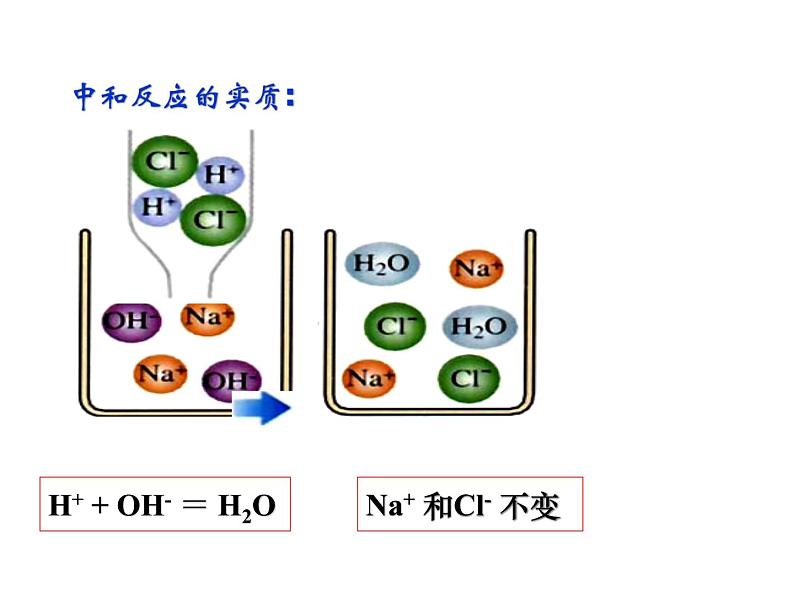
H+ + OH- = H2O
Na+ 和Cl- 不变
类似上面的反应,例如氢氧化钙[ Ca(OH)2 ]与稀盐酸(HCl)、氢氧化钠(NaOH )与稀硫(H2SO4 )、氢氧化铝[Al(OH)3]与稀盐酸(HCl)都能发生类似的反应,你能写出它们的化学方 程式吗?
下列反应有何共同特点?
NaOH+HCl == NaCl + H2O
Ca(OH)2+2HCl==
CaCl2 + 2H2O
2NaOH + H2SO4==
Na2SO4 + 2H2O
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
用碱性物质(例如熟石灰)进行中和处理。
你能写出化学方程式吗?请试一下。
Ca(OH)2 + H2SO4 CaSO4 + 2H2O
探究四、中和反应在实际中的应用
(1)胃酸的主要成分是 。胃药的主要 成分是氢氧化铝。
氢氧化铝能中和胃酸,你能写出化学方程式吗?
Al(OH)3 + 3HCl = AlCl3 + 3H2O
(2)被蚊虫叮咬后,涂一些含有碱性物质的药水。
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
中和反应在实际中有哪些应用?
(1)醋去除热水瓶水垢(水垢主要是Mg(OH)2) (2)被蚊虫叮咬处肿成大包(3)早晨空腹时,为什么要少吃苹果(或酸性食物)? (4)用醋降低或除去皮蛋涩味
2、中和反应在工农业生产和日常生活中有广泛的用途,下列应用与中和反应原理无关的是( )A. 服用含Al(OH)3的药物治疗胃酸过量B. 使用熟石灰改良酸性土壤C. 用熟石灰和硫酸铜配制波尔多液D. 用NaOH溶液洗涤石油产品中的残余硫酸
1.下列反应属于中和反应的是( )A.2NaOH+CO2==Na2CO3+H2OB.Cu(OH)2+H2SO4==CuSO4+2H2OC.Fe2O3+6HCl==2FeCl3+3H2O D.Ca(OH)2+2HCl==CaCl2+2H2O
3.有些胃药中含有氢氧化铝[Al(OH)3],它在人的胃内起什么作用?试写出反应的化学方程式。
4.一些国家正在试用碳酸水浇灌某些植物,其作用是( )A.调节土壤的pH,改良酸性土壤B.调节土壤的pH,改良碱性土壤C.促进植物的光合作用D.在植物上方形成温室
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3能中和胃中过量的盐酸
如何知道食醋和柠檬汁哪种酸性更强?
初中化学人教版九年级下册课题2 酸和碱的中和反应优质课件ppt: 这是一份初中化学人教版九年级下册<a href="/hx/tb_c9871_t3/?tag_id=26" target="_blank">课题2 酸和碱的中和反应优质课件ppt</a>,共41页。PPT课件主要包含了想一想,金属离子,酸根离子,中和反应的实质,H2O,小试牛刀,中和反应的应用,探究结论,反思提升等内容,欢迎下载使用。
化学九年级下册第十单元 酸和碱课题2 酸和碱的中和反应备课ppt课件: 这是一份化学九年级下册第十单元 酸和碱课题2 酸和碱的中和反应备课ppt课件,共36页。PPT课件主要包含了发现问题,知识讲解,归纳小结,酸碱性,酸碱度,利用下表归纳相关规律,一些物质的pH,进行实验,提出疑问,实验现象无明显现象等内容,欢迎下载使用。
人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应多媒体教学课件ppt: 这是一份人教版九年级下册第十单元 酸和碱课题2 酸和碱的中和反应多媒体教学课件ppt,共18页。PPT课件主要包含了HCl,NaOH,中和反应的实质,改变土壤的酸碱性,用熟石灰中和,处理工厂的废水,用于医药,氢氧化铝,氢氧化铝能中和胃酸等内容,欢迎下载使用。












