高中化学第一章 化学反应的热效应第二节 反应热的计算教案及反思
展开盖斯定律—教学设计
课标分析:
内容要求: 1.2 了解盖斯定律及其简单应用
学业要求:能进行反应焓变的简单计算
教材分析:
本节课内容是高中化学选择性必修1化学反应原理第一章化学反应的热效应第二节反应热的计算第一课时的内容,是中学化学基本理论的重要组成部分,是热化学理论性概念。本节旨在学生了解盖斯定律,并从定量的角度来进一步认识物质发生化学反应伴随的热效应;通过本节课的学习,学生能够了解盖斯定律并利用盖斯定律进行简单计算。
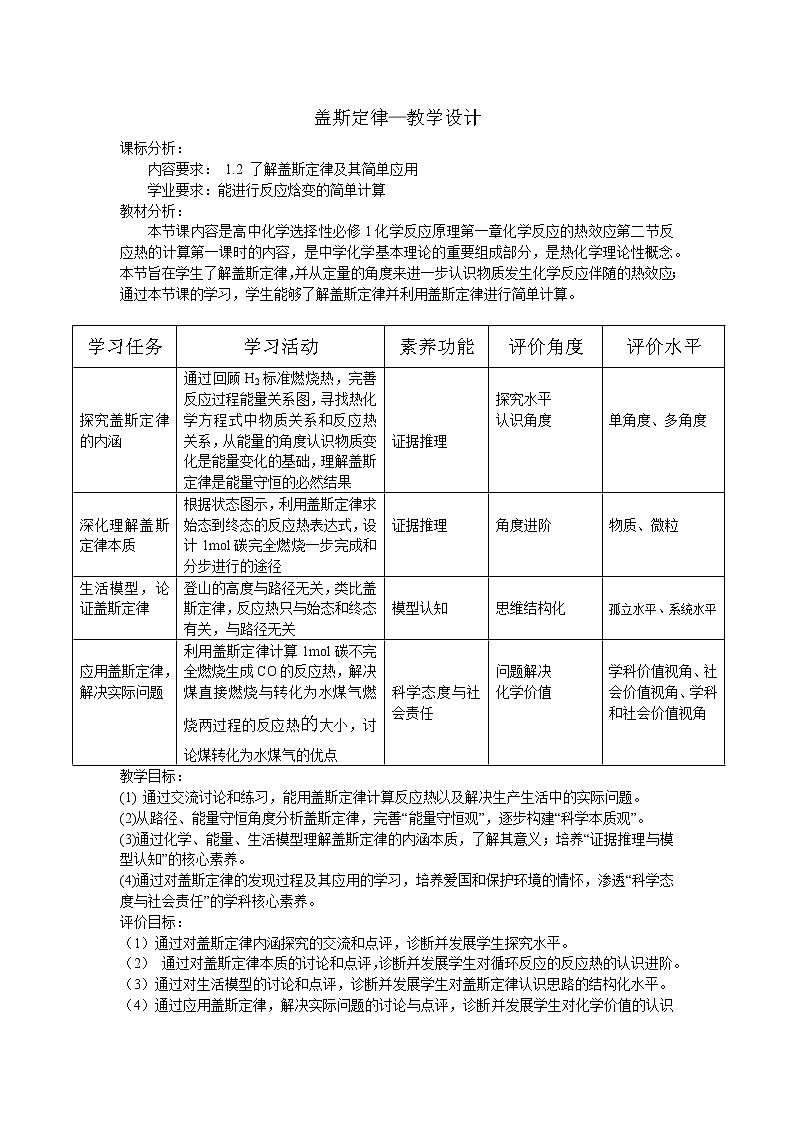
学习任务 | 学习活动 | 素养功能 | 评价角度 | 评价水平 |
探究盖斯定律的内涵 | 通过回顾H2标准燃烧热,完善反应过程能量关系图,寻找热化学方程式中物质关系和反应热关系,从能量的角度认识物质变化是能量变化的基础,理解盖斯定律是能量守恒的必然结果 |
证据推理 |
探究水平 认识角度 |
单角度、多角度 |
深化理解盖斯定律本质 | 根据状态图示,利用盖斯定律求始态到终态的反应热表达式,设计1mol碳完全燃烧一步完成和分步进行的途径 |
证据推理 |
角度进阶 |
物质、微粒 |
生活模型,论证盖斯定律 | 登山的高度与路径无关,类比盖斯定律,反应热只与始态和终态有关,与路径无关 |
模型认知 |
思维结构化 |
孤立水平、系统水平 |
应用盖斯定律,解决实际问题 | 利用盖斯定律计算1mol碳不完全燃烧生成CO的反应热,解决煤直接燃烧与转化为水煤气燃烧两过程的反应热的大小,讨论煤转化为水煤气的优点 |
科学态度与社会责任 |
问题解决 化学价值 |
学科价值视角、社会价值视角、学科和社会价值视角 |
教学目标:
(1) 通过交流讨论和练习,能用盖斯定律计算反应热以及解决生产生活中的实际问题。
(2)从路径、能量守恒角度分析盖斯定律,完善“能量守恒观”,逐步构建“科学本质观”。
(3)通过化学、能量、生活模型理解盖斯定律的内涵本质,了解其意义;培养“证据推理与模型认知”的核心素养。
(4)通过对盖斯定律的发现过程及其应用的学习,培养爱国和保护环境的情怀,渗透“科学态度与社会责任”的学科核心素养。
评价目标:
(1)通过对盖斯定律内涵探究的交流和点评,诊断并发展学生探究水平。
(2) 通过对盖斯定律本质的讨论和点评,诊断并发展学生对循环反应的反应热的认识进阶。
(3)通过对生活模型的讨论和点评,诊断并发展学生对盖斯定律认识思路的结构化水平。
(4)通过应用盖斯定律,解决实际问题的讨论与点评,诊断并发展学生对化学价值的认识水平。
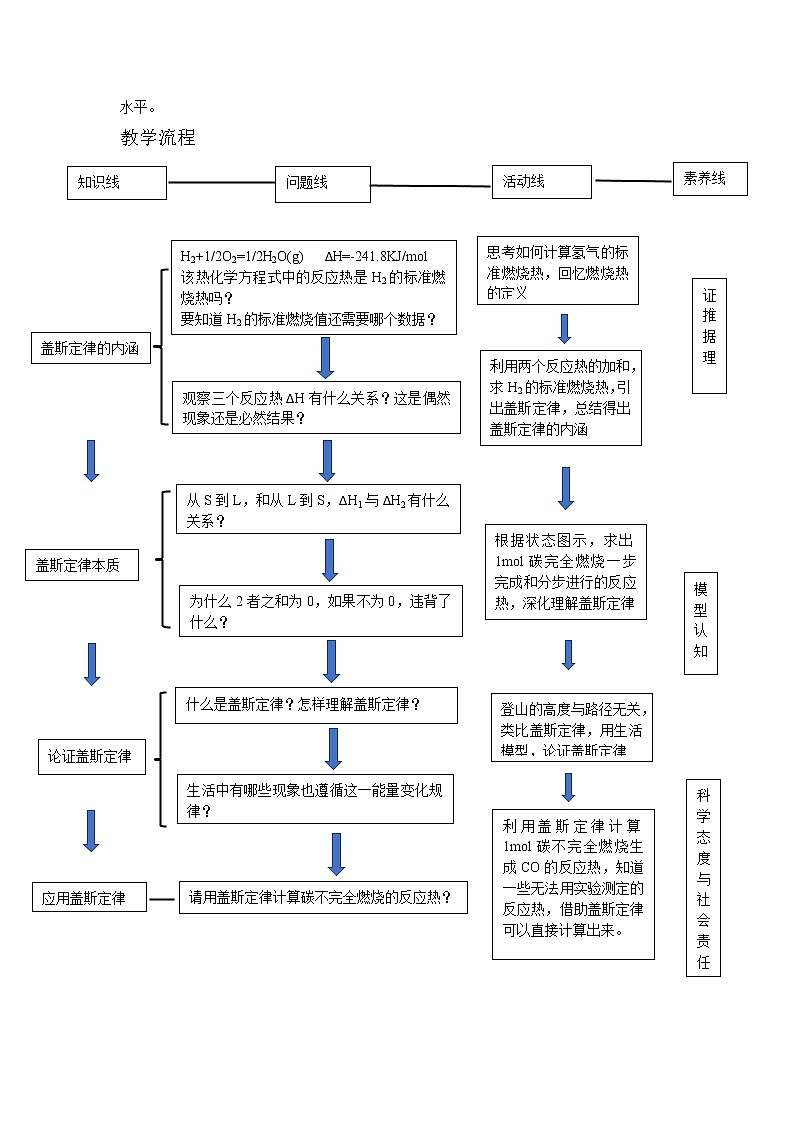
教学流程
教学过程
活动元1 证据推理 引出盖斯定律 | |||
时间 | 教师活动 | 学生活动 | 设计意图 |
2min
4min
7min
| 请同学观察下面热化学方程式:H2(g)+1/2O2(g)=1/2H2O(g) ΔH1=-241.8KJ/mol 在反应过程能量图中标注反应物和生成物的能量; 问:该热化学方程式中的反应热是H2的标准燃烧热吗?
追问:如果要计算H2的标准燃烧值还需要哪个数据? 已知:H2O(g)= H2O(l) ΔH2=-44KJ/mol,请同学们是写出氢气标准燃烧热的热化学方程式,并完善能量图。 提问:观察思考三个ΔH有什么关系,三个方程式之间又有怎样的关系? 设问:这是偶然现象还是必然结果? 假设一个体系从始态到终态的反应热ΔH1 ‹ 0;问:从终态到始态的ΔH2与0是什么关系?ΔH1 与 ΔH2的和是多少呢? 追问:为什么二者之和等于0?如果不等于0,违背了什么? 归纳总结:经历一个循环后,体系中的反应物并没有改变,能量也不可能变化。出现上述现象是必然结果! 阅读教材p13页,盖斯定律的内容 | 思考,回答问题:
燃烧热:1mol可燃物完全燃烧生成稳定化合物时所放出的热 1mol气态水转化为液态水时所放的热 书写热化学方程式,完善能量图: H2(g)+1/2O2(g)=1/2H2O(g) ΔH3=-285.8KJ/mol 思考,回答问题:ΔH3 = ΔH1 + ΔH2 方程式3等于方程式1加方程式2 ΔH1 ‹0
S(始态) L(终态)
ΔH2>0 ΔH1 + ΔH2 = 0
违背质量守恒定律
总结:反应物和生成物确定,能力就确定,与反应途径无关。 阅读教材,完善笔记 | 回忆燃烧热的定义,求H2的标准燃烧热,引出盖斯定律,从能量守恒的去理解盖斯定律的内涵
|
活动元2 模型认知 理解定律本质 | |||
5min
4min
4min | 引导学生分析
求从始态到终态采用不同路径的ΔH值,这些值之间有怎样的关系?
练习巩固 若有一个反应体系为1mol的碳,完全燃烧生成CO2,请同学们分别设计一步完成和分步进行的途径,思考不同途径的反应热有什么关系? 提问:生活中有没有类似的实例,也遵循这一能量变化规律? | ΔH1 A ΔH2 始态S ΔH L终态 ΔH3 BΔH4 CΔH5 DΔH6 ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5+ΔH6 ΔH2=ΔH - ΔH1 设计方案: 一步:C(s)+ O2(g) = CO2(g) ΔH 两步: C(s)+ 1/2O2(g) = CO(g) ΔH1 CO(g)+ 1/2O2(g) = CO2(g) ΔH2 ΔH=ΔH1+ΔH2 小组讨论交流:生活中的登山现象,物理中的势能、高度、做功等
| 根据状态图示分析,练习碳完全燃烧一步完成和分步进行的反应热,深化理解盖斯定律
|
活动元3 应用定律 解决实际问题 | |||
8min
4min | 过渡:有同学可能疑问,学了这么久的盖斯定律有什么用呢?反应热不是可以通过实验方法测定吗? 设疑:碳不完全燃烧的产物为一氧化碳,该过程的反应热用实验能否测定?为什么? 碳和一氧化碳的燃烧热我们都可以通过实验测定,那可否利用其求出碳不完全燃烧的产物为一氧化碳的反应热呢?(碳和一氧化碳完全燃烧的燃烧热分别为-393.5 KJ/mol和-283.0 KJ/mol)
引导学生分析求解
问:代数加减法中,计算所求反应的焓变,如何找出可用的已知热化学方程式? 追问:1、如何确定已知反应的加和减 2、如何消去目标反应物中没有的物质? 总结:一些无法用实验测定的反应热,借助盖斯定律可以直接计算出来。
练习巩固:教材p17页 4、6题 | 思考,回答问题:
不能,因为生成一氧化碳的同时,有部分一氧化碳会转化成二氧化碳。
根据碳和一氧化碳的燃烧热,设计方案求:碳不完全燃烧的产物为一氧化碳的反应热 方案: C(s)+ O2(g)=CO2(g)ΔH1=-393.5 KJ/mol ① CO(g)+1/2O2(g)=CO2(g)ΔH2=-283KJ/mol② ①-②得 C(s)+ 1/2O2(g) = CO(g) ΔH3=-110.5KJ/mol
小组讨论: 总结:目标物质,已知中找,同向加,异向减 过渡物,要消去,同侧加,异向减 焓变关系:系数同,不用官,系数不同,焓变不同。
完成练习 | 通过具体的实例,认识盖斯定律的价值,通过巩固练习,学会应用盖斯定律 |
| 总结、布置作业 | 回忆本节课内容 |
|
板书设计:盖斯定律
1、 内容:
2、 论证:
3、 应用:
高中人教版 (2019)第二节 电解池优秀教案设计: 这是一份高中人教版 (2019)第二节 电解池优秀教案设计,共5页。教案主要包含了教学目标,教学重难点,教学过程,演示实验,得到结论,设计意图,知识巩固,学生活动等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 原电池优质课教案设计: 这是一份高中化学人教版 (2019)选择性必修1第一节 原电池优质课教案设计,共8页。教案主要包含了教学目标,教学重难点,教学过程,设计意图,引入课题,思考交流,课堂专练,规律小结等内容,欢迎下载使用。
高中人教版 (2019)第四节 化学反应的调控优质教案: 这是一份高中人教版 (2019)第四节 化学反应的调控优质教案,共6页。教案主要包含了导入新课,新课讲授等内容,欢迎下载使用。