
2022届高考化学二轮复习专题06电化学原理应用
展开这是一份2022届高考化学二轮复习专题06电化学原理应用,共24页。试卷主要包含了单选题,共13小题,非选择题,共6小题等内容,欢迎下载使用。
2022届高考化学二轮复习专题06电化学原理应用
一、单选题,共13小题
1.(2021·河北·武安市第一中学高二阶段练习)火星大气中含有大量,一种有参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时
A.负极上发生还原反应 B.在正极上得电子
C.阳离子由正极移向负极 D.将电能转化为化学能
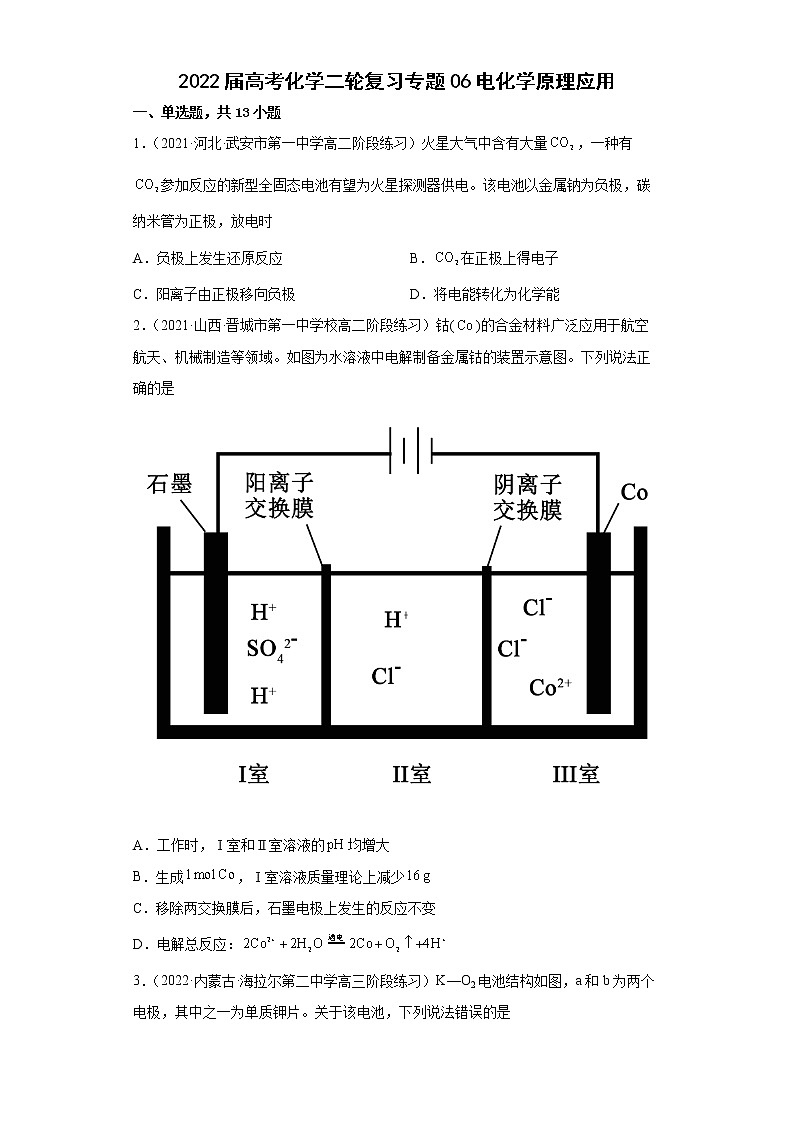
2.(2021·山西·晋城市第一中学校高二阶段练习)钴()的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是
A.工作时,Ⅰ室和Ⅱ室溶液的均增大
B.生成,Ⅰ室溶液质量理论上减少
C.移除两交换膜后,石墨电极上发生的反应不变
D.电解总反应:
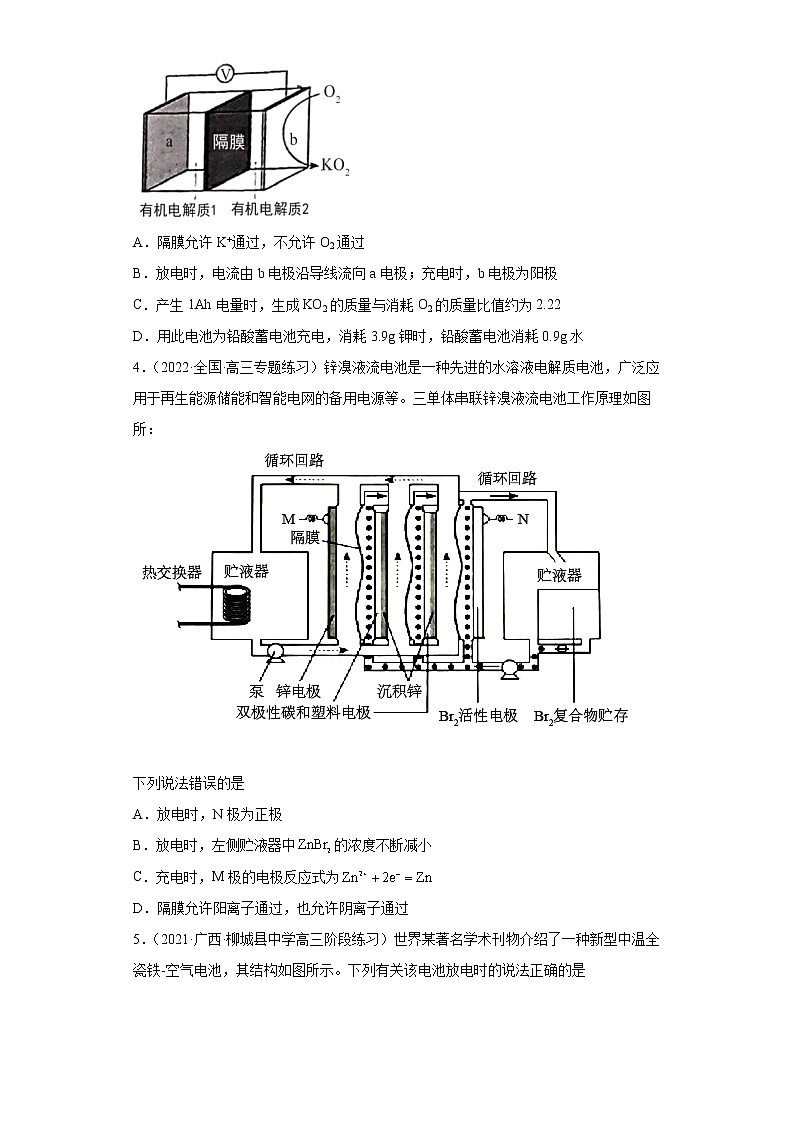
3.(2022·内蒙古·海拉尔第二中学高三阶段练习)K—O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是
A.隔膜允许K+通过,不允许O2通过
B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极
C.产生1Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22
D.用此电池为铅酸蓄电池充电,消耗3.9g钾时,铅酸蓄电池消耗0.9g水
4.(2022·全国·高三专题练习)锌溴液流电池是一种先进的水溶液电解质电池,广泛应用于再生能源储能和智能电网的备用电源等。三单体串联锌溴液流电池工作原理如图所:
下列说法错误的是
A.放电时,N极为正极
B.放电时,左侧贮液器中的浓度不断减小
C.充电时,M极的电极反应式为
D.隔膜允许阳离子通过,也允许阴离子通过
5.(2021·广西·柳城县中学高三阶段练习)世界某著名学术刊物介绍了一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时的说法正确的是
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4L(标准状况)空气参与反应,则电路中有4mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
6.(2022·全国·高三专题练习)我国电动汽车产业发展迅猛,多种车型采用三元锂电池,该电池放电时工作原理如图所示。下列说法错误的是
A.无论充电或放电,A极电势均低于B极
B.充电时,外电路中流过0.1mol电子,A极质量减少0.7g
C.放电时,正极反应为Li1-aNixCoyMnzO2+aLi++ae-=LiNixCoyMnzO2
D.失去活性锂元素的三元正极材料可采用化学方法再生,实现循环利用
7.(2022·全国·高三专题练习)一种处理SO2的电化学装置如图所示(已知电极a、b均为石墨烯电极,阳膜只允许H+通过)。下列说法错误的是
A.a是该电池的负极
B.b电极反应式:O2+4e-+4H+=2H2O
C.一段时间后,阳膜左侧硫酸溶液的浓度减小
D.反应过程中,氢离子从阳膜左侧向右侧移动
8.(2022·全国·高三专题练习)已知在同一电池中,正极电势高于负极电势。标准电极常用于测定其它电极的电势,测知电极的电势高于电极的电势。以下说法正确的是
A.溶液可用代替
B.微孔瓷片起到阻隔离子通过的作用
C.电极反应为
D.若把体系换作体系,电压表的示数变大
9.(2022·天津市西青区张家窝中学一模)下列化学用语解释事实或过程正确的是
A.Fe3O4溶于过量稀硝酸中:Fe3O4+8H+=2Fe3++Fe2++4H2O
B.铅蓄电池充电时阴极反应:
C.用足量氨水吸收烟气中的二氧化硫:SO2+2OH-=SO+H2O
D.用酸性高锰酸钾标准溶液滴定草酸:2MnO+16H++5C2O=2Mn2++10CO2↑+8H2O
10.(2022·吉林·东北师大附中模拟预测)NA为阿伏加德罗常数的值。下列说法正确的是
A.100g 60%的乙酸溶液中,其中氧原子数为2NA
B.用惰性电极电解1L 0.2mol/LAgNO3溶液,当两极产生气体的物质的量相等时,电路中通过电子数为0.4NA
C.常温下1L pH=9的醋酸钠溶液中,由水电离出的数目为10-9NA
D.32g Cu与足量的S完全反应转移电子数为NA
11.(2022·北京东城·一模)热激活电池是一种需要达到启动温度才开始工作的电池。一种热激活电池的结构如图1所示,其放电后的产物为Li7Si3和LiMn2O4。
已知:LiCl和KCl混合物的熔点与KCl的物质的量分数的关系如图2所示。
下列说法不正确的是
A.放电时,Li+向b极区移动
B.放电时,a极的电极反应是3Li13Si4-1le-=4Li7Si3+11Li+
C.该电池中火药燃烧产生的热能转化为电能
D.调节混合物中KCl的物质的量分数可以改变电池的启动温度
12.(2022·吉林长春·三模)相比锂电池,钠电池具有性能稳定、安全性好等优点,且可循环使用,寿命较长,对环境较友好。如图是某钠离子二次电池工作原理示意图,电池反应为,下列说法错误的是
A.充电时,N极接电源的负极
B.放电时,导线中每通过1mol电子,理论上M极质量减轻23g
C.放电时,N电极上的电极反应式为
D.理论上,该电池在充、放电过程中,溶液中的钠离子浓度始终不变
13.(2022·重庆·模拟预测)某科研团队发明的制取H2O2的绿色方法,原理如图所示,下列说法正确的是
A.Y膜为阳离子交换膜
B.催化剂可加快单位时间内反应中电子的转移数目
C.b极上发生氧化反应
D.生成H2O2的总反应为2H2O+O2=2H2O2
二、非选择题,共6小题
14.(2021·北京·模拟预测)硒和铬元素都是人体必需的微量元素,请回答下列问题:
(1)硒与氧为同主族元素,硒的原子结构示意图为_______。
(2)由硒在周期表中的位置分析判断下列说法不正确的是_______(填标号)。
A.沸点:H2Se>H2S>H2O B.热稳性:PH3>H2S>H2Se
C.还原性:H2Se>HBr>HF D.原子半径:Ge>Se>Cl
(3)人体内产生的活性氧能加速人体衰老,被称为“生命杀手”,化学家尝试用及其他富硒物质清除人体内的活性氧,此时Na2SeO3表现出_______性。
(4)+6价铬的化合物毒性较大,用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有)的原理示意图如下图所示。
①M极的电极反应式为_______,N极附近的pH_______(填“变大”或“变小”或“不变”)
②写出电解池中转化为Cr3+的离子方程式_______。
15.(2021·北京延庆·一模)合成氨对人类生存具有重大意义:
(1)传统工业合成法:反应为N2(g)+3H2(g)2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
①N2的电子式是___。
②写出步骤b的化学方程式___。
③由图像可知合成氨反应的∆H__0(填“>”、“<”或“=”)。
④工业生产中,除了温度采用400℃—500℃外,促进该反应正向进行的措施是(至少两点)___。
(2)电化学制备方法:目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:
①氢化酶区域发生反应的离子方程式是___。
②溶液中H+的移动方向是___(填“向左”或“向右”)。
③下列说法正确的是___。
A.该装置可以实现电能转化为化学能
B.电极a是燃料电池的负极
C.该方法相较于传统工业合成方法具有条件温和,对环境友好等优点
16.(2022·辽宁沈阳·一模)氮及其化合物在工农业生产和生命活动中起着重要的作用。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一 个十年行动纲领。氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的价电子轨道表示式 ___________ ;基态铬、氮原子的未成对电子数之比为___________。
(2)NH3也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。其反应机理如图所示(其中H2O和NaCl 略去)。NaClO 氧化NH3的总反应化学程式为 ___________。
(3)改变对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图所示,则除氨气过程中最佳的值约为___________。
(4)室温下,用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而减小的是___________。
A.) B.
C.c(H+) D.
(5)25°C时,将amol NH4NO3溶于水,向该溶液中滴加bL氨水后溶液呈中性,滴加氨水的过程中水的电离平衡将___________ (填 “正向”、“逆向”或“不”)移动。
(6)工业上利用NH3制备联氨(N2H4)装置如下图,其阳极电极反应式为___________。
17.(2022·辽宁·模拟预测)全球气候变化对全球人类社会构成重大威胁。政府气候变化专门委员会(IPCC)报告认为,为了避免极端危害,世界必须将全球变暖幅度控制在1.5℃以内。只有全球都在21世纪中叶实现温室气体净零排放,才能有可能实现这一目标。请根据二氧化碳的利用回答下列问题:
(1)CO2催化氢化制甲烷的研究过程如图1:
①上述过程中,加入铁粉的作用是__。
②HCOOH是CO2转化为CH4的中间体:CO2HCOOHCH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是__。
(2)一定条件下,Pd—Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为__。
(3)CO2加氢还可制备甲酸(HCOOH)。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=__k正。
②温度为T2℃时,k正=1.1k逆,则T2℃时平衡压强__(填“>”“<”或“=”)T1℃时平衡压强。
(4)N—甲基二乙醇胺(用MDEA表示)水溶液具有吸收能力强、对设备腐蚀小等特点,MDEA吸收CO2的反应可以表示为:MDEA(aq)+CO2(g)+H2O(l)MDEAH+(aq)+HCO(aq) △H。
①已知MDEA中的氮具有一元碱(类似于NH3)的性质,Kb=5.2×10-4,已知H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,推测溶液MDEAHHCO3显__性(填酸,碱,中)。
②标准平衡常数Kθ可以表示平衡时各物质的浓度关系:如反应A(aq)+2B(g)C(g)+D(aq)的Kθ=,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=__(计算结果保留两位小数)。
(5)设计二氧化碳熔盐捕获及电化学转化装置示意图如图:
a极的电极反应式为__。
18.(2022·浙江·模拟预测)已知20℃下,饱和食盐水质量分数为26.5%,密度为。用惰性电极电解50mLNaCl饱和溶液,分别收集两极气体,一段时间后,测定装置中溶液密度变为1.024。不考虑溶液体积的变化、水气挥发、气体的溶解。请回答:
(1)该饱和食盐水的物质的量浓度为___________。
(2)所得理论上可制得漂白粉有效成分的质量为:___________g。(写出计算过程)
19.(2020·全国·模拟预测)Ⅰ.高铁酸盐在能源、环保等方面有着广泛的用途。高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图是高铁电池的模拟实验装置:
(1)该电池放电时正极的电极反应式为_______。
(2)盐桥中盛有饱和KCl溶液,此盐桥中氯离子向_______(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向_______(填“左”或“右”)移动。
(3)如图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有_______。
Ⅱ.二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取ClO2的新工艺。
(4)阳极产生ClO2的电极反应式:_______。
(5)当阴极产生标准状况下112 mL气体时,通过阳离子交换膜离子的物质的量为_______。
参考答案:
1.B
【解析】
根据题干信息可知,放电时总反应为4Na+3CO2=2Na2CO3+C。
A.放电时负极上Na发生氧化反应失去电子生成Na+,故A错误;
B.放电时正极为CO2得到电子生成C,故B正确;
C.放电时阳离子移向还原电极,即阳离子由负极移向正极,故C错误;
D.放电时装置为原电池,能量转化关系为化学能转化为电能和化学能等,故D错误;
综上所述,符合题意的为B项,故答案为B。
2.D
【解析】
由图可知,该装置为电解池,石墨电极为阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为2H2O-4e-=O2↑+4H+,Ⅰ室中阳离子电荷数大于阴离子电荷数,放电生成的氢离子通过阳离子交换膜由Ⅰ室向Ⅱ室移动,钴电极为阴极,钴离子在阴极得到电子发生还原反应生成钴,电极反应式为Co2++2e-=Co,Ⅲ室中阴离子电荷数大于阳离子电荷数,氯离子过阴离子交换膜由Ⅲ室向Ⅱ室移动,电解的总反应的离子方程式为2Co2++2H2O2 Co +O2↑+4H+。
A.由分析可知,放电生成的氢离子通过阳离子交换膜由Ⅰ室向Ⅱ室移动,使Ⅱ室中氢离子浓度增大,溶液pH减小,故A错误;
B.由分析可知,阴极生成1mol钴,阳极有1mol水放电,则Ⅰ室溶液质量减少18g,故B错误;
C.若移除离子交换膜,氯离子的放电能力强于水,氯离子会在阳极失去电子发生氧化反应生成氯气,则移除离子交换膜,石墨电极的电极反应会发生变化,故C错误;
D.由分析可知,电解的总反应的离子方程式为2Co2++2H2O2 Co +O2↑+4H+,故D正确;
故选D。
3.D
【解析】
由图可知,a电极为原电池的负极,单质钾片失去电子发生氧化反应生成钾离子,电极反应式为K—e-=K+,b电极为正极,在钾离子作用下,氧气在正极得到电子发生还原反应生成超氧化钾;据以上分析解答。
A.金属性强的金属钾易与氧气反应,为防止钾与氧气反应,电池所选择隔膜应允许通过,不允许通过,故A正确;
B.由分析可知,放电时,a为负极,b为正极,电流由b电极沿导线流向a电极,充电时,b电极应与直流电源的正极相连,做电解池的为阳极,故B正确;
C.由分析可知,生成1mol超氧化钾时,消耗1mol氧气,两者的质量比值为1mol×71g/mol:1mol×32g/mol≈2.22:1,故C正确;
D.铅酸蓄电池充电时的总反应方程式为2PbSO4+2H2O=PbO2+Pb+2H2SO4,反应消耗2mol水,转移2mol电子,由得失电子数目守恒可知,耗钾时,铅酸蓄电池消耗水的质量为×18g/mol=1.8g,故D错误;
故选D。
4.B
【解析】
由图可知,放电时,N电极为电池的正极,溴在正极上得到电子发生还原反应生成溴离子,电极反应式为Br2+2e-=2Br-,M电极为负极,锌失去电子发生氧化反应生成锌离子,电极反应式为Zn—2e-=Zn2+,溴离子进入左侧,左侧溴化锌溶液的浓度增加;充电时,M电极与直流电源的负极相连,做电解池的阴极,N电极与直流电源的正极相连,做阳极。
A.由分析可知,放电时,N电极为电池的正极,故A正确;
B.由分析可知,放电时,溶液中有Zn2+与Br-生成,通过循环回路,左侧储液器中溴化锌的浓度增大,故B错误;
C.由分析可知,充电时,M电极与直流电源的负极相连,做电解池的阴极,锌离子在阴极上得到电子发生还原反应生成锌,电极反应式为Zn2++2e-=Zn,故C正确;
D.由分析可知,放电或充电时,交换膜允许锌离子和溴离子通过,维持两侧溴化锌溶液的浓度保持不变,故D正确;
故选B。
5.D
【解析】
由新型中温全瓷铁空气电池的装置图可知,a极上空气中氧气得电子发生还原反应,为原电池的正极,铁与水反应生成氢气,氢气在b极失电子发生氧化反应,为原电池的负极。
A. a极上空气中氧气得电子发生还原反应,故A错误;
B.O2在正极发生反应,电极反应式为O2+4e-=2O2-,故B错误;
C.若有22.4 L(标准状况)空气参与反应,则氧气的物质的量为×=0.2mol,电路中转移的电子为0.8mol,故C错误;
D.由新型中温全瓷铁空气电池的装置图可知,铁表面H2O(g)参与反应生成H2,发生的反应为xH2O(g)+Fe=FeOx+xH2,故D正确;
故选D。
6.B
【解析】
A.该电池放电时工作原理可知,放电时,A为负极B为正极,充电时,A为阴极B为阳极,故无论充电或放电,A极电势均低于B极,故A正确;
B.充电时,A极电极反应为aLi++ae-+6C=LiaC6, 外电路中流过0.1mol电子,A极质量增加0.7g,故B错误;
C.由该电池放电时工作原理可知,放电时B为正极,Li1- aNix Coy MnzO2得电子结合Li+生成LiNixCoyMnzO2,正极反应为Li1-aNixCoyMnzO2+aLi++ae-=LiNixCoyMnzO2,故C正确;
D.锂元素失去活性后,可采用化学方法再生,从而实现Li的循环利用,故D正确;
故选 B。
7.C
【解析】
A.左侧是SO2化合价升高生成硫酸,因此a是该电池的负极,故A正确;
B.b电极是正极,氧气得到电子,因此b电极反应式:O2+4e-+4H+=2H2O,故B正确;
C.左侧发生的电极反应式:SO2-2e-+2H2O=+4H+,因此一段时间后,阳膜左侧硫酸溶液的浓度增大,故C错误;
D.原电池中“同性相吸”即反应过程中,氢离子从阳膜左侧向右侧移动,故D正确。
综上所述,答案为C。
8.D
【解析】
A.溶液能导电,而不能导电,则不能用代替溶液,故A错误;
B.原电池工作时,电解质溶液中阴、阳离子会定向移动,则微孔瓷片能使离子通过,否则不能形成闭合电路,故B错误;
C.电极的电势高于Cu电极的电势,电极为正极,发生氧化反应,电极反应式为:,故C错误;
D.Cu为原电池的负极,若换成更加活泼的体系,Zn比Cu活泼,更容易失去电子,Zn与Hg的活性差异更大,则电压表的示数变大,故D正确;
故选D。
9.B
【解析】
A. Fe3O4溶于过量稀硝酸生成硝酸铁和一氧化氮,反应的离子方程式为,故A错误;
B. 铅蓄电池充电时,阴极硫酸铅得到电子生成铅单质,阴极的电极反应式为,故B正确;
C.氨水是弱碱,应保留化学式,正确的离子方程式为,故C错误;
D.草酸为弱酸,应保留化学式,正确的离子方程式为,故D错误;
答案选B。
10.B
【解析】
A.100g 60%的乙酸溶液中溶质的质量为60g,溶剂水的质量为40g,,乙酸中氧原子数为,水中也含有氧原子,则氧原子的数目大于,A项错误;
B.用惰性电极电解,溶液中阳离子为:>在阴极放电,电极反应式为:、,溶液中的阴离子为:>,电极反应式为:,当氢气和氧气生成时,转移电子数为,B项正确;
C.常温下1L pH=9的醋酸钠溶液中,醋酸钠为强碱弱酸盐,水解产生的,水电离出的数目为,C项错误;
D.S的氧化性较弱与Cu反应生成,转移电子关系式为,完全反应转移电子数为,D项错误;
答案选B。
11.C
【解析】
A. 放电时,Li+向正极移动,即向b极区移动,故A正确;
B. 放电时,a极的Li13Si4失电子发生氧化反应,电极反应是3Li13Si4-1le-=4Li7Si3+11Li+,故B正确;
C. 该电池中火药反应产生的化学能转化为电能,故C错误;
D. LiCl和KCl混合物的熔点与KCl的物质的量分数的关系图,调节混合物中KCl的物质的量分数为0.6时,400℃时就可以启动电池,故D正确;
故选D。
12.B
【解析】
该装置为二次电池,放电为原电池装置,充电为电解池,根据装置图,放电时,Na+向左边电极移动,根据原电池工作原理,左边电极为正极,右边电极为负极,据此分析。
A.由图示可判断,放电时Na+向 NaFePO4F 电极方向移动,所以 NaFePO4F 电极为正极,充电时作阳极与外接电源正极相连,即M接电源正极,N接电源负极,故A说法正确;
B.根据总反应式,放电时,原电池的正极反应为 NaFePO4F+Na++e-=Na2FePO4F , M极质量不会减轻,反而会增重,导线中每通过1mol 电子,理论上M极质量增重23g ,故B说法错误;
C.由总反应结合原电池正极反应可知,放电时负极N上的电极反应式为 Na3Ti2(PO4)3-2e-=NaTi2(PO4)3+2Na+ ,故C说法正确;
D.由图示知, NaFePO4F 、 Na2FePO4F 、 Na3Ti2(PO4)3 、 NaTi2(PO4)3 均附着在电极材料上,充、放电时两极反应的 Na+ 生成与消耗的量相等,理论上溶液中的钠离子浓度不变,故D说法正确;
答案为B。
13.B
【解析】
由图可知,通入氢气的a极为原电池的负极,氢气在负极失去电子发生氧化反应生成氢离子,电极反应式为H2—2e—=2H+,氢离子通过阳离子交换膜进入产品室,通入氧气的b极为正极,氧气在正极得到电子发生还原反应生成HO离子和氢氧根离子,电极反应式为O2+2e—+H2O=HO+OH—,HO离子、OH—离子通过阴离子交换膜进入产品室与氢离子反应生成过氧化氢和水,电池的总反应为H2+O2=H2O2。
A.由分析可知,Y膜为阴离子交换膜,故A错误;
B.催化剂能降低反应的活化能,加快反应速率,所以单位时间内反应中电子的转移数目增多,故B正确;
C.由分析可知,b极为正极,氧气在正极得到电子发生还原反应生成HO离子和氢氧根离子,故C错误;
D.由分析可知,电池的总反应为H2+O2=H2O2,故D错误;
故选B。
14.(1)
(2)AB
(3)还原
(4) CH3OH-6e-+H2O=6H++CO2↑ 变大 +6Fe2++14H+=2Cr3++6Fe3++7H2O
【解析】
(1)
硒是34号元素,原子核外电子排布是2、8、18、6,所以硒的原子结构示意图为;
(2)
A.水分子间含氢键,使物质分子之间吸引力增强,其沸点最高,且H2S、H2Se中相对分子质量大的沸点高,则沸点高低顺序为:H2O>H2Se>H2S,A错误;
B.元素的非金属性越强,则气态氢化物的热稳定性越强,元素的非金属性:S>P>Se,故热稳定性顺序为:H2S>PH3>H2Se,B错误;
C.元素的非金属性越强,则对应阴离子的还原性越弱,由于非金属性:F>Br>Se,故氢化物的还原性:H2Se>HBr>HF,C正确;
D.原子核外电子层数越多,微粒半径越大,而Se有四个电子层,Cl有三个电子层,故半径:Se>Cl;而Ge和Se均有四个电子层,当原子核外电子层数相同时,核电荷数越多,原子半径越小,故Ge>Se,因此原子半径大小关系为:Ge>Se>Cl,D正确;
故合理选项是AB;
(3)
“活性氧”的氧化性极强,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,表明Na2SeO3能将“活性氧”还原,“活性氧”为氧化剂,Na2SeO3为还原剂,表现还原性;
(4)
①M电极通入燃料CH3OH,N电极通入O2,则M为负极,N为正极。负极上甲醇失去电子发生氧化反应,生成二氧化碳与氢离子,负极电极反应式为:CH3OH-6e-+H2O=6H++CO2↑;正极上氧气获得电子发生还原反应,与通过质子交换膜的H+结合为水,正极电极反应式为:O2+4e-+4H+=2H2O,N电极附近c(H+)降低,导致N极附近的pH变大;
②电解池溶液里转化为Cr3+,化合价降低共6价,左侧Fe电极与原电池的正极连接,所以左侧Fe电极为阳极,阳极上Fe失去电子生成Fe2+,酸性条件下Fe2+将还原为Cr3+,Fe2+被氧化为Fe3+,根据电子守恒、电荷守恒、原子守恒,可得该反应的离子方程式为:+6Fe2++14H+=2Cr3++6Fe3++7H2O。
15.(1) 2*NN+H2=2*NNH(或*NN+H2=*NNH+H) < 增大压强;增大氢气或者氮气的浓度;移走氨气
(2) H2+2MV2+=2H++2MV+ 向右 BC
【解析】
(1)
N2的氮原子间是氮氮叁键,电子式是;从图中可知,步骤b是*NN生成*NNH,化学方程式是2*NN+H2=2*NNH(或*NN+H2=*NNH+H);从反应物“N2+3H2”到生成物“2NH3”总能量下降,反应过程放出热量,故∆H<0;反应N2(g)+3H2(g)2NH3(g),气体物质系数正向较小,为促进该反应正向进行,可以增大体系压强、增大氢气或者氮气的浓度、移走氨气等;
(2)
电极a MV+转变成MV2+失去电子,作负极,电极b是正极,氢化酶区域MV2+转变成MV+,发生反应的离子方程式是H2+2MV2+=2H++2MV+;溶液中阳离子朝正极移动,质子交换膜允许H+通过,故溶液中H+的向右移动;该装置是原电池,将化学能转化为电能,相较于传统工业合成氨的高温高压,该方法反应条件温和,对环境友好,选择BC;
注意从题给示意图中观察物质的变化方向和途径,第一题结合原子守恒,第二题结合氧化还原原理,是解题突破口。
16.(1) 2:1
(2)
(3)1.5
(4)BD
(5)逆向
(6)
【解析】
(1)
三价铬离子的价电子排布式为3d3,则其价电子轨道表示式为:;基态铬原子的价电子轨道表示式为: ,核外有6个未成对电子,基态氮原子的价电子轨道式为:,核外有3个未成对电子,因此基态铬、氮原子的未成对电子数之比为2:1。
(2)
根据图示,由始态和终态判断反应物中氨气被氧化成氮气,次氯酸钠则被还原成氯化钠,依据得失电子守恒和质量守恒,可知化学方程式为:。
(3)
当去除率较高,余氯量较低时,说明去除效果最佳,由图示可知,符合要求的最佳值约为1.5。
(4)
A.由氨水的电离方程式可知,为平衡常数,只随温度变化,用水稀释,温度不变,比值不变,A项错误;
B.加水稀释,促进一水合氨的电离,n()减小,n()增大,两者在同一溶液中,体积相同,因此减小,B项正确;
C.加水稀释,氨水碱性减弱,c()浓度减小,c()浓度增大,C项错误;
D.加水稀释,氨水碱性减弱,c()浓度减小,c()浓度增大,减小,D项正确;
答案选BD。
(5)
25°C时,将amolNH4NO3溶于水,向该溶液中滴加bL氨水后溶液呈中性,氨水会电离生成铵根离子和氢氧根离子,会对水的电离起到抑制作用,使水的电离平衡逆向移动。
(6)
分析装置图可知,氧离子移向的电极为阳极,阳极上通入氨气失电子生成N2H4,阴极上氧气得到电子生成O2-。在阳极,NH3转变为N2H4,氮元素化合价由-3价变为-2价,则2molNH3失去2mol电子生成1molN2H4,余下的2molH与阴极传导过来的O2-结合生成水。故阳极电极反应为:
17.(1) 铁与水蒸气反应提供氢气 当增加镍粉的用量时,第Ⅱ大步反应速率增加更大
(2)CO2+4H2CH4+2H2O
(3) 1.25 <
(4) 碱 0.29
(5)2C2O-4e-=4CO2↑+O2↑
【解析】
(1)
①由转化关系图可知, 分离的气体中含有氢气,已知高温下Fe与水蒸气反应生成氢气和四氧化三铁,氢气与二氧化碳反应生成甲烷,所以加入铁粉的作用是作为反应物,生成氢气;
②HCOOH是CO2转化为CH4的中间体,反应I生成HCOOH ,反应ⅡHCOOH转化为CH4,当镍粉用量增加10倍后,甲酸的产量迅速减少,说明HCOOH转化为CH4,即当镍粉用量增加10倍后,甲酸的产量在迅速减少,说明甲酸的消耗速率大于其生成速率,说明反应I的速率要比反应I的速率增加得快;
(2)
根据题目信息“一定条件下,Pd-Mg/SiO2催化剂可使CO2甲烷化”可知反应中CO2为反应物之一,CH4为产物之一,再根据图示中氢气“进入”Pd中可知H2也为反应物之一,所以化学方程式为:CO2+4H2CH4+2H2O;
(3)
①反应达到化学平衡时,v正=v逆,即,k正c(CO2)·c(H2)= k逆c(HCOOH),又K=0.8,可得k正=0.8K逆,所以K逆=1.25k正;
②由k正=1.1K逆,可以得出K=1.1>0.8,说明平衡正向移动,而该反应为放热反应,可知T2
①MDEAH+、HCO均为弱碱根、弱酸根,它们发生水解,MDEAH+水解显酸性,HCO水解显碱性,MDEAH+的水解常数为==,HCO的水解常数为==,MDEAH+的水解常数小于HCO的水解常数,所以溶液溶液MDEAHHCO3显碱性;
②MDEA的物质的量浓度由2.5mol/L降低到2.0mol/L,此时消耗MDEA的物质的量为n=cV=20L×2.5mol/L-20L×2.0mol/L=6mol,同时吸收CO2的物质的量也为,二氧化碳的吸收率为60%,则开始时,通入CO2的物质的量为=10mol,N2=4mol,
达到平衡后气体物质的量为4+4=8mol,起始14mol,相同条件下,压强之比等于物质的量之比,因此平衡时的压强==pθ,的分压为==pθ,根据标准平衡常数的表达式:Kθ==0.29;
(5)
由题给示意图可知,该池为电解池,左侧捕获CO2时,CO2与O2-生成C2O,右侧捕获CO2时,CO2与生成CO,C2O在阳极上失去电子发生氧化反应生成二氧化碳和氧气,电极反应式为:2C2O-4e-=4CO2+O2;
18.(1)5.3mol/L
(2)7.15
【解析】
(1)
由c=可知,质量分数为26.5%饱和食盐水的物质的量浓度为mol/L=5.3mol/L,故答案为:5.3mol/L;
(2)
电解饱和食盐水的方程式为2NaCl+2H2O2NaOH+ H2↑+ Cl2↑,由方程式可知,溶液减少的质量为氢气和氯气的质量之和,则氯气的物质的量为=0.1mol,氯气与氢氧化钙反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,由方程式可知,电解生成氯气制得漂白粉有效成份的质量为0.1mol××143g/mol=7.15g,故答案为:7.15。
19.(1)FeO+4H2O+3e-=Fe(OH)3↓+5OH-
(2) 右 左
(3)使用时间长、工作电压稳定
(4)Cl--5e-+2H2O=ClO2↑+4H+
(5)0.01mol
【解析】
(1)
根据电池装置,Zn做负极,C为正极,高铁酸钾的氧化性很强,正极上高铁酸钾发生还原反应生成Fe(OH)3,正极电极反应式为:FeO+4H2O+3e-=Fe(OH)3↓+5OH-;
(2)
盐桥中阴离子移向负极移动,盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷,构成闭合回路,放电时盐桥中氯离子向右移动,用某种高分子材料制成阳离子交换膜代替盐桥,则钾离子向左移动;
(3)
由图可知高铁电池的优点有:使用时间长、工作电压稳定;
(4)
由题意可知,氯离子放电生成ClO2,根据电子守恒和电荷守恒写出阳极的电极反应式为Cl--5e-+2H2O=ClO2↑+4H+;
(5)
阴极产生标准状况下112mL是H2,物质的量为0.005mol,阴极电极反应式为2H++2e-=H2↑,所以电路中转移电子0.01mol,钠离子所带电荷与电子所带电荷数相同,所以通过阳离子交换膜的钠离子的物质的量为0.01mol。
相关试卷
这是一份06 电化学原理应用—高考(化学)一轮复习 知识点+练习+测试,文件包含06电化学原理应用练习含答案解析docx、06电化学原理应用测试含答案解析docx、06电化学原理应用知识点含答案解析docx、06电化学原理应用练习docx、06电化学原理应用知识点docx、06电化学原理应用测试docx等6份试卷配套教学资源,其中试卷共92页, 欢迎下载使用。
这是一份2023届新高考专用化学二轮复习热考题型--练6 电化学原理与应用,共5页。
这是一份2022届高考化学二轮复习专题06电化学原理应用(2),共25页。试卷主要包含了单选题,共13小题,非选择题,共6小题等内容,欢迎下载使用。












