

2021届江苏省盐城市高三三模化学(文字版、含答案)练习题
展开盐城市2021届高三年级第三次模拟考试
化学试题
注意事项: 2021.5
1.本试卷考试时间为75分钟,试卷满分100分,考试形式闭卷;
2.本试卷中所有试题必须作答在答题卡上规定的位置,否则不给分;
3.答题前,务必将自己的学校、班级、姓名、准考证号用0.5毫米黑色墨水签字笔填写在答题卡上。
可能用到的相对原子质量:H1 O16 S32 Mn55
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意。
1.为解决气候危机,我国制定了实现“碳中和”和“温室气体净零排放”的长期战略目标。
下列做法不应该提倡的是
A.使用一次性餐具 B.发展CO2捕集技术
C.开发新能源 D.开发清洁燃烧技术
2.用化学用语表示2NaCl+2H2O 2NaOH+H2↑+Cl2↑的相关微粒,其中正确的是
A.中子数为10的氧原子为 B.H2O的比例模型为
C.Cl-的结构示意图为 D.NaOH的电子式为
阅读下列资料,完成3~5题:氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+ 502(g) = 4NO(g)+ 6H2O(g)△H = -904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。
3.下列氮及其化合物的性质与用途具有对应关系的是
A.N2不溶于水,可用作保护气
B.NH3具有还原性,可用作制冷剂
C.KNO3具有氧化性,可用于制黑火药
D.NH4CI受热易分解,可用于制造化肥
4.对于反应4NH3(g) + 502(g)4NO(g)+6H2O(g),下列有关说法正确的是
A.△S<0
B.该反应的正反应的活化能小于逆反应的活化能
C. 4mol NH3和5molO2充分反应放出的热量为904 kJ
D.达到平衡时,增大容器的体积,v (正)增加、v (逆)减小
5.下列选项所述措施均能减少大气中NOx含量的是
①减少化石燃料的使用 ②烟气催化脱硝处理
③使用强氧化剂氧化脱氮 ④用生石灰改良酸性土壤
A.①②③ B.①③④ C.②③④ D.①②④
6.如右图所示为元素周期表中短周期的一部分,X、Y、Z、W四种主族元素原子序数增大,Z是非金属性最强的元素,Y的主族序数是其周期数的3倍。下列说法正确的是
A.原子半径:r(W) > r(Z) > r(Y )> r(X)
B.电负性:Y > X > Z
C.元素W最高价氧化物的水化物是一种强酸
D.元素Y的简单气态氢化物的热稳定性比W的弱
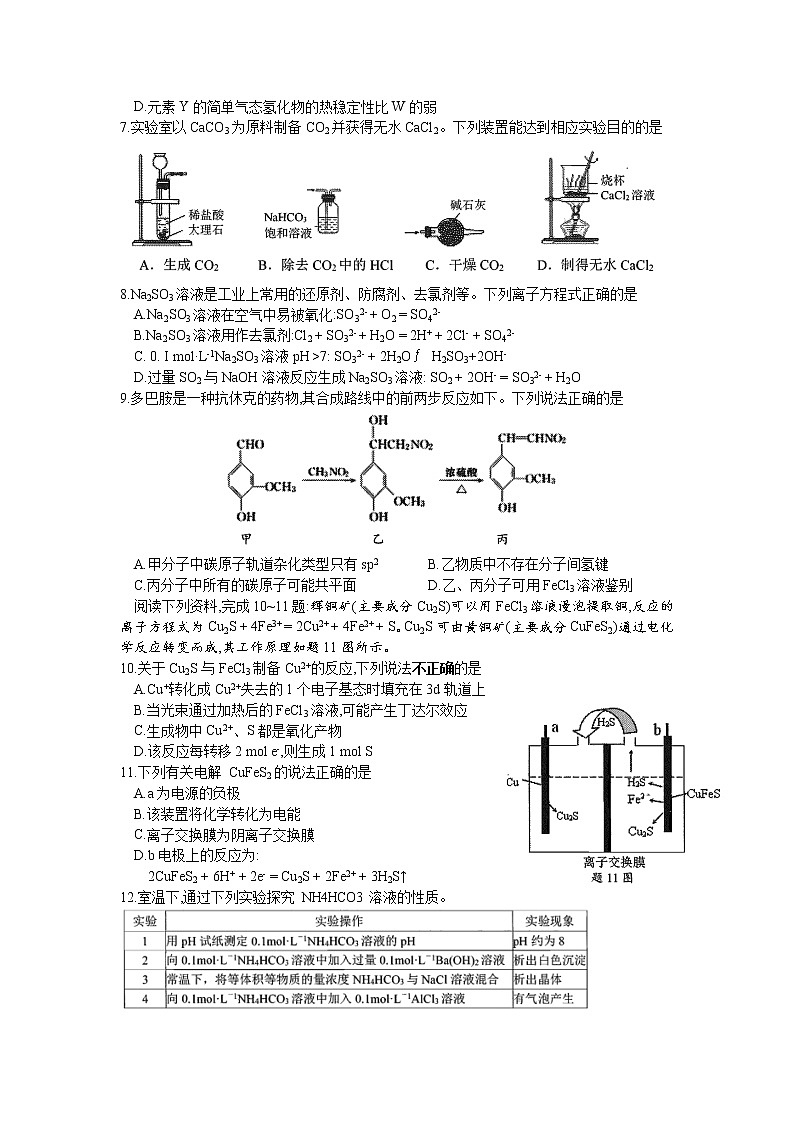
7.实验室以CaCO3为原料制备CO2并获得无水CaCl2。下列装置能达到相应实验目的的是
8.Na2SO3溶液是工业上常用的还原剂、防腐剂、去氯剂等。下列离子方程式正确的是
A.Na2SO3溶液在空气中易被氧化:SO32- + O2 = SO42-
B.Na2SO3溶液用作去氯剂:Cl2 + SO32- + H2O = 2H+ + 2Cl- + SO42-
C. 0. I mol·L-1Na2SO3溶液pH >7: SO32- + 2H2OH2SO3+2OH-
D.过量SO2与NaOH溶液反应生成Na2SO3溶液: SO2 + 2OH- = SO32- + H2O
9.多巴胺是一种抗休克的药物,其合成路线中的前两步反应如下。下列说法正确的是
A.甲分子中碳原子轨道杂化类型只有sp2 B.乙物质中不存在分子间氢键
C.丙分子中所有的碳原子可能共平面 D.乙、丙分子可用FeCl3溶液鉴别
阅读下列资料,完成10~11题:辉铜矿(主要成分Cu2S)可以用FeCl3溶液漫泡提取铜,反应的离子方程式为Cu2S + 4Fe3+ = 2Cu2+ + 4Fe2+ + S。Cu2S可由黄铜矿(主要成分CuFeS2)通过电化学反应转变而成,其工作原理如题11图所示。
10.关于Cu2S与FeCl3制备Cu2+的反应,下列说法不正确的是
A.Cu+转化成Cu2+失去的1个电子基态时填充在3d轨道上
B.当光束通过加热后的FeCl3溶液,可能产生丁达尔效应
C.生成物中Cu2+、S都是氧化产物
D.该反应每转移2 mol e-,则生成1 mol S
11.下列有关电解 CuFeS2的说法正确的是
A.a为电源的负极
B.该装置将化学转化为电能
C.离子交换膜为阴离子交换膜_210075
D.b电极上的反应为:
2CuFeS2 + 6H+ + 2e- = Cu2S + 2Fe2+ + 3H2S↑
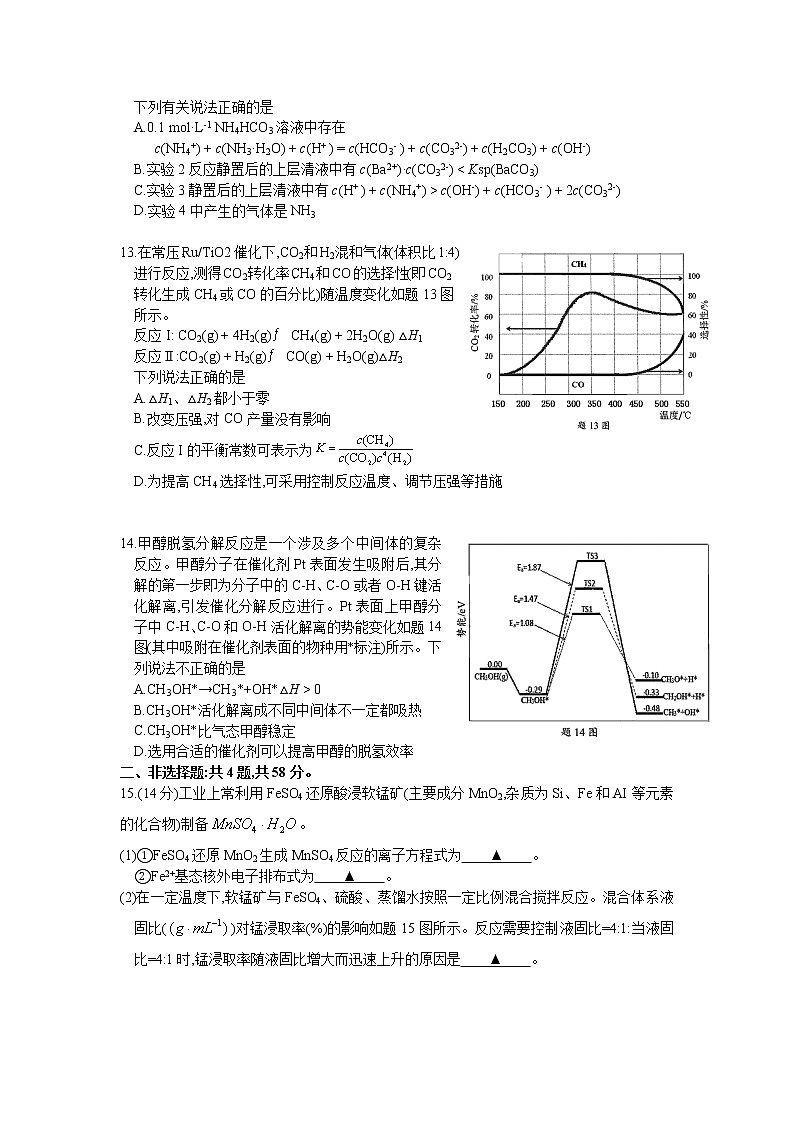
12.室温下,通过下列实验探究 NH4HCO3溶液的性质。
下列有关说法正确的是
A.0.1 mol·L-1 NH4HCO3溶液中存在
c(NH4+) + c(NH3·H2O) + c(H+ ) = c(HCO3- ) + c(CO32-) + c(H2CO3) + c(OH-)
B.实验2反应静置后的上层清液中有c(Ba2+)·c(CO32-) < Ksp(BaCO3)
C.实验3静置后的上层清液中有c(H+ ) + c(NH4+) > c(OH-) + c(HCO3- ) + 2c(CO32-)
D.实验4中产生的气体是NH3
13.在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4)进行反应,测得CO2转化率、CH4和CO的选择性(即CO2转化生成CH4或CO的百分比)随温度变化如题13图所示。_75
反应I: CO2(g) + 4H2(g)CH4(g) + 2H2O(g) △H1
反应Ⅱ:CO2(g) + H2(g)CO(g) + H2O(g)△H2
下列说法正确的是
A.△H1、△H2都小于零
B.改变压强,对CO产量没有影响
C.反应I的平衡常数可表示为
D.为提高CH4选择性,可采用控制反应温度、调节压强等措施
14.甲醇脱氢分解反应是一个涉及多个中间体的复杂反应。甲醇分子在催化剂Pt表面发生吸附后,其分解的第一步即为分子中的C-H、C-O或者O-H键活化解离,引发催化分解反应进行。Pt表面上甲醇分子中C-H、C-O和O-H活化解离的势能变化如题14图(其中吸附在催化剂表面的物种用*标注)所示。下列说法不正确的是
A.CH3OH*→CH3*+OH*△H > 0
B.CH3OH*活化解离成不同中间体不一定都吸热
C.CH3OH*比气态甲醇稳定
D.选用合适的催化剂可以提高甲醇的脱氢效率
二、非选择题:共4题,共58分。
15.(14分)工业上常利用FeSO4还原酸浸软锰矿(主要成分MnO2,杂质为Si、Fe和AI等元素的化合物)制备。
(1)①FeSO4还原MnO2生成MnSO4反应的离子方程式为 ▲ 。
②Fe2+基态核外电子排布式为 ▲ 。
(2)在一定温度下,软锰矿与FeSO4、硫酸、蒸馏水按照一定比例混合搅拌反应。混合体系液固比()对锰浸取率(%)的影响如题15图所示。反应需要控制液固比=4:1:当液固比=4:1时,锰浸取率随液固比增大而迅速上升的原因是 ▲ 。
(3)浸取液经氧化、中和等系列操作后,可得到粗产品。通过下列方法测定产品纯度:准确称取3.000g样品,加适量ZnO及H2O煮沸、冷却,转移至锥形瓶中,用0.5000KMnO4 ,标准溶液滴定至溶液呈红色且半分钟不褪色,消耗标准溶液20.00mL计算样品的纯度(写出计算过程): ▲ 。
已知:2KMnO4+3MnSO4+2H2 O=5MnO2+K2SO4+2H2SO4
16.(14分)化合物G是制备抗HIV药物阿扎那韦的关键中间体,其一种合成路线如下:
已知:Boc-表示
(1)A分子中含有的官能团为 ▲ 。
(2)E→F的反应类型为 ▲ 。
(3)G含有手性碳原子的数目为 ▲ 。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: ▲ 。
①分子中含有-NH2;
②核磁共振氢谱有四组峰
③能发生银镜反应:常温下1mol最多与含4 mol NaOH水溶液完全反应。
(5)设计以为原料制备的合成路线(无机试剂和有机试剂任用,合成路线示例见本题题干)。
17.(16分)水合肼()常用作航天器-sa;;jg燃料,也广泛应用于医药生产。实验室制取水合肼,并模拟处理铜氨{[Cu(NH3)4]2+}废液回收铜粉的实验流程如下:
(1)反应Ⅰ中温度升高时易产生副产物 NaClO3。为提高 NaCIO产率,实验中可采取的措施有 ▲
A.反应容器浸入热水中 B.适当减慢通入Cl2的速率 C.不断搅拌溶液
(2)① NaCIO与CO(NH2)2反应合成水合肼的离子方程式为 ▲ 。
②合成过程中需控制,比理论值略大的原因是 ▲ 。
(3)检验分离出水合肼后的溶液中Cl-的实验操作是 ▲ 。
(4)铜粉沉淀率与水合肼溶液浓度的关系如题17图所示。请设计由铜氨废液回收铜粉
的实验方案:取一定量5水合肼溶液, ▲ ,静置、过滤、洗涤、干燥。
实验中可选用的试剂:5水合肼溶液、2硫酸、2 NaOH溶液、
铜氨废液、蒸馏水。
已知:。
18.(14分)铬是造成水体重度污染的元素之一,水体除铬主要有还原沉淀法、离子交换法、光催化还原法等。
(1)还原沉淀法:向水体中加入FeSO4、CaSO3等将高zxy75毒性C(Ⅵ)还原为低毒性Cr(Ⅲ)再调节pH使Cr(Ⅲ)生成Cr(OH)3沉淀除去。
①Cr(Ⅵ)在水溶液中的存在形态分布如题18图-1所示。向pH=1.5的含Cr(Ⅵ)污水中加入FeSO4,发生的主要反应的离子方程式为 ▲ 。
②Cr(Ⅲ)在水溶液中的存在形态分布如题18图-2所示。当pH>12时,铬去除率下降的原因可用离子方程式表示为 ▲ 。
(2)离子交换法:用强碱性离子交换树脂(ROH)与含铬离子(CrO42-、HCrO4-等)发生离子交换。如与CrO42-的交换可表示为2ROH(s)+CrO42-(aq)R2CrO4(s)+2OH-(aq)。Cr(Ⅵ)去除率与pH关系如题18图-3所示,当pH>4时,C(Ⅵ)去除率下降的原因是 ▲ 。
(3)光催化还原法:可能的反应机理如题18图-4所示,ZrO2纳米管为催化剂,在紫外光照射下,VB端光生空穴(h+)被牺牲剂甲醇(CH3OH)消耗。在紫外光照射下,甲醇还原Cr(Ⅵ)的过程可描述为 ▲ 。
2023届江苏省盐城市高考三模化学试卷+答案: 这是一份2023届江苏省盐城市高考三模化学试卷+答案,共8页。
2023届江苏省徐州市高三三模化学试题及答案: 这是一份2023届江苏省徐州市高三三模化学试题及答案,文件包含高三化学打靶题pdf、06稿化学答案pdf、A3三栏单面高三化学答题卡-条形码pdf等3份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
2021年高江苏省南京市盐城市考一模化学试卷含解析: 这是一份2021年高江苏省南京市盐城市考一模化学试卷含解析,共23页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。












