
安徽省滁州市定远县育才学校2021-2022学年高三下学期期中考试理科综合化学试题(含答案)
展开可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na-23 Al-27 S 32
一、选择题:本题共13小题,每小题6分,共78分。每小题给出的4个选项中只有一项是符合题意要求的。
7.化学与社会、生活及工业生产密切相关。下列有关说法正确的是
A.硫酸铝可除去水体中的悬浮杂质并起到消毒杀菌的作用
B.海水资源的综合利用涉及制盐,制取镁和溴等,其过程中均涉及氧化还原反应
C.地沟油经处理后可用作生物柴油,其主要成分和汽油相同,都是酯类
D.使用可降解的聚碳酸酯塑料和向燃煤中加入生石灰,都能减轻环境污染
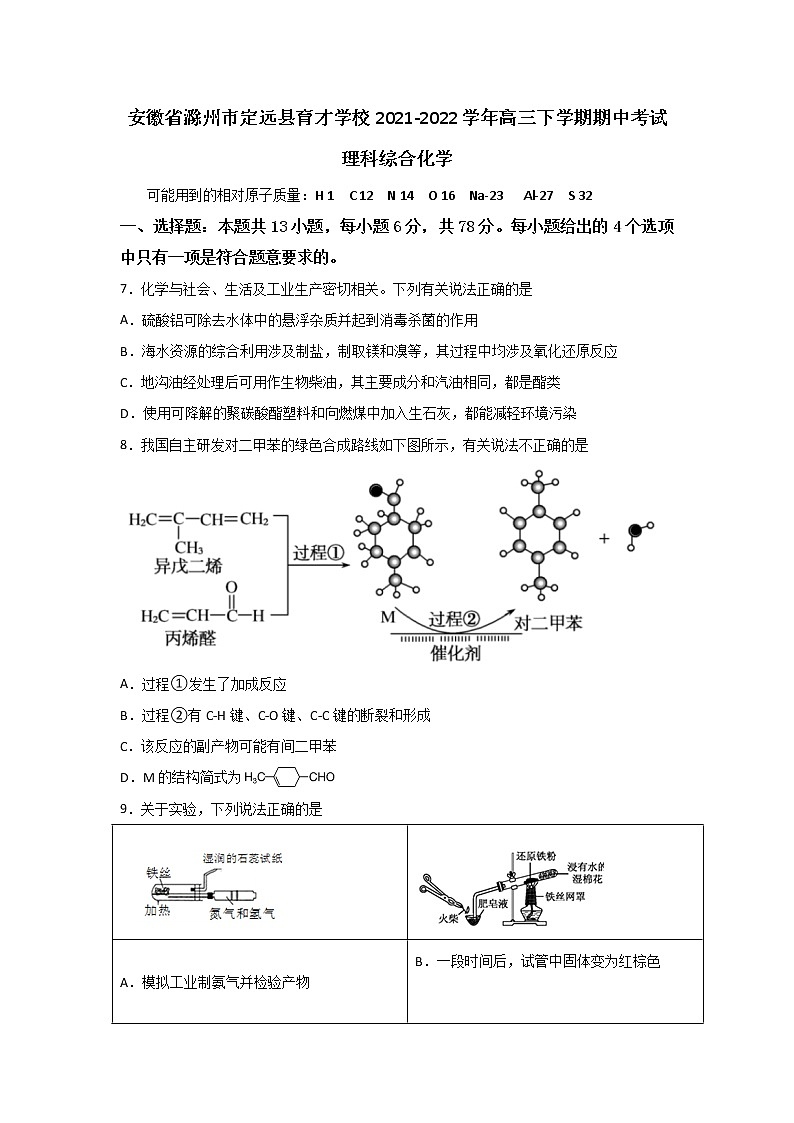
8.我国自主研发对二甲苯的绿色合成路线如下图所示,有关说法不正确的是
A.过程①发生了加成反应
B.过程②有C-H键、C-O键、C-C键的断裂和形成
C.该反应的副产物可能有间二甲苯
D.M的结构简式为
9.关于实验,下列说法正确的是
A.AB.BC.CD.D
10.X、Y、Z、W、R为原子序数依次增大的短周期主族元素,X最高正价和最低负价代数和为0,Y的质子数与其阴离子的最外层电子数相等,X和Z同主族,Z、W、R三种元素形成的最高价氧化物对应的水化物两两间能反应。下列说法正确的是
A.X与Y、Z、R形成的化合物均只含有共价键
B.简单离子半径:Y<W<R
C.Y和R的简单氢化物沸点:Y>R
D.Z和R元素形成的化合物水溶液一定显中性
11.我国科学家以CO2和辛胺为原料实现了甲酸盐和辛睛的高选择性合成,装置工作原理如图(以KOH溶液为电解液,隔膜a只允许OH-自由通过)。下列说法正确的是
A.m为直流电源正极
B.In/In2O3-x电极上发生的反应为CO2+2e-+H2O=HCOO-+OH-
C.若Ni2P电极上生成1mlCH3(CH2)6CN,理论上电路中转移2mle-
D.工作一段时间后,左右两室溶液的pH均保持不变
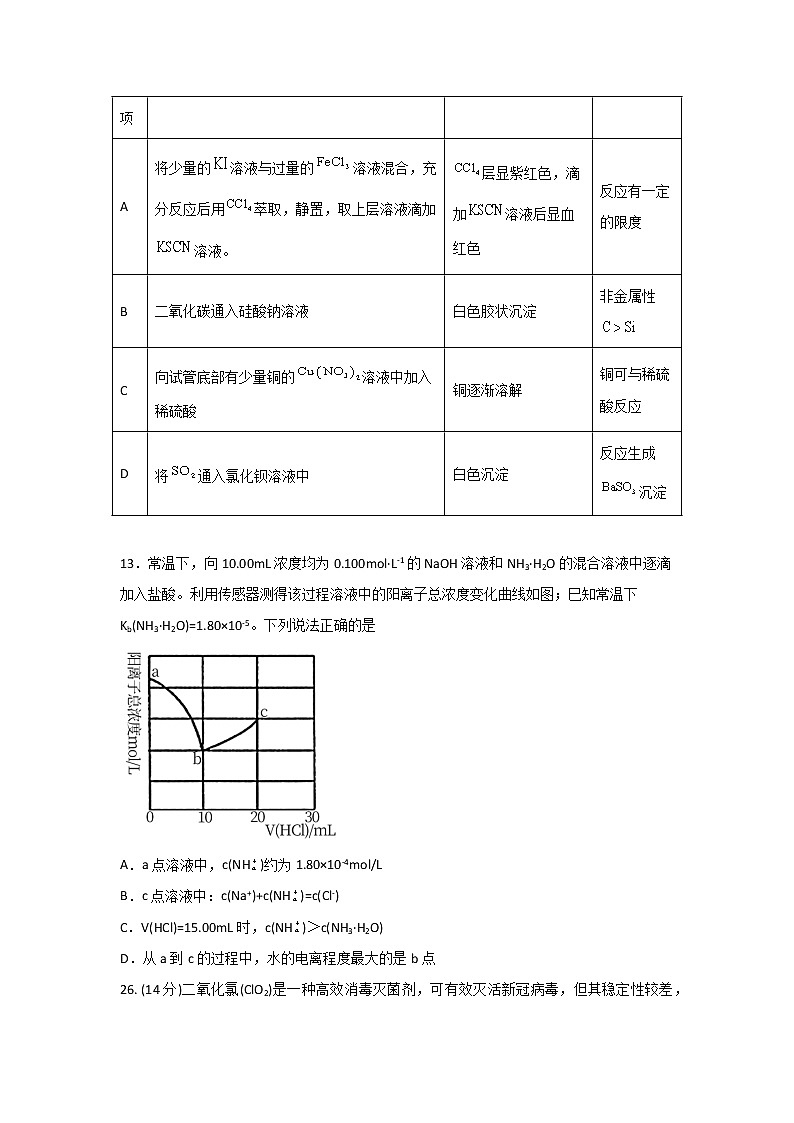
12.下列实验操作、现象和结论正确的是
13.常温下,向10.00mL浓度均为0.100ml·L-1的NaOH溶液和NH3·H2O的混合溶液中逐滴加入盐酸。利用传感器测得该过程溶液中的阳离子总浓度变化曲线如图;巳知常温下Kb(NH3·H2O)=1.80×10-5。下列说法正确的是
A.a点溶液中,c(NH)约为1.80×10-4ml/L
B.c点溶液中:c(Na+)+c(NH)=c(Cl-)
C.V(HCl)=15.00mL时,c(NH)>c(NH3·H2O)
D.从a到c的过程中,水的电离程度最大的是b点
26. (14分)二氧化氯(ClO2)是一种高效消毒灭菌剂,可有效灭活新冠病毒,但其稳定性较差,故常采用H2O2和NaOH混合溶液将其吸收转化为NaClO2保存。现利用如下装置及试剂制备NaClO2。
已知:①ClO2的熔点为-59℃,沸点为11℃。纯ClO2易分解爆炸;ClO2极易溶于水,且在碱性环境中发生反应2ClO2+2OH-=++H2O。
②高于60℃时NaClO2分解成NaClO3和NaCl
回答下列问题:
(1)仪器A的名称是___________,其优点是___________。
(2)B为ClO2的发生装置,生成ClO2的离子方程式为___________。
(3)实验过程中持续通入N2的速度不能太快也不能太慢的原因是___________;实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂,选出一种可行的方法,化学方程式为___________。
可供选择的试剂:CuO(s)、NH3(g)、Cl2(g)、O2(g)、饱和NaNO2溶液、饱和NH4Cl溶液
(4)装置C需要采用冰水浴,可能的原因为___________;该装置中H2O2和NaOH需要按照一定比例加入,NaOH过量时导致的后果是___________。
(5)NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2。从NaClO2溶液中获得NaClO2固体的操作:
①减压,55℃蒸发结晶;②___________;③无水乙醇洗涤;④___________,得到成品。
(6)某同学根据“SO2+2OH-+H2O2=+2H2O”推测产品中含Na2SO4杂质,请设计简单实验证明:___________。
27. (14分)硫酸铜可用作家禽养殖饲料的添加剂。一种以含砷氧化铜矿[含CuO、Cu(OH)2·CuCO3、砷的化合物及铅的化合物]为原料制备饲料级硫酸铜的工艺流程如图所示。回答下列问题:
(1)“氨浸”时控制温度为45℃,液固比为1:4,c(NH3)+c(NH)=1 ml·L-1且c(NH3)=c(NH)。
①温度不宜超过55℃,这是因为___。
②“氨浸”时,Cu(OH)2·CuCO3转化为[Cu(NH3)4]SO4和NH4HCO3的化学方程式为__。
③溶液中Cu2+、[Cu(NH3)n]2+(n=1~4)的物质的量分数δ(x)与lgc(NH3)的关系如图所示。
lgc(NH3)=-3时,浓度最大的含铜微粒是__,lgc(NH3)由-1→0时,发生反应的离子方程式为__。
(2)“除砷”时控制pH=9,AsO最终转化为FeAsO4沉淀,AsO中As的化合价为__,该转化过程中每生成1 ml FeAsO4,转移__ml电子。
(3)“蒸氨沉铜”的尾气可返回__工序循环使用,由碱式硫酸铜制取产品硫酸铜晶体的方法:将碱式硫酸铜先溶于硫酸,再__、洗涤、干燥。
28 (15分) “低碳经济”备受关注,二氧化碳的回收利用是环保和能源领域研究的热点课题。
(1)已知:①CO(g)+H2O(g)H2(g)+CO2(g)△H=-41kJ·ml-1
②CH4(g)C(s)+2H2(g)△H=+73kJ·ml-1
③2CO(g)C(s)+CO2(g)△H=-171kJ·ml-1
写出CO2与H2反应生成CH4和水蒸气的热化学方程式:_________________________。
(2)CO2与H2在催化剂作用下可以合成二甲醚,反应原理如下:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H。某温度下,向体积为2L的密闭容器中充入CO2与H2,发生上述反应。测得平衡混合物中CH3OCH3(g)的体积分数[φ(CH3OCH3) 与起始投料比Z[Z=]的关系如图1所示;CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图2所示。
①当Z=3时,CO2的平衡转化率a=__________%。
②当Z=4时,反应达到平衡状态后,CH3OCH3的体积分数可能是图1中的_________点(填"D"、"E"或“F")。
③由图2可知该反应的△H_______0(选填“>”、“<“或“=”,下同),压强p1、p2、p3由大到小的顺序为__________。
④若要进一步提高H2的平衡转化率,除了可以适当改变反应温度和压强外,还可以采取的措施
有________________(任写一种)。
(3)我国科研人员研制出的可充电"Na-CO2"电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO22Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示。
①放电时,正极的电极反应式为____________________。
②若生成的Na2CO3和C全部沉积在正极表面,当正极增加的质量为28g时,转移电子的物质的量为__________。
③可选用高氯酸钠-四甘醇甲醚作电解液的理由是________________________。
35. [化学-选修3:物质结构与性质] (15分)
黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)Cu2+基态核外电子排布式为_____________________。
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型为__________,中心原子杂化类型为________________。
②X的沸点比水低的主要原因是___________________。
(3)CuFeS2与氧气反应生成SO2,SO2中心原子的价层电子对数为_________,其中基态S原子中,核外电子占据的最高能层的符号是_________,占据最高能级电子的电子云轮廓图为________形。分子中的大π键可用符号表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则SO2中的大π键应表示为______________。
(4)四方晶系CuFeS2晶胞结构如图所示。
①Cu+的配位数为_______________,S2-的配位数为____________________。
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是____________g/cm3(列出计算式)。
36. [化学-选修5:有机化学基础] (15分)
聚酰亚胺是重要的特种工程材料,已广泛应用在航空、航天、纳米、液晶、激光等领域。某聚酰亚胺的合成路线如下(部分反应条件已略去)。
已知:
①
②CH3COOH +CH3COOH(R代表烃基)
请回答下列问题:
(1)B中所含官能团的名称是______________ F的名称是__________。
(2)②反应的反应类型是____________ 反应。
(3)I的分子式为C9H12O2N2,I的结构简式是______________。
(4)K 是D的同系物,核磁共振氢谱显示其有4组峰,则L的同分异构体中属于芳香的烃有_______种(不考虑立体异构)。
(5)P的结构简式是 ____________________(不考虑端基的书写)。
化学参考答案
7.D 8.B 9.C 10.C 11.B 12.B 13.C
26.(1) 恒压滴液漏斗 平衡气压,使75%硫酸顺利流下
(2)2++2H+=2ClO2↑+H2O+或2+SO2=2ClO2↑+
(3) N2流速过快时ClO2不能被充分吸收,太慢时装置内的ClO2不能被及时移走,会导致浓度过高而分解爆炸 2NH3+3CuO3Cu+N2↑+3H2O(或NH4Cl+NaNO2NaCl+2H2O+N2↑)
(4) 液化ClO2;防止H2O2在较高温度下分解;防止温度过高NaClO2分解 产品中含有杂质NaClO3
(5) 趁热过滤 低于60℃干燥
(6)取适量产品于试管中,加足量稀盐酸溶解后,滴加BaCl2溶液,若产生白色沉淀,说明产品含Na2SO4杂质,反之,则不含
27.(1) 会加速氨的挥发
Cu(OH)2∙CuCO3+5NH3+2(NH4)2SO4=2[Cu(NH3)4]SO4+NH4HCO3+2H2O [Cu(NH3)2]2+ [Cu(NH3)3]2++NH3=[Cu(NH3)4]2+
(2) +5价 3
(3) 氨浸工序 蒸发浓缩、冷却结晶、过滤
28.(1) CO2(g)+4H2(g)CH4(g)+2H2O(g) △H=-162 kJ·ml-1
(2 75 F < p1>p2>p3 将二甲醚从体系中分离或增大n(CO2)∶n(H2)
(3) 3CO2+4Na++4e-=2Na2CO3+C 0.5ml 导电性好、与金属钠不反应、难挥发等(答案合理即给分)
35.(1) 1s2s2p63s23p63d9(或[Ar] 3d9)
(2) V形 sp3 水分子间存在氢键
(3) 3 M 哑铃(或纺锤)
(4) 4 4
36. (1)羟基 苯甲酸乙酯 (2)取代(硝化) (3) (4)21 (5)或者
A.模拟工业制氨气并检验产物
B.一段时间后,试管中固体变为红棕色
C.可用所示装置比较KMnO4、Cl2、S的氧化性强弱
D.若溴水褪色则证明石蜡油分解产生乙烯
选项
实验操作
实验现象
实验结论
A
将少量的溶液与过量的溶液混合,充分反应后用萃取,静置,取上层溶液滴加溶液。
层显紫红色,滴加溶液后显血红色
反应有一定的限度
B
二氧化碳通入硅酸钠溶液
白色胶状沉淀
非金属性
C
向试管底部有少量铜的溶液中加入稀硫酸
铜逐渐溶解
铜可与稀硫酸反应
D
将通入氯化钡溶液中
白色沉淀
反应生成沉淀
安徽省滁州市定远县育才学校2022-2023学年高三第二次模拟检测化学试题(含答案): 这是一份安徽省滁州市定远县育才学校2022-2023学年高三第二次模拟检测化学试题(含答案),共15页。试卷主要包含了1ml⋅L-1NaClO溶液等内容,欢迎下载使用。
安徽省滁州市定远县育才学校2022-2023学年高三第二次模拟检测化学试题: 这是一份安徽省滁州市定远县育才学校2022-2023学年高三第二次模拟检测化学试题,共14页。试卷主要包含了1ml⋅L-1NaClO溶液等内容,欢迎下载使用。
安徽省滁州市定远县育才学校2022-2023学年高三下学期开学考试化学试题(Word版含答案): 这是一份安徽省滁州市定远县育才学校2022-2023学年高三下学期开学考试化学试题(Word版含答案),共17页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












