2022届高考化学二轮复习专题化学能与热能--化学反应中的能量变化
展开
这是一份2022届高考化学二轮复习专题化学能与热能--化学反应中的能量变化,共25页。试卷主要包含了单选题,共10小题,多选题,共3小题,非选择题,共6小题等内容,欢迎下载使用。
一、单选题,共10小题
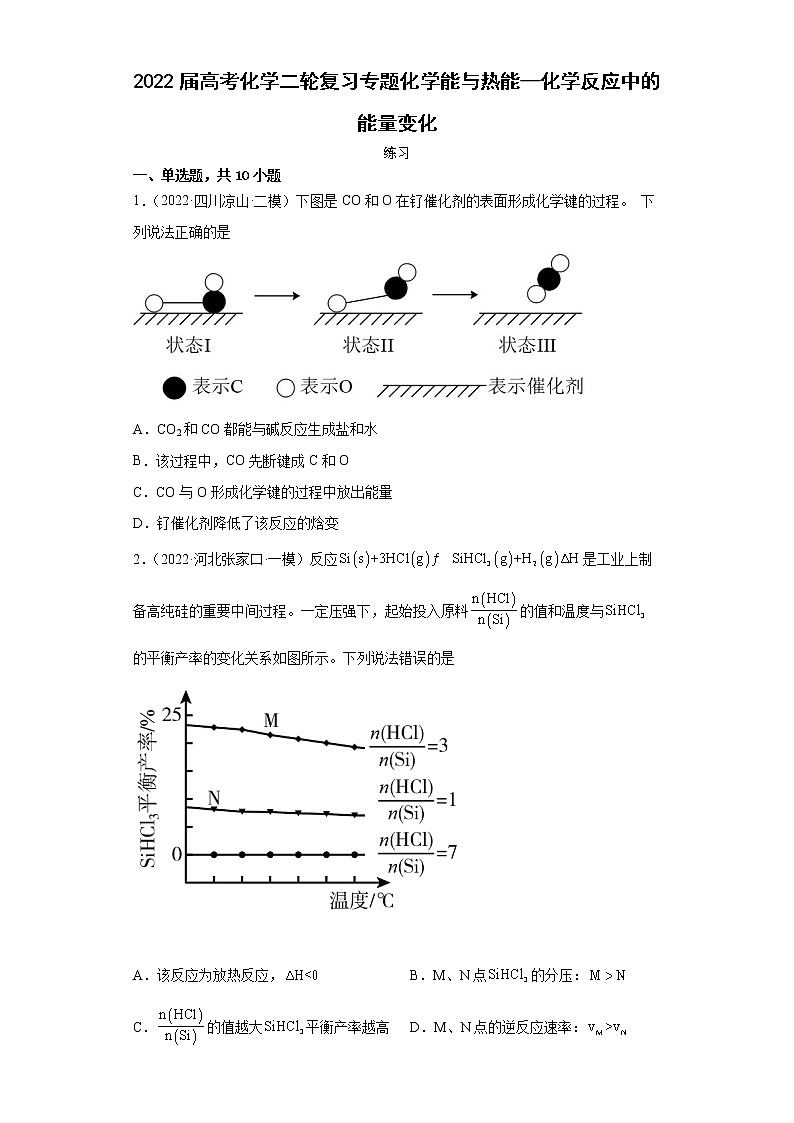
1.(2022·四川凉山·二模)下图是CO和O在钌催化剂的表面形成化学键的过程。 下列说法正确的是
A.CO2和CO都能与碱反应生成盐和水
B.该过程中,CO先断键成C和O
C.CO与O形成化学键的过程中放出能量
D.钌催化剂降低了该反应的焓变
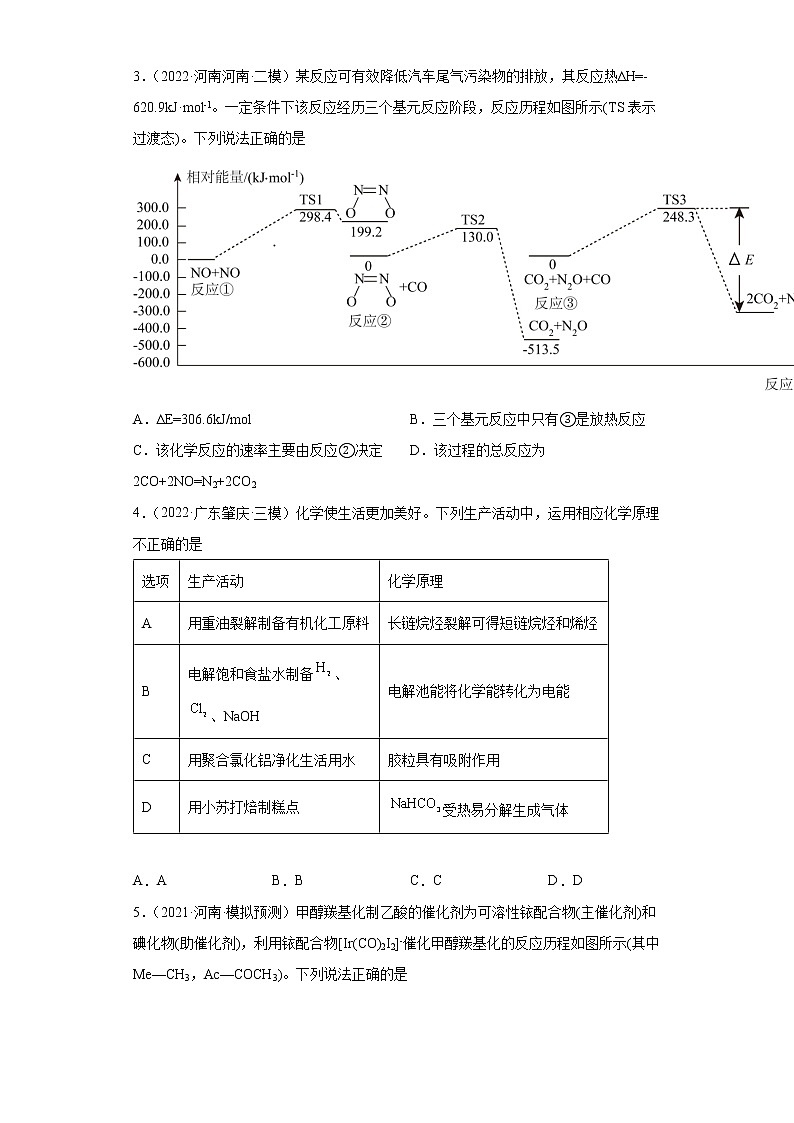
2.(2022·河北张家口·一模)反应是工业上制备高纯硅的重要中间过程。一定压强下,起始投入原料的值和温度与的平衡产率的变化关系如图所示。下列说法错误的是
A.该反应为放热反应,B.M、N点的分压:
C.的值越大平衡产率越高D.M、N点的逆反应速率:
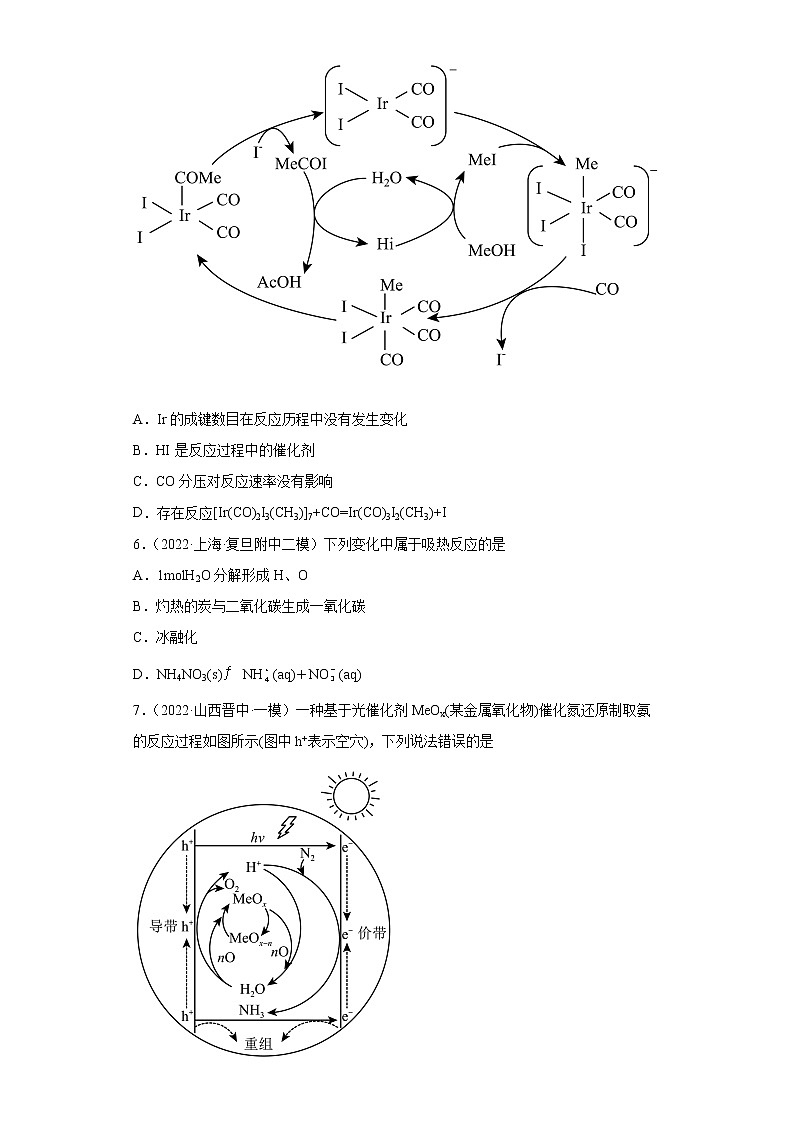
3.(2022·河南河南·二模)某反应可有效降低汽车尾气污染物的排放,其反应热∆H=-620.9kJ·ml-1。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。下列说法正确的是
A.∆E=306.6kJ/mlB.三个基元反应中只有③是放热反应
C.该化学反应的速率主要由反应②决定D.该过程的总反应为2CO+2NO=N2+2CO2
4.(2022·广东肇庆·三模)化学使生活更加美好。下列生产活动中,运用相应化学原理不正确的是
A.AB.BC.CD.D
5.(2021·河南·模拟预测)甲醇羰基化制乙酸的催化剂为可溶性铱配合物(主催化剂)和碘化物(助催化剂),利用铱配合物[Ir(CO)2I2]-催化甲醇羰基化的反应历程如图所示(其中Me—CH3,Ac—COCH3)。下列说法正确的是
A.Ir的成键数目在反应历程中没有发生变化
B.HI是反应过程中的催化剂
C.CO分压对反应速率没有影响
D.存在反应[Ir(CO)2I3(CH3)]7+CO=Ir(CO)3I2(CH3)+I
6.(2022·上海·复旦附中二模)下列变化中属于吸热反应的是
A.1mlH2O分解形成H、O
B.灼热的炭与二氧化碳生成一氧化碳
C.冰融化
D.NH4NO3(s)NH(aq)+NO(aq)
7.(2022·山西晋中·一模)一种基于光催化剂MeOx(某金属氧化物)催化氮还原制取氨的反应过程如图所示(图中h+表示空穴),下列说法错误的是
A.H+和N2是反应物,H2O是中间体
B.导带上发生的反应为2H2O+4h+=4H++O2↑
C.光能转变为化学能
D.该过程总反应可表示为2N2+6H2O4NH3+3O2
8.(2022·上海交大附中模拟预测)已知:热化学方程式为。硫化氢与甲合成甲硫醇的催化反应过程如下图。下列说法中不正确的是
A.过程①和②均吸收能量
B.过程④形成了和
C.(E表示键能)
D.适当降温加压可提高甲醇的平衡转化率
9.(2022·福建福州·二模)苯与的催化反应历程如图所示。关于该反应历程,下列说法正确的是
A.苯与的催化反应为放热反应
B.该反应历程,苯与的催化反应可生成溴苯、邻二溴苯
C.苯与的催化反应决速步伴随着极性键的断裂与形成
D.从反应速率角度,苯与Br,的催化反应主反应为取代反应,原因是该反应活化能更低
10.(2022·江苏·模拟预测)下列关于2SO2(g)+O2(g)⇌2SO3(g) kJ/ml,说法正确的是
A.生产过程中将SO3分离出去,逆反应速率减慢
B.该反应中,反应物的总能量小于生成物的总能量
C.该反应的>0
D.其他条件不变,增大压强,平衡右移,平衡常数增大
二、多选题,共3小题
11.(2022·山东泰安·一模)我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂,可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示。下列说法正确的是
A.充电时,Zn电极周围pH降低
B.放电时,每生成,转移个电子
C.使用催化剂Sn或者均能有效减少副产物CO的生成
D.使用催化剂,中间产物更不稳定
12.(2022·山东·烟台市教育科学研究院一模)H2在石墨烯负载型Pd单原子催化剂(Pd/SVG)上还原NO生成N2和NH3的路径机理及活化能(kJ·ml–1)如图所示。下列说法错误的是
A.H2还原NO生成N2的决速步为反应⑥
B.Pd/SVG上H2还原NO,更容易生成N2
C.根据如图数据可计算NO+5H=NH3+H2O的ΔH
D.由图可知,相同催化剂条件下反应可能存在多种反应历程
13.(2022·山东潍坊·一模)我国科学家研究化合物M(s)催化CO2氢化机理。由化合物M(s)生成化合物N(s)过程的机理和相对能量曲线如下图所示(已知1eV=1.6×10−19J)。TS1、TS2均为过渡态。下列说法错误的是
A.过渡态TS2比TS1更稳定
B.过程P→TS2为化合物M生成化合物N的决速步骤
C.化合物M催化CO2氢化反应过程中一定有Fe-O键的断裂
D.该过程的热化学方程式为:M(s)+CO2(g)=N(s) ΔH=-11.63kJ·ml-1
三、非选择题,共6小题
14.(2022·江苏·模拟预测)有机物催化脱氢制备氢气和化工原料是当前石化工业研究的重要课题之一、
(1)以甲烷、水蒸气为原料进行催化重整是制氢的常见方法之一,过程可能涉及反应:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2 kJ∙ml−1
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=−41.1 kJ∙ml−1
CH4(g)=C(g)+2H2(g) △H3=+74.8 kJ∙ml−1
①反应C(g)+2H2O(g)=CO2(g)+2H2(g) △H4=___________kJ·ml-1
②向原料中添加正硅酸锂Li4SiO4作为CO2的吸附剂,除产生氢气外还生成两种盐,写出该反应的方程式___________。
(2)甲基环己烷催化脱氢(+3H2)是石油工业制氢常见方法,以Ni−Cu为催化剂,固定反应温度为650K,以氮气为载气,在不同载气流速情况下,甲基环己烷脱氢转化率如图1所示,b点转化率能与a点保持相当的原因是___________。
(3)以H2O、CaBr2、Fe3O4为原料进行气固相反应可以实现水的分解制得氢气,其反应原理如图2所示。反应“①”中生成3mlHBr,生成氢气的物质的量为_______,从原料到O2的生成过程可描述为_______。
15.(2021·吉林·东北师大附中一模)工业废水中过量的氨氮(和)会导致水体富营养化,其氨氮总量的检测和去除备受关注。
(1)氨氮总量检测
利用氨气传感器检测水体中氨氮含量的示意图:
若利用氨气传感器将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为,则水样中氨氮(以氨气计)含量为___________mg/L。
(2)氧化法处理氨氮废水
①写出酸性条件下氧化为氮气的离子反应方程式___________。
②为研究空气对氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是___________(填字母)。
a.的氧化性比弱 b.氧化氨氮速率比慢 c.空气中的进入溶液中
(3)传统的生物脱氮机理认为:脱氮过程一般包括氨化[将含氮有机物转化为氨氮(、)、硝化和反硝化三个过程。
①硝化过程:废水中的氨氮(、)在硝化菌(好氧自养型微生物)的作用下被转化为和的过程。其中硝化过程的主要反应原理有:
反应1
反应2
反应3
则x=___________。
②反硝化过程:若在缺氧环境和反硝化菌的作用下,向某含的酸性废水中加入适量的甲醇,能实现“反硝化”过程,并产生两种对环境无污染的气体;写出该过程的离子反应方程式:___________。
(4)新型生物脱氮工艺可将硝化过程中的产物控制在阶段,防止生成,该工艺的优点___________。
16.(2021·浙江·模拟预测)已知制备甲醇的有关化学反应及平衡常数如表所示:
(1)则反应_______;_______(填数据)。
(2)850℃时,在密闭容器中进行反应①,开始时只加入、,反应10后测得各组分的浓度如表:
(ⅰ)该时间段内反应速率_______。
(ⅱ)比较此时正逆反应速率的大小υ正_______(填“>““0
(1)已知合成CH3OH可以由CO和H2反应制备,制备过程中发生的反应有:
①CO(g)+2H2(g)CH3OH(g) △H=-90.7kJ/ml
②2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-23.5k/ml
③CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.2kJ/ml
则反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)的△H=___。
(2)若在恒温恒容容器中进行上述制甲醛的反应,可判断反应达到平衡状态的是___(填序号)。
A.混合气体的密度不变B.CH3OH、HCHO的物质的量浓度之比为1∶1
C.H2的体积分数不再改变D.混合气体的平均相对分子质量不变
(3)能提高上述制甲醛的反应中甲醇平衡转化率的措施是___。
A.及时移除产物B.降低温度
C.恒温恒压充入稀有气体D.使用合适的催化剂
Ⅱ.2—甲氧基—2—甲基丁烷(TAME)常用作汽油原添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如下反应:
反应Ⅰ:+CH3OH △H1
反应Ⅱ:+CH3OH △H2
反应Ⅲ: △H3
(4)反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。据图判断,A和B中相对稳定的是___;反应Ⅱ是___(填“吸热”或“放热”)反应。
(5)为研究上述反应体系的平衡关系,向某反应容器中加入1.0mlTAME,控制温度为353K,测得TAME的平衡转化率为a。已知反应Ⅲ的平衡常数Kx3=8,则平衡体系中B的物质的量为___ml,反应Ⅰ的平衡常数Kx1=___。
(6)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为___(填“X”或“Y”);t=100s时,反应Ⅲ的正反应速率V正___逆反应速率V逆(填“>”“
相关试卷
这是一份高考化学二轮复习(新高考版) 第1部分 专题6 考点一 化学能与热能(含解析),共10页。试卷主要包含了从两种角度理解化学反应热,燃烧热和中和热应用中的注意事项,据文献报道等内容,欢迎下载使用。
这是一份2023高三二轮复习化学(老高考)专题六 化学能与热能课件PPT,共60页。PPT课件主要包含了已知ⅰ等内容,欢迎下载使用。
这是一份2022届高考化学二轮复习专题化学能与热能--化学反应热的计算 (1),共24页。试卷主要包含了单选题,共13小题,非选择题,共6小题等内容,欢迎下载使用。








