





人教版 (2019)选择性必修1第一章 化学反应的热效应第二节 反应热的计算教学ppt课件
展开人教版化学选修一
《盖斯定律》教学设计
课题名 | 盖斯定律 |
教学目标 | 1.通过学习并理解盖斯定律的内容,能用盖斯定律进行有关反应热的 简单计算,培养宏观辨识与微观探析的核心素养。 2.通过学会有关反应热计算的方法技巧,进一步提高化学计算的能力。 |
教学重点 |
|
教学难点 | 盖斯定律的应用 |
教学准备 | 教师准备:课件、例题 学生准备:复习热化学式的相关知识 |
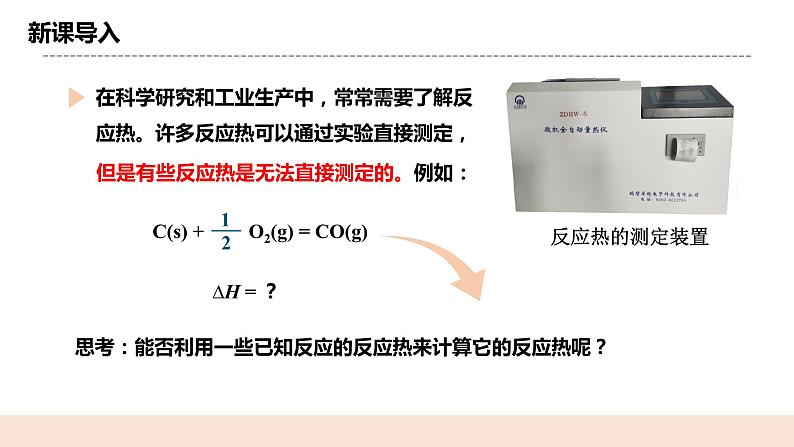
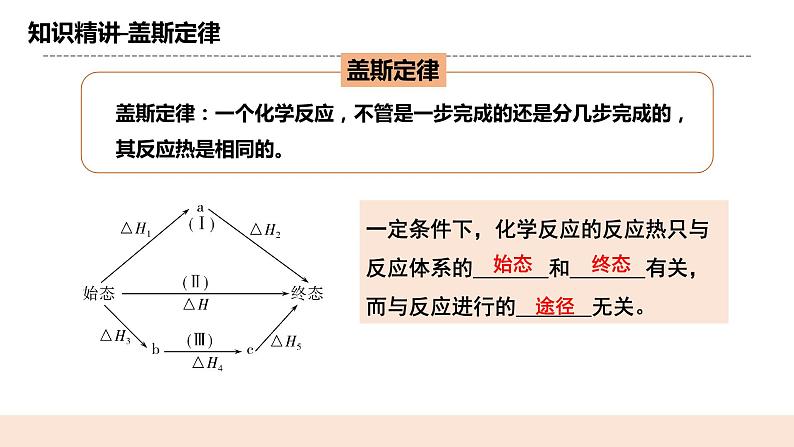
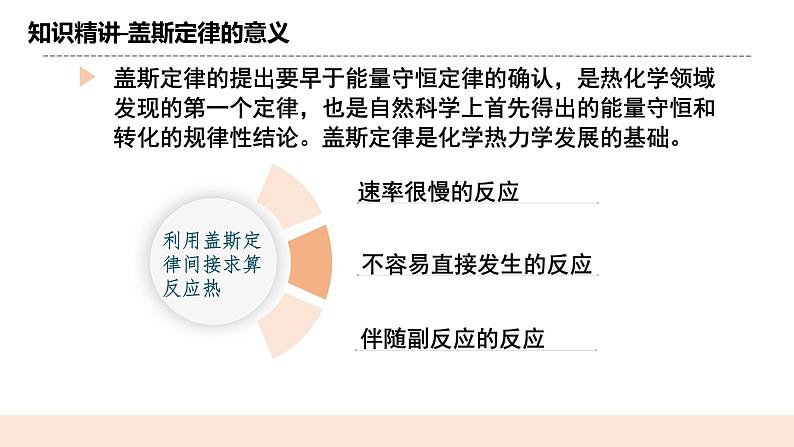
教学过程 | 一. 新课导入 提问:在科学研究和工业生产中,常常需要了解反应热。许多反应热可以通过实验直接测定,但是有些反应热是无法直接测定的。 科学史话:1836年,盖斯利用自己设计的量热计测定了大量的反应热,并依据氨水、氢氧化钠、氢氧化钾、石灰分别与硫酸反应的反应热总结出了盖斯定律。 二.知识精讲 (一) 盖斯定律 1.内容: 一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。 解析:始态→终态有途径Ⅰ、Ⅱ、Ⅲ,根据盖 斯定律推测,各途径中反应热存在关系: ΔH= ΔH1+ΔH2 =ΔH3+ΔH4+ΔH5 即:一定条件下,化学反应的反应热只与 反应体系的__始态__和__终态_有关, 而与反应进行的__途径__无关。 (二)盖斯定律的意义 盖斯定律的提出要早于能量守恒定律的确认,是热化学领域发现的第一个定律,也是自然科学上首先得出的能量守恒和转化的规律性结论。盖斯定律是化学热力学发展的基础。
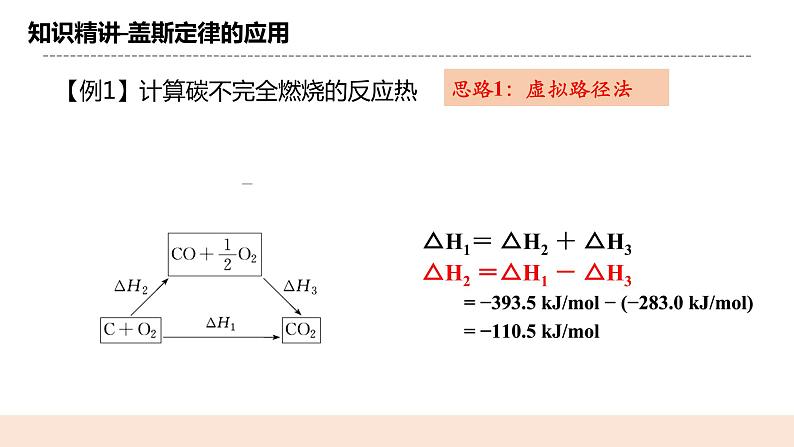
(三)盖斯定律的应用 【例1】计算碳不完全燃烧的反应热 .思路1:路径法 ΔH1= ΔH2+ΔH3 ΔH2= ΔH1-ΔH3 = -393.5KJ/mol-(-283.0 KJ/mol) =-110.5 KJ/mol 思路2:加和法 即运用所给热化学方程式通过加减的方法得到所求热化学方程式。
总结:运用盖斯定律计算反应热的解题模型:
三.随堂练习 1、已知 ① CO(g) + 1/2 O2(g) = CO2(g) ΔH1= -283.0 kJ/mol ② H2(g) + 1/2 O2(g) = H2O(l) ΔH2= -285.8 kJ/mol ③ C2H5OH(l) + 3 O2(g) = 2CO2(g) + 3 H2O(l) ΔH3= -1370 kJ/mol 计算: 2CO(g)+ 4 H2(g)= H2O(l)+ C2H5OH(l) 的ΔH 解 ④=①×2 + ②×4 - ③ 2CO(g)+ 4 H2(g)= H2O(l)+ C2H5OH(l) ΔH =-339.2 kJ/mol 2、某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知: N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol 请写出发射火箭反应的热化学方程式。 解 ③=②×2 - ① 2N2H4(g)+ 2NO2(g)==3N2(g)+4H2O(l) △H3=-1135.2kJ/mol 3、已知25 ℃、101 kPa时: 4Fe(s)+3O2(g)==2Fe2O3(s) ΔH=-1 648 kJ·mol-1 ① C(s)+O2(g)==CO2(g) ΔH=-393 kJ·mol-1 ② 2Fe(s)+2C(s)+3O2(g)==2FeCO3(s) ΔH=-1 480 kJ·mol-1 ③ FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。 解析:①×1/2+②×2-③ = -1648 ×1/2+(-393 )×2-(-1480 ) =-130 kJ·mol-1 4、室温下,CuSO4·5H2O(s)、CuSO4(s)与其水溶液之间转化的焓变关系如图, 已知CuSO4·5H2O(s)溶于水,溶液温度降低;CuSO4(s)溶于水,溶液温度升高。 下列有关说法正确的是 ( ) A.从硫酸铜溶液中析出CuSO4·5H2O(s)的反应焓变ΔH>0 B.1 mol CuSO4(s)的总能量大于1 mol Cu2+(aq)与1 mol SO42−(aq)的总能量 C.ΔH2>ΔH1 D.ΔH1=ΔH2+ΔH3
四、课堂小结
|
布置作业 | 化学课时作业《盖斯定律》 |
板书设计 | 盖斯定律 1.内容: 一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。 解析: 一定条件下,化学反应的反应热只与反应体系的始态和终态有关, 而与反应进行的途径无关。 2.意义: 3.应用:思路1:路径法 思路2:加和法 |
教学反思 | 本节课要注意引导学生理解盖斯定律的含义,通过理解含义帮助学生应用盖斯定律解决实际问题,在教学中给与学生充分的自主练习时间,可利用小组合作等模式,突出学生的主体地位。 |
高中化学人教版 (2019)选择性必修1第二节 反应热的计算示范课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算示范课课件ppt,共21页。PPT课件主要包含了学习目标,课前导入,知识点一,盖斯定律,①从反应途径分析,②从能量守恒分析,始态S,终态L,盖斯定律的应用,1虚拟路径法等内容,欢迎下载使用。
人教版 (2019)第二节 反应热的计算优质课ppt课件: 这是一份人教版 (2019)第二节 反应热的计算优质课ppt课件,文件包含121盖斯定律练习解析版docx、121盖斯定律练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
高中化学第二节 反应热的计算一等奖ppt课件: 这是一份高中化学第二节 反应热的计算一等奖ppt课件,文件包含人教版高中化学选择性必修一121《盖斯定律》课件pptx、人教版高中化学选择性必修一121《盖斯定律》学案docx等2份课件配套教学资源,其中PPT共20页, 欢迎下载使用。














