





所属成套资源:山东专用高考化学一轮复习专题基础篇教学PPT课件
山东专用高考化学一轮复习专题七原子结构元素周期表与元素周期律_基础篇课件
展开
这是一份山东专用高考化学一轮复习专题七原子结构元素周期表与元素周期律_基础篇课件,共18页。
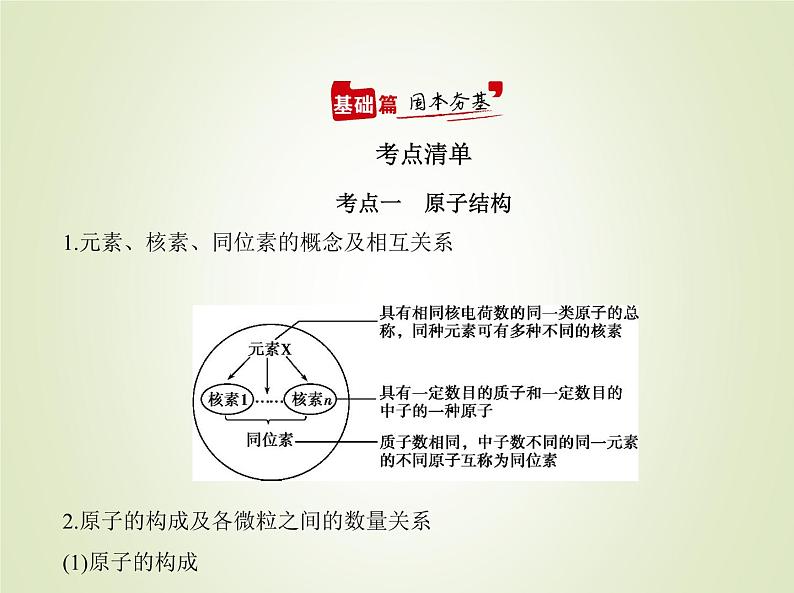
考点一 原子结构1.元素、核素、同位素的概念及相互关系 2.原子的构成及各微粒之间的数量关系(1)原子的构成
原子 X) (2)各微粒间的数量关系 X表示质量数为A、质子数为Z的一个原子。1)核电荷数=③ 核内质子数 =原子核外电子数;2)质量数(A)=质子数(Z)+中子数(N);3)离子所带电荷数=质子数-核外电子总数。3.基态原子核外电子排布及其表示方法(1)排布原则1)能量最低原理
原子核外电子先占据能量低的轨道,然后依次进入能量较高的轨道,使整
个原子的能量处于最低状态。2)泡利不相容原理在一个原子轨道里,最多只能容纳④ 2 个电子,而且它们的自旋状态
⑤ 不同 。3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独
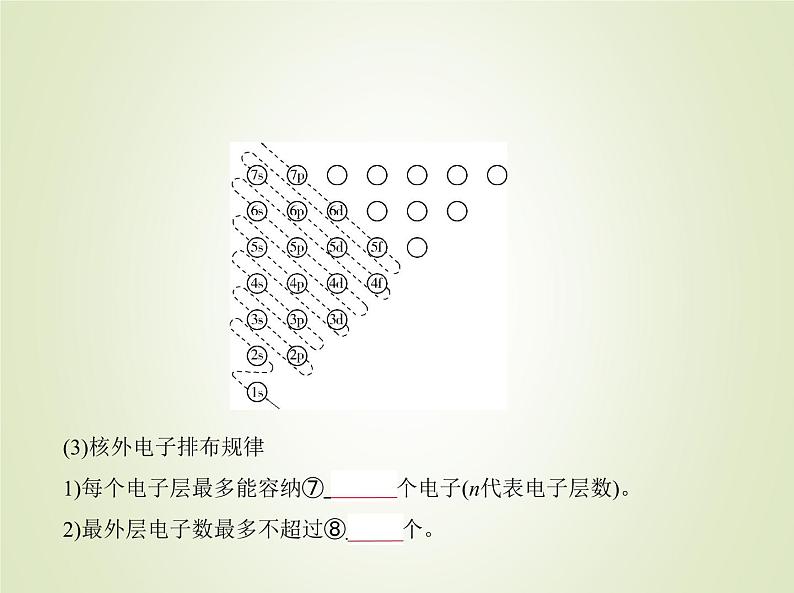
占据一个轨道,而且自旋状态⑥ 相同 ,这个规则称为洪特规则。(2)填充顺序——构造原理
(3)核外电子排布规律1)每个电子层最多能容纳⑦ 2n2 个电子(n代表电子层数)。2)最外层电子数最多不超过⑧ 8 个。
3)次外层电子数最多不超过⑨ 18 个,倒数第三层不超过⑩ 32
个。(4)基态原子核外电子排布的表示方法(以硫原子为例)
考点二 元素周期表与元素周期律
一、元素周期表1.编排原则 2.结构
3.元素周期表的分区s区元素:ⅠA族和ⅡA族元素;p区元素:ⅢA~ⅦA族元素和0族元素;d区元素:ⅢB~Ⅷ族元素(镧系元素和锕系元素除外);ds区元素:ⅠB和ⅡB族元素;f区元素:镧系元素和锕系元素。
二、元素周期律1.定义:元素的性质随着③ 原子序数 的递增,而呈周期性变化的规
律。2.实质:原子核外电子排布呈现周期性变化决定了元素④ 性质 的周
期性变化。3.具体表现
三、元素周期表中的位置、结构、性质的关系元素的原子结构决定了元素在周期表中的位置和元素的主要性质,元素
在周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之
间可相互推断。
结合元素化合物的性质、应用、转化进行元素推断在高考中该类题常以元素单质及其化合物的特征性质、典型应用、反
应现象或重要转化为突破口,进行元素推断,进而考查原子半径大小比
较、金属性和非金属性强弱比较、物质类别的判断、元素单质及其化
合物的重要性质及递变规律等。解题的关键是熟记单质或化合物具有“特性”的元素:(1)地壳中含量最多的元素或简单氢化物呈液态的元素:O。(2)形成化合物种类最多的元素或形成的某种单质是自然界中硬度最大
的物质的元素:C。(3)气态氢化物的水溶液呈碱性或气态氢化物能与其最高价氧化物对应
的水化物发生化合反应或氢化物常做制冷剂的元素:N。
(4)最活泼的非金属元素或无正化合价的主族元素或无氧酸可腐蚀玻璃
的元素或简单阴离子的还原性最弱的元素:F。(5)焰色呈黄色的元素:Na;焰色呈紫色(透过蓝色钴玻璃观察)的元素:K。(6)地壳中含量最多的金属元素:Al。(7)简单氢化物和其最高价氧化物对应的水化物能发生氧化还原反应的
元素或简单氢化物能和其氧化物在常温下反应生成该元素对应的单
质:S。(8)单质为黄绿色气体的元素:Cl。(9)可组成红棕色有刺激性气味气体的两种元素:O、N。
例 (2020山师附中高三一模,5)短周期元素W、X、Y、Z的原子序数依
次增加。M、N、P、Q分别是这些元素形成的单质,甲、乙、丙、丁、
戊是由这些元素形成的二元化合物。其中,乙是一种能使湿润的红色石
蕊试纸变蓝的无色气体;丙是一种高能燃料,其组成元素与乙相同;丁是常
见的两性氧化物。上述物质的转化关系如图所示。下列说法正确的是
( ) A.原子半径的大小:W
相关课件
这是一份人教版高考化学一轮复习第5单元原子结构元素周期律第1节原子结构元素周期表课件
这是一份山东专用高考化学一轮复习专题十一化学能与电能的转化_基础篇课件,共28页。
这是一份山东专用高考化学一轮复习专题四氧化还原反应_基础篇课件,共24页。








