
所属成套资源:高考化学一轮复习成套课时学案
高考化学一轮复习第2章物质及其变化第3讲离子共存离子检验和推断学案
展开
这是一份高考化学一轮复习第2章物质及其变化第3讲离子共存离子检验和推断学案,共10页。
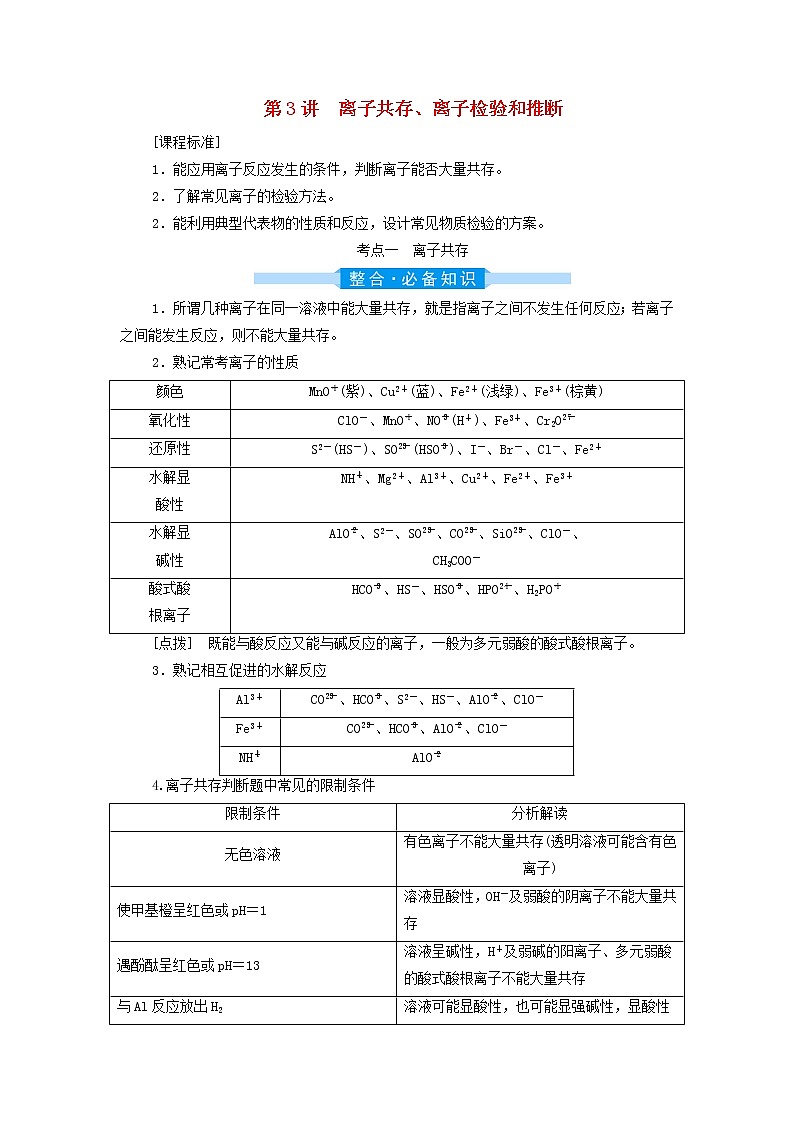
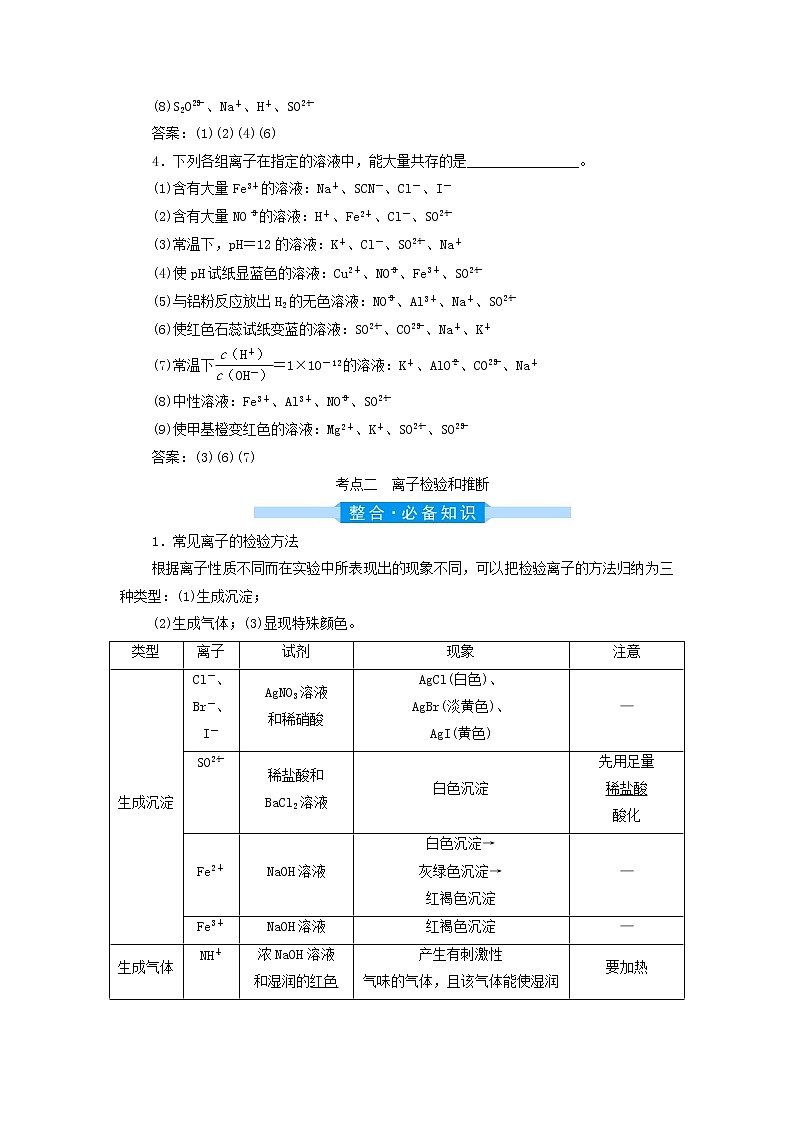
第3讲 离子共存、离子检验和推断[课程标准]1.能应用离子反应发生的条件,判断离子能否大量共存。2.了解常见离子的检验方法。2.能利用典型代表物的性质和反应,设计常见物质检验的方案。考点一 离子共存1.所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。2.熟记常考离子的性质颜色MnO(紫)、Cu2+(蓝)、Fe2+(浅绿)、Fe3+(棕黄)氧化性ClO-、MnO、NO(H+)、Fe3+、Cr2O还原性S2-(HS-)、SO(HSO)、I-、Br-、Cl-、Fe2+水解显酸性NH、Mg2+、Al3+、Cu2+、Fe2+、Fe3+水解显碱性AlO、S2-、SO、CO、SiO、ClO-、CH3COO-酸式酸根离子HCO、HS-、HSO、HPO、H2PO[点拨] 既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。3.熟记相互促进的水解反应Al3+CO、HCO、S2-、HS-、AlO、ClO-Fe3+CO、HCO、AlO、ClO-NHAlO4.离子共存判断题中常见的限制条件限制条件分析解读无色溶液有色离子不能大量共存(透明溶液可能含有色离子)使甲基橙呈红色或pH=1溶液显酸性,OH-及弱酸的阴离子不能大量共存遇酚酞呈红色或pH=13溶液呈碱性,H+及弱碱的阳离子、多元弱酸的酸式酸根离子不能大量共存与Al反应放出H2溶液可能显酸性,也可能显强碱性,显酸性时不能含NO由水电离出的 c(H+)=1×10-13 mol·L-1水的电离受到抑制,溶液可能显酸性,也可能显碱性因发生氧化还原反应而不能大量共存能发生氧化还原反应的氧化性离子和还原性离子不能大量共存“一定能”“可能”或“不能”大量共存确定是“可能性”还是“肯定性”加水稀释,减小说明该溶液呈酸性[稀释的是溶质,c(H+)减小,而c(OH-)增大]某溶液中lg =12该溶液呈酸性Fe3+与SCN-不能大量共存二者发生络合反应1.下列各组离子在溶液中因发生复分解反应而不能大量共存的是________。(1)K+、H+、CH3COO-、Br-(2)Ba2+、Na+、CO、NO(3)Na+、HCO、H+、Cl-(4)Al3+、Fe3+、NO、SO(5)Na+、K+、AlO、NO(6)Na+、H+、Cl-、OH-答案:(1)(2)(3)(6)2.下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是________。(1)H3O+、NO、Fe2+、Na+ (2)Na+、Fe3+、I-、Cl-(3)H+、S2-、SO、SO (4)SO、NO、Na+、H+(5)I-、ClO-、K+、H+ (6)Na+、K+、MnO、NO答案:(1)(2)(3)(5)3.下列各组离子在溶液中因水解相互促进而不能大量共存的是________。(1)Al3+、HCO、Cl-、K+(2)Al3+、SiO、Na+、Cl-(3)Fe3+、NH、SO、S2-(4)Fe3+、Cl-、Na+、CO(5)Al3+、Fe3+、SCN-、Cl-(6)Na+、Al3+、NO、AlO(7)Na+、Ca2+、HCO、HSO(8)S2O、Na+、H+、SO答案:(1)(2)(4)(6)4.下列各组离子在指定的溶液中,能大量共存的是________________。(1)含有大量Fe3+的溶液:Na+、SCN-、Cl-、I-(2)含有大量NO的溶液:H+、Fe2+、Cl-、SO(3)常温下,pH=12的溶液:K+、Cl-、SO、Na+(4)使pH试纸显蓝色的溶液:Cu2+、NO、Fe3+、SO(5)与铝粉反应放出H2的无色溶液:NO、Al3+、Na+、SO(6)使红色石蕊试纸变蓝的溶液:SO、CO、Na+、K+(7)常温下=1×10-12的溶液:K+、AlO、CO、Na+(8)中性溶液:Fe3+、Al3+、NO、SO(9)使甲基橙变红色的溶液:Mg2+、K+、SO、SO答案:(3)(6)(7)考点二 离子检验和推断1.常见离子的检验方法根据离子性质不同而在实验中所表现出的现象不同,可以把检验离子的方法归纳为三种类型:(1)生成沉淀;(2)生成气体;(3)显现特殊颜色。类型离子试剂现象注意生成沉淀Cl-、Br-、I-AgNO3溶液和稀硝酸AgCl(白色)、AgBr(淡黄色)、AgI(黄色)—SO稀盐酸和BaCl2溶液白色沉淀先用足量稀盐酸酸化Fe2+NaOH溶液白色沉淀→灰绿色沉淀→红褐色沉淀—Fe3+NaOH溶液红褐色沉淀—生成气体NH浓NaOH溶液和湿润的红色石蕊试纸产生有刺激性气味的气体,且该气体能使湿润的红色石蕊试纸变蓝要加热CO稀盐酸和澄清石灰水产生能使澄清石灰水变浑浊的气体SO、HSO、HCO有干扰SO稀硫酸和品红溶液产生有刺激性气味的气体,且该气体能使品红溶液褪色,加热后溶液又恢复红色HSO有干扰显现特殊颜色I-氯水(少量),CCl4下层为紫色或紫红色—Fe2+①KSCN溶液和氯水先是无变化,滴加氯水后溶液变红色先加KSCN溶液,无变化,再加氯水②铁氰化钾{K3[Fe(CN)6]}溶液生成蓝色沉淀,即Fe3[Fe(CN)6]2—Fe3+①KSCN溶液红色—②苯酚溶液紫色—Na+、K+洁净的Pt(或Fe)丝和稀盐酸火焰分别呈黄色、紫色K+的焰色要透过蓝色钴玻璃观察2.“坚持四项基本原则”突破无机离子推断(1)互斥性原则:当利用题给实验现象判断出一定有某种离子存在时,应立即运用已有知识,将不能与之大量共存的离子排除掉,从而判断出一定没有哪种离子。(2)酸碱性原则:根据溶液的酸碱性判断,一是初步判断可能组成哪些物质,联系盐类的水解;二是在酸性或碱性溶液中哪些离子不能大量存在。(3)进出性原则:在进行离子检验时,往往需要加入试剂,这样就会引入新的离子,原溶液中是否存在该种离子就无法判断,还有一些离子会随着实验过程中所产生的沉淀或气体而消失,有可能对后续的实验造成影响。(4)电中性原则:在任何电解质溶液中,阴、阳离子的总电荷数是守恒的,即溶液呈电中性。在判断混合体系中某些离子存在与否时,有的离子并未通过实验验证,但我们可运用溶液中电荷守恒理论来判断其是否存在。题组一 离子的检验1.下列关于某无色溶液中所含离子的鉴别,判断正确的是( )A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在B.通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解,可确定有SO存在D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO存在解析:选B。稀盐酸中含有Cl-,对Cl-的检验有干扰,A错;通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,则溶液中有I-存在,B对;SO能与Ba(NO3)2反应生成BaSO3沉淀,加入稀盐酸后在H+、NO的作用下可转化为BaSO4沉淀,C错;能使澄清石灰水变浑浊的气体是CO2或SO2,原溶液中可能存在的离子是CO、HCO、SO或HSO,D错。2.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )选项操作现象结论A滴加BaCl2溶液生成白色沉淀原 溶 液 中 有SOB滴加稀硫酸有刺激性气味的气体产生原 溶 液 中 有SOC用洁净的铂丝蘸取溶液进行焰色试验火焰呈紫色(透过蓝色钴玻璃观察)原 溶 液 中 有K+D滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口试纸不变蓝原 溶 液 中 无NH解析:选C。A项,加入BaCl2溶液得到白色沉淀,原溶液中可能含有SO、SO或Ag+;B项,HSO也有同样的现象;C项,观察K+的焰色时透过蓝色钴玻璃,排除Na+的干扰;D项,检验NH应加入浓NaOH溶液,且需要加热。离子检验中常见干扰离子以及排除措施待检离子干扰离子排除措施Cl-SO加过量的Ba(NO3)2溶液CO加稀硝酸酸化OH-SOCO加盐酸酸化SOAg+SOCO加盐酸后将产生的气体通入品红溶液中COSO加硝酸后将产生的气体通入澄清石灰水中题组二 离子的推断3.有一无色溶液,可能含有Fe3+、K+、Al3+、Mg2+、NH、Cl-、SO、HCO、MnO中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入稀硝酸酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )A.肯定有Al3+、Mg2+、NH、Cl-B.肯定有Al3+、Mg2+、HCOC.肯定有K+、HCO、MnOD.肯定有Al3+、Mg2+、SO解析:选D。无色溶液中一定不含Fe3+和MnO。①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,因为过氧化钠和水反应生成氢氧化钠和氧气,所以无色无味的气体是O2,一定不是NH3,则一定没有NH,再加入足量的NaOH溶液后白色沉淀部分溶解,沉淀的成分应该是氢氧化铝和氢氧化镁,则溶液中一定含有Al3+、Mg2+,一定不含HCO。②另取部分溶液,加入稀硝酸酸化的Ba(NO3)2溶液,有白色沉淀产生,则一定含有SO。综上分析,溶液中一定含有Al3+、Mg2+、SO,一定不含Fe3+、MnO、NH、HCO,不确定是否含有K+和Cl-。4.某无色溶液Y可能含有Na+、Fe3+、Ba2+、NH、Cl-、SO、HCO、HSO中的几种离子,溶液中阳离子浓度相同。为了确定其组成,某同学进行了如下实验(假设气体均全部逸出,忽略H2O2的分解)。下列说法不正确的是( )A.溶液Y中一定不存在Fe3+、SOB.溶液Y中一定含有Cl-,且n(Cl-)=0.01 molC.溶液Y中肯定存在HCO、HSO、Ba2+、NHD.溶液Y中可能存在Na+,为确定其是否存在,可取溶液1通过焰色试验验证解析:选B。因为是无色溶液,因此溶液中不含Fe3+,加入足量盐酸酸化的H2O2溶液,有沉淀和气体生成,推出原溶液中含有Ba2+和HSO、HCO,一定不含SO,其中n(Ba2+)=n(HSO)=n(BaSO4)==0.01 mol,n(HCO)=n(CO2)==0.01 mol;向溶液1中加入Ba(OH)2溶液并加热,产生气体,此气体为NH3,n(NH)=n(NH3)==0.01 mol。根据溶液呈电中性,原溶液中一定含有Cl-,因为无法确定是否含有Na+,因此n(Cl-)≥0.01 mol。根据上述分析可知,A、C说法正确,B说法错误;检验Na+,需要进行焰色试验,若火焰呈黄色,说明含有Na+,否则不含Na+,D说法正确。1.(2020·高考全国卷Ⅱ)某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色试验,通过钴玻璃可观察到紫色;③向溶液中加碱,产生白色沉淀。根据实验现象可判断其组成为( )A.KCl、NaCl B.KCl、MgSO4C.KCl、CaCO3 D.MgSO4、NaCl解析:选B。根据实验①混合物溶于水,得到澄清透明溶液,而CaCO3难溶于水,即白色固体中一定不含CaCO3;根据实验②做焰色试验时焰色呈紫色(透过蓝色钴玻璃)可确定含有钾元素,即白色固体中含有KCl;结合实验③向溶液中加碱产生白色沉淀,可知溶液中含有能与OH-反应生成白色沉淀的离子,只能为Mg2+,即白色固体的另一成分为MgSO4。综合上述分析,可知B项正确。2.(2020·高考江苏卷)常温下,下列各组离子在指定溶液中能大量共存的是( )A.0.1 mol·L-1 氨水溶液:Na+、K+、OH-、NOB.0.1 mol·L-1 盐酸溶液:Na+、K+、SO、SiOC.0.1 mol·L-1 KMnO4溶液:NH、Na+、NO、I-D.0.1 mol·L-1 AgNO3溶液:NH、Mg2+、Cl-、SO解析:选A。氨水中,Na+、K+、OH-、NO彼此不反应,能大量共存,A项正确;盐酸中的H+能与SiO结合生成H2SiO3沉淀,B项错误;KMnO4溶液具有强氧化性,具有还原性的I-不能大量存在,C项错误;AgNO3溶液中的Ag+能与Cl-、SO反应生成沉淀,不能大量共存,D项错误。3.(2019·高考江苏卷)室温下,下列各组离子在指定溶液中能大量共存的是( )A.0.1 mol·L-1 NaOH溶液:Na+、K+、CO、AlO B.0.1 mol·L-1 FeCl2溶液:K+、Mg2+、SO、MnO C.0.1 mol·L-1 K2CO3溶液:Na+、Ba2+、Cl-、OH-D.0.1 mol·L-1 H2SO4溶液:K+、NH、NO、HSO解析:选A。A项,题给四种离子在碱性条件下能大量共存,正确;B项,MnO可以氧化Fe2+,错误;C项,CO与Ba2+会发生反应生成BaCO3沉淀,错误;D项,H+可以与HSO反应生成SO2,且酸性条件下NO会氧化HSO生成SO,错误。4.(2019·浙江4月选考)白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。下列推断不正确的是( )A.无色溶液B的pH≥7B.白色固体F的主要成分是H2SiO3C.混合物A中有Na2SiO3、CuSO4和CaCO3D.在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl解析:选C。混合物A加水溶解后得到固体C,固体C加过量硝酸后,得到白色固体F,由混合物A的成分可知,F的主要成分为H2SiO3,B项正确;蓝色溶液E中存在Cu2+,故白色固体混合物A中存在CuSO4,无色气体D为CO2,故白色固体混合物A中可能含有Na2CO3,与CuSO4反应生成碱式碳酸铜进入固体C,也可能含有CaCO3,C项错误;CuSO4与Na2SiO3或Na2CO3反应生成CuSiO3或碱式碳酸铜沉淀进入固体C,同时生成Na2SO4,故无色溶液B中一定含有Na2SO4,可能存在KCl、Na2CO3、Na2SiO3,故溶液的pH≥7,A项正确;无色溶液B经HNO3酸化后,无沉淀,再加AgNO3有白色沉淀产生,说明A中有KCl,D项正确。1.某化学实验室产生的废液中只可能含有Na+、Al3+、Fe2+、Fe3+、Ba2+、CO、SO、Cl-中的某几种,实验室设计了以下方案对废液进行处理,以确定其组成。①取少许废液,逐滴滴加NaOH溶液直至过量,先产生沉淀后沉淀部分溶解,过滤得到沉淀甲和滤液甲;②沉淀甲在空气中灼烧得到红棕色固体;③向滤液甲中加入过量稀硫酸,过滤得到滤液乙和沉淀乙。下列说法中正确的是( )A.根据步骤①的现象,可推知废液中一定含有Al3+,一定不含COB.根据步骤②,可推知废液中一定含有Fe3+C.取滤液乙进行焰色试验,火焰呈黄色,可推知废液中一定含有Na+D.不能确定该废液中是否含有Cl-解析:选A。取少许废液,逐滴滴加NaOH溶液直至过量,先产生沉淀后沉淀部分溶解,则废液中含有Al3+;未给出不溶沉淀的颜色,且沉淀甲在空气中灼烧得到红棕色固体,则至少含有Fe2+、Fe3+中的一种;给出的离子中与Al3+反应的CO不能存在;向滤液甲中加入过量稀硫酸,过滤得到滤液乙和沉淀乙,则原溶液中含有Ba2+,不含SO;溶液中一定含有阴离子,则一定存在Cl-。A.根据步骤①的现象可推知,废液中一定含有Al3+,则不含与Al3+反应的CO,A说法正确;B.根据步骤②,可推知废液中至少含有Fe2+、Fe3+中的一种,B说法错误;C.取滤液乙进行焰色试验,火焰呈黄色,可推知滤液乙中一定含有Na+,由于步骤①中加入NaOH溶液,则不能确定废液中是否含有Na+,C说法错误;D.由上述分析可知,确定该废液中含有Cl-,D说法错误。2.(双选)某兴趣小组对实验室中的一种白色固体进行鉴别,实验探究如下:①将适量白色固体溶于水,得到无色溶液A,溶液呈碱性;②用铂丝蘸取少量无色溶液A在火焰上灼烧,产生黄色火焰;③取少量无色溶液A,加入酸性高锰酸钾溶液,溶液褪色,继续加入氯化钡溶液生成不溶于硝酸的白色沉淀;④另取少量无色溶液A,加入硫粉,加热,硫溶解,得到无色溶液B,且无其他明显现象;继续向溶液B中加入盐酸,产生淡黄色沉淀和刺激性气味的气体;若将溶液B加入AgBr沉淀中,沉淀溶解。下列叙述错误的是( )A.由实验可推测该白色固体为Na2SO3或NaHSO3B.实验③发生反应的离子方程式可能为5HSO+2MnO+H+===2Mn2++5SO+3H2OC.实验④中生成无色溶液B的化学方程式为Na2SO3+SNa2S2O3D.由实验④可知,S2O可以和Ag+形成配合物[Ag(S2O3)2]3-而使AgBr溶解解析:选AB。由实验现象分析,将适量白色固体溶于水,得到无色溶液A,用铂丝蘸取少量无色溶液A在火焰上灼烧,产生黄色火焰,则溶液A中含有Na+;取少量无色溶液A,加入酸性高锰酸钾溶液,溶液褪色,继续加入氯化钡溶液生成不溶于硝酸的白色沉淀,则溶液中含有HSO或SO,白色固体为Na2SO3或NaHSO3,因为溶液A呈碱性,所以白色固体只能为Na2SO3;向Na2SO3溶液中加入硫粉,加热,反应生成Na2S2O3,故溶液B为Na2S2O3溶液,加入盐酸,Na2S2O3在酸性条件下发生歧化反应生成S和SO2;将Na2S2O3溶液加入AgBr沉淀中形成配合物[Ag(S2O3)2]3-,据此分析解答问题。根据上述分析可知,白色固体为Na2SO3,A选项错误;溶液A中不存在HSO,实验③中发生的离子反应为5SO+2MnO+6H+===2Mn2++5SO+3H2O,B选项错误;实验④中Na2SO3溶液和硫粉在加热条件下发生反应生成Na2S2O3,化学方程式为Na2SO3+SNa2S2O3,C选项正确;实验④中AgBr沉淀溶解是因为Ag+与S2O形成了配合物[Ag(S2O3)2]3-,D选项正确。
相关学案
这是一份鲁科版高考化学一轮复习第2章第7讲离子共存与离子推断课时学案,共18页。
这是一份新高考化学一轮复习精品学案 第1章 第3讲 离子共存、离子检验与推断(含解析),共20页。
这是一份2024年高考化学一轮复习 第6讲 离子共存、离子检验与推断 学案(含答案),共16页。









