

所属成套资源:新人教版高考化学一轮复习成套课时学案
新人教版高考化学一轮复习第2章化学物质及其变化第5讲物质的组成分类性质和变化学案
展开
这是一份新人教版高考化学一轮复习第2章化学物质及其变化第5讲物质的组成分类性质和变化学案,共13页。学案主要包含了物质的组成,物质的分类,常见无机物之间的转化关系,Fe3胶体的制备等内容,欢迎下载使用。
考点一 物质的组成与分类
一、物质的组成
1.原子、分子和离子的概念
原子是化学变化中的最小微粒,分子是保持物质化学性质的最小微粒。一般来说,分子由原子通过共价键构成,但稀有气体是单原子分子,无化学键。离子是带电荷的原子或原子团。
2.元素、物质和微粒间的关系
(1)宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
(2)元素:具有相同核电荷数的一类原子的总称。
(3)元素与物质的关系
元素eq \(――→,\s\up8(组成))eq \b\lc\{(\a\vs4\al\c1(单质:同种元素组成的纯净物,化合物:两种或两种以上的元素组成的纯净物))
(4)元素在物质中的存在形态
①游离态:元素以单质形式存在的状态。
②化合态:元素以化合物形式存在的状态。
(5)原子通过微粒间作用力构成物质
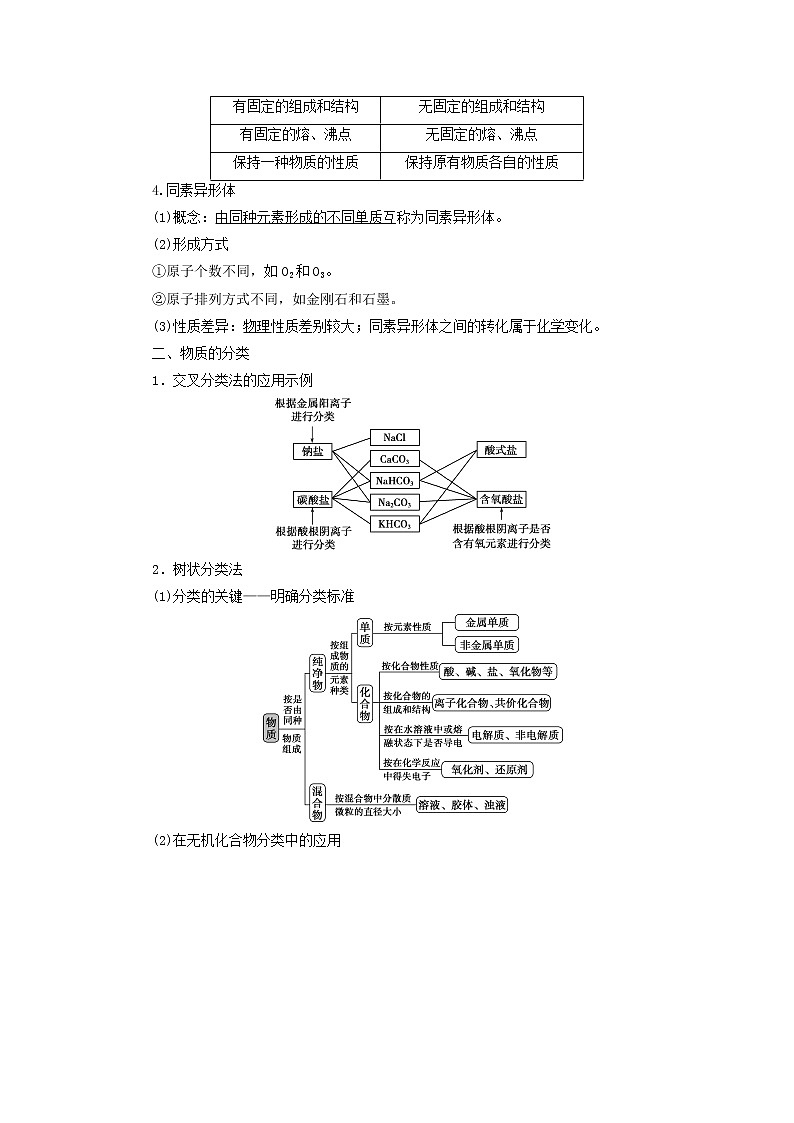
3.纯净物与混合物
(1)纯净物:由同种单质或化合物组成的物质。
(2)混合物:由几种不同的单质或化合物组成的物质。
(3)纯净物和混合物的区别
4.同素异形体
(1)概念:由同种元素形成的不同单质互称为同素异形体。
(2)形成方式
①原子个数不同,如O2和O3。
②原子排列方式不同,如金刚石和石墨。
(3)性质差异:物理性质差别较大;同素异形体之间的转化属于化学变化。
二、物质的分类
1.交叉分类法的应用示例
2.树状分类法
(1)分类的关键——明确分类标准
(2)在无机化合物分类中的应用
eq \a\vs4\al(无机化合物)eq \b\lc\{(\a\vs4\al\c1(氢化物:HCl、H2S、H2O、NH3等,氧化物\b\lc\{(\a\vs4\al\c1(不成盐氧化物:CO、NO等,成盐氧化物\b\lc\{(\a\vs4\al\c1(碱性氧化物:Na2O、CaO等,酸性氧化物:CO2、P2O5等,两性氧化物:Al2O3等)),过氧化物:Na2O2、H2O2等)),酸\b\lc\{(\a\vs4\al\c1(按电离出的H+个数\b\lc\{(\a\vs4\al\c1(一元酸:HCl、HNO3等,二元酸:H2SO4、H2S等,三元酸:H3PO4等)),按酸根是否含氧元素\b\lc\{(\a\vs4\al\c1(无氧酸:HCl、H2S等,含氧酸:HClO4、H2SO4等)),按酸性强弱\b\lc\{(\a\vs4\al\c1(强酸:HCl、H2SO4、HNO3等,弱酸:CH3COOH、HF等)),按有无挥发性\b\lc\{(\a\vs4\al\c1(挥发性酸:HNO3、HCl等,难挥发性酸:H2SO4、H3PO4等)))),碱\b\lc\{(\a\vs4\al\c1(按水溶性\b\lc\{(\a\vs4\al\c1(可溶性碱:NaOH、KOH、Ba(OH)2等,难溶性碱:Mg(OH)2、Cu(OH)2等)),按碱性强弱\b\lc\{(\a\vs4\al\c1(强碱:NaOH、Ba(OH)2、KOH等,弱碱:NH3·H2O等))))))
eq \a\vs4\al(无机化合物)eq \b\lc\{(\a\vs4\al\c1(盐\b\lc\{(\a\vs4\al\c1(正盐:BaSO4、KNO3、NaCl等,酸式盐:NaHCO3、KHSO4等,碱式盐:Cu2(OH)2CO3等,复盐:KAl(SO4)2·12H2O等))))
判断正误(正确的打“√”,错误的打“×”)。
(1)物质组成成分的判断及分子、原子、离子的概念
①“天宫二号”使用的碳纤维是一种新型有机高分子材料。( )
②Na、NaCl、SiO2、H2SO4都称为分子式。( )
③含有金属元素的离子不一定是阳离子。( )
④同一种元素可能有多种不同的原子,同一种原子也可能形成不同的离子。( )
(2)纯净物与混合物的判断
①某物质经科学测定只含有一种元素,不可以断定该物质一定是纯净物。( )
②用于环境消毒的漂白粉是混合物。( )
③花生油和汽油的主要成分都是烃的混合物。( )
④冰水共存物为纯净物。( )
⑤胆矾(CuSO4·5H2O)、明矾[KAl(SO4)2·12H2O]均属于混合物。( )
⑥纤维素、合成纤维、塑料等高分子化合物均为混合物。( )
(3)正确理解物质的分类标准
①能与酸反应的氧化物一定是碱性氧化物。( )
②氯化铵、次氯酸都属于强电解质。( )
③金属氧化物均为碱性氧化物。( )
④纯碱属于碱,硫酸氢钠、碳酸氢钠均属于酸式盐。( )
⑤已知NaH2PO2是正盐,其水溶液呈碱性,则H3PO2属于一元弱酸。( )
答案:(1)①× ②× ③√ ④√
(2)①√ ②√ ③× ④√ ⑤× ⑥√
(3)①× ②× ③× ④× ⑤√
eq \a\vs4\al()
1.熟悉常见的混合物
(1)气体混合物:空气、水煤气(CO和H2)、爆鸣气(H2和O2)、天然气(主要成分是CH4)、焦炉气(主要成分是H2和CH4)、出炉煤气、石油气、裂解气。
(2)液体混合物:氨水、氯水、王水、天然水、硬水、软水、水玻璃、福尔马林、浓硫酸、盐酸、石油、石油的各种馏分、植物油、胶体。
(3)固体混合物:大理石、碱石灰、漂白粉、煤、高分子化合物、玻璃、水泥、合金、铝热剂。
2.物质分类的“4个标准”和“4个误区”
(1)“4个标准”
①混合物与纯净物——是否由同种物质组成。
②酸性氧化物、碱性氧化物和两性氧化物——是否能与碱或酸反应且只生成盐和水。
③电解质与非电解质——水溶液中或熔融状态下能否导电的化合物。
④溶液、胶体和浊液——分散质粒子直径的大小。
(2)“4个误区”
①误认为由相同元素组成的物质一定是纯净物。
若某物质是由一种元素组成的不同单质混合而成,则该物质为混合物,如O2、O3组成的混合气体就是混合物,而由12C和14C组成的石墨是纯净物。
②误认为溶液呈酸性的物质一定是酸、溶液呈碱性的物质一定是碱,如NaHSO4、CuSO4、NH4Cl溶液呈酸性,Na2CO3、NaHCO3溶液呈碱性,但这些物质均属于盐。
③误认为金属氧化物、非金属氧化物分别与碱性氧化物、酸性氧化物相对应。
金属氧化物不一定是碱性氧化物,但碱性氧化物一定是金属氧化物。 酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
④误认为酸分子中含有几个氢原子,该酸就是几元酸。
几元酸是由一个酸分子最多能电离产生的H+数目决定的,最多能电离产生几个H+,该酸就是几元酸,如次磷酸(H3PO2)、醋酸(CH3COOH)都是一元酸。
演练一 物质的组成
1.(教材改编题)下列含有“水”的物质中属于纯净物的有________。
①水玻璃 ②氨水 ③汽水 ④氯水 ⑤重水 ⑥紫水晶 ⑦水银 ⑧溴水 ⑨硬水 ⑩软水 ⑪王水 ⑫卤水 ⑬生理盐水 ⑭水煤气 ⑮石灰水 ⑯油水 ⑰矿泉水 ⑱蒸馏水 ⑲水泥 ⑳钢水
答案:⑤⑦⑱
2.(2020·浙江7月选考)下列物质对应的组成不正确的是( )
A.干冰:CO2
B.熟石灰:CaSO4·2H2O
C.胆矾:CuSO4·5H2O
D.小苏打:NaHCO3
解析:选B。干冰的组成为CO2,A项正确;熟石灰的组成为Ca(OH)2,B项错误;胆矾的组成为CuSO4·5H2O,C项正确;小苏打的组成为NaHCO3,D项正确。
演练二 物质的分类
3.(2021·长春高三质检)化学与人类生产、生活密切相关,下列叙述错误的是( )
A.用地沟油制取的生物柴油和从石油中获得的柴油都属于烃类物质
B.高铁“复兴号”车厢连接的关键部位使用的聚四氟乙烯板属于高分子材料
C.“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称,丝绸的主要成分是蛋白质,属于天然高分子化合物
D.中国“天眼”用到的碳化硅是一种新型无机非金属材料
解析:选A。用地沟油制取的生物柴油属于酯类物质,从石油中获得的柴油属于烃类物质,A项错误;四氟乙烯发生加聚反应生成的聚四氟乙烯属于高分子化合物,B项正确;丝绸的主要成分是蛋白质,蛋白质属于天然高分子化合物,C项正确;碳化硅属于新型无机非金属材料,D项正确。
4.下列各组物质的分类正确的是( )
①在熔融状态下能导电的化合物为离子化合物
②电解质:明矾、冰醋酸、绿矾、纯碱
③CO2、NO2、P2O5均为酸性氧化物,Na2O、Mn2O7均为碱性氧化物
④同位素:1H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦化合物:CaCl2、NaOH、HCl、HD
A.①②⑤ B.①②⑤⑦
C.②⑤⑥⑦ D.①②③④⑤⑥⑦
解析:选A。③中NO2不是酸性氧化物,Mn2O7是酸性氧化物;④中三者不互为同位素;⑥中各分子式间通式相同均为CnH2nO2,但结构可能不相似,所以可能不互为同系物;⑦中HD为单质。
考点二 物质的性质与变化
一、物质的性质与变化
1.相关概念及相互关系
2.常见的物理变化和化学变化
(1)升华、萃取、分液、吸附、盐析、金属导电、电离、渗析等均为物理变化。
(2)脱水、蛋白质变性、同素异形体互变、熔融盐导电、电解质溶液导电等均为化学变化。
二、化学反应的分类
eq \a\vs4\al(化学反应)eq \b\lc\{(\a\vs4\al\c1(按反应物、生成物种类及数目多少分为\b\lc\{(\a\vs4\al\c1(化合反应,分解反应,置换反应,复分解反应)),按反应中有无离子参与分为\b\lc\{(\a\vs4\al\c1(离子反应,非离子反应)),按反应中有无电子转移分为\b\lc\{(\a\vs4\al\c1(氧化还原反应,非氧化还原反应)),按反应进行的程度和方向分为\b\lc\{(\a\vs4\al\c1(可逆反应,不可逆反应)),按反应的能量变化分为\b\lc\{(\a\vs4\al\c1(吸热反应,放热反应))))
三、常见无机物之间的转化关系
1.判断正误(正确的打“√”,错误的打“×”)。
(1)核裂变、核聚变均有新物质生成,均属于化学变化。( )
(2)煤的气化、液化和干馏都是物理变化。( )
(3)分馏、蒸馏、蒸发、萃取、分液、过滤都属于物理变化。( )
(4)加热NH4Cl晶体,固体从试管底部移动到上部属于物理变化。( )
(5)向蛋白质溶液中滴加CuSO4溶液产生沉淀属于化学变化。( )
(6)向蛋白质溶液中滴加Na2SO4浓溶液产生沉淀属于化学变化。( )
(7)Na2CO3·10H2O的风化属于化学变化,NaOH的潮解属于物理变化。( )
(8)紫色石蕊溶液中加入活性炭褪色是化学变化。( )
(9)用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化。( )
(10)用铂丝蘸取Na2SO4、Na2CO3、NaCl溶液进行焰色反应是化学变化。( )
(11)激光法蒸发石墨得C60发生的是化学变化。( )
(12)有化学键断裂的变化一定是化学变化。( )
答案:(1)× (2)× (3)√ (4)× (5)√ (6)×
(7)√ (8)× (9)√ (10)× (11)√ (12)×
2.下列用途体现物质物理性质的是________;体现物质化学性质的是________。
①用铝箔包装物品 ②NaHCO3作为食品工业的膨松剂
③浓氨水检验输送氯气的管道是否泄漏 ④SO2漂白纸浆 ⑤液态丙烷做制冷剂
答案:①⑤ ②③④
3.下列变化中,属于物理变化的是______________________________;
属于化学变化的是_____________________________________________。
①石油的分馏 ②煤的干馏 ③钠的焰色反应 ④碘的升华 ⑤氯化铵分解 ⑥蛋白质的变性 ⑦蛋白质的颜色反应 ⑧电解食盐水 ⑨CaCl2的潮解 ⑩冰的融化
⑪FeCl3的水解 ⑫石油的裂化、裂解 ⑬蛋白质的盐析
⑭食物的缓慢氧化 ⑮同素异形体间的转化
答案:①③④⑨⑩⑬ ②⑤⑥⑦⑧⑪⑫⑭⑮
eq \a\vs4\al()
常考易错的几种物质的变化与转化
(1)结晶水合物失去结晶水的过程属于化学变化。
(2)浓硫酸的吸水性属于物理性质,脱水性属于化学性质。
(3)煤的干馏、气化和液化,石油的裂化和裂解,蛋白质的变性均属于化学变化;石油的分馏、蛋白质的盐析、焰色反应均属于物理变化。
(4)同素异形体之间的转化属于化学变化。
(5)物质间转化的几个常见误区
①S燃烧不能直接生成SO3而是生成SO2。
②Al2O3、SiO2、Fe2O3与水不反应,不能直接转化为 Al(OH)3、H2SiO3、Fe(OH)3。
③NH3催化氧化不能直接生成NO2。
④Fe分别与Cl2、Br2反应不能生成FeCl2、FeBr2,而是生成FeCl3、FeBr3;Fe分别与S、I2反应生成FeS、FeI2;Cu与 S反应生成Cu2S。
⑤Fe与H+、Cu2+反应不能生成Fe3+,而是生成Fe2+。
演练一 物质的性质
1.(2021·四川江油中学期末)化学与社会、生活密切相关,下列解释错误的是( )
解析:选A。含Na2CO3的盐碱地可用石膏降低其碱性,是因为CaSO4可将Na2CO3转化为难溶于水的CaCO3,A不正确;二氧化硫具有漂白性,可将纸浆漂白,B正确;油脂在碱性条件下的水解叫皂化反应,C正确;NaHCO3受热易分解产生二氧化碳,二氧化碳可以使食品变得松软、多孔,故NaHCO3常用于焙制糕点的发酵粉,D正确。
2.(2020·高考全国卷Ⅰ,7,6分)国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是( )
A.CH3CH2OH能与水互溶
B.NaClO通过氧化灭活病毒
C.过氧乙酸相对分子质量为76
D.氯仿的化学名称是四氯化碳
解析:选D。乙醇易溶于水,能与水以任意比例互溶,A项正确;次氯酸钠具有强氧化性,能通过氧化灭活病毒,B项正确;由过氧乙酸的结构简式(CH3COOOH)可知其相对分子质量为76,C项正确;氯仿的化学式为CHCl3,化学名称是三氯甲烷,D项错误。
演练二 物质的变化
3.(2020·高考江苏卷)下列选项所示的物质间转化均能实现的是( )
A.NaCl(aq)eq \(――→,\s\up8(电解))Cl2(g)eq \(――→,\s\up8(石灰水))漂白粉(s)
B.NaCl(aq)eq \(――→,\s\up8(CO2(g)))NaHCO3(s)eq \(――→,\s\up8(加热))Na2CO3(s)
C.NaBr(aq)eq \(――→,\s\up8(Cl2(g)))Br2(aq)eq \(――→,\s\up8(NaI(aq)))I2(aq)
D.Mg(OH)2(s)eq \(――→,\s\up8(HCl(aq)))MgCl2(aq)eq \(――→,\s\up8(电解))Mg(s)
解析:选C。Cl2与石灰乳反应可制得漂白粉,A项错误;NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl,2NaHCO3 eq \(=====,\s\up8(△))Na2CO3+CO2↑+H2O,B项错误;由于氧化性Cl2>Br2>I2,则Cl2+2NaBr===2NaCl+Br2,Br2+2NaI===2NaBr+I2,C项正确;电解MgCl2溶液不能得到单质镁,要得到单质镁,需电解熔融态的MgCl2,D项错误。
4.(2021·汉中高三检测)下列诗句或谚语可能与化学现象有关,其中说法不正确的是( )
A.“水乳交融”“火上浇油”前者包含物理变化,而后者包含化学变化
B.“落汤螃蟹着红袍”肯定发生了化学变化
C.“滴水石穿,绳锯木断”不包含化学变化
D.“看似风平浪静,实则暗流涌动”形象地描述了沉淀溶解平衡的状态
解析:选C。C项,“滴水石穿”包含了CaCO3+CO2+H2O===Ca(HCO3)2的化学变化。
考点三 分散系与胶体
一、分散系
1.概念:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。
2.分类:根据分散质粒子直径的大小将分散系分为溶液、胶体和浊液,可用下图直观地表示。
二、三大分散系的比较
三、胶体的性质及应用
四、Fe(OH)3胶体的制备
化学方程式为FeCl3+3H2Oeq \(=====,\s\up8(△))Fe(OH)3(胶体)+3HCl。
判断正误(正确的打“√”,错误的打“×”)。
(1)胶体的本质特征及性质
①直径介于1~100 nm的微粒称为胶体。( )
②胶体、溶液和浊液这三种分散系的根本区别是分散质粒子直径的大小。( )
③利用丁达尔效应可以区分溶液与胶体。( )
④溶液呈电中性,胶体带电。( )
⑤雾和霾所形成的气溶胶具有丁达尔效应。( )
⑥用激光笔照射鸡蛋清溶液,侧面可观察到一条光亮的“通路”。( )
⑦稀豆浆、硅酸凝胶、氯化铁溶液均属于胶体。( )
⑧将1 mL 1 ml·L-1的FeCl3溶液滴入沸水中制备Fe(OH)3胶体,若FeCl3完全水解,则制得Fe(OH)3胶体粒子少于0.001NA个。( )
(2)胶体的应用
①明矾电离出的Al3+水解生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化。( )
②水泥厂、冶金厂用高压电作用于气溶胶以除去烟尘,利用的是电泳原理。( )
③将纳米材料分散到某液体中,用滤纸过滤的方法可以从此分散系中分离得到该纳米材料。( )
④向浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体。( )
答案:(1)①× ②√ ③√ ④× ⑤√ ⑥√ ⑦× ⑧√ (2)①√ ②√ ③× ④×
演练一 胶体的性质及应用
1.下列事实与胶体性质无关的是( )
A.土壤中离子的吸附和交换过程,有保肥作用
B.将植物油倒入水中用力搅拌形成油水混合物
C.一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的“通路”
D.向氢氧化铁胶体中滴入稀硫酸,先看到生成红褐色沉淀而后沉淀溶解
解析:选B。A项利用土壤胶粒的吸附作用;B项形成乳浊液,与胶体无关;C项为丁达尔效应;D项先是Fe(OH)3胶体聚沉,而后Fe(OH)3沉淀溶于稀硫酸。
2.磁流体是电子材料的新秀,它是由直径为纳米量级(1~10 nm之间)的磁性固体颗粒、基载液以及界面活性剂三者混合而成的分散系,既具有固体的磁性,又具有液体的流动性。下列关于纳米Fe3O4磁流体的说法中不正确的是( )
A.纳米Fe3O4磁流体分散系属于溶液
B.纳米Fe3O4磁流体可以通过半透膜得到提纯
C.当一束可见光通过该磁流体时会出现光亮的“通路”
D.纳米Fe3O4磁流体比较稳定
解析:选A。根据题意磁流体分散系分散质粒子直径在1~10 nm之间,属于胶体的范畴,具备胶体的性质。
3.关于胶体的性质与应用,下列相关说法错误的是( )
A.静电除尘器除去空气或工厂废气中的飘尘是利用胶体粒子的带电性
B.氯化铁净水是利用胶体的吸附性
C.从颜色上无法区别FeCl3溶液和Fe(OH)3胶体
D.由于胶粒之间的排斥作用,胶粒不易聚集成大的颗粒,所以胶体的性质相对比较稳定
解析:选C。FeCl3溶液呈棕黄色,Fe(OH)3胶体呈红褐色,二者颜色不同,可从颜色上区别二者。
eq \a\vs4\al()
净水剂及其作用原理
胶体粒子的直径一般在1~100 nm之间,它决定了胶体粒子具有较大的比表面积,吸附力很强,能吸附水中的悬浮固体或毒素形成沉淀,从而达到净化水的目的。能在水中自然形成胶体,并且对水质无明显副作用的物质有KAl(SO4)2·12H2O、FeCl3·6H2O等,这样的物质被称为净水剂,其形成胶体的化学原理是Al3+、Fe3+发生水解反应生成Al(OH)3胶体、Fe(OH)3胶体。
演练二 胶体的制备与性质
4.(2021·天津高三联考)500 mL 2 ml·L-1 FeCl3溶液和500 mL 2 ml·L-1明矾溶液分别滴入沸水中,加热制成甲、乙两种分散系,经测定,甲分散系中分散质的粒子直径大小在1~100 nm之间,乙分散系中分散质的粒子直径大小在10-9~10-7 m之间。下列关于甲、乙分散系的判断合理的是( )
A.在暗室里用一束明亮的强光照射甲、乙,发现甲有丁达尔效应,乙没有丁达尔效应
B.向甲、乙中分别滴加过量的氢氧化钠溶液,现象都是“先沉淀,后溶解”
C.向甲、乙中分别滴加过量的氢碘酸,最终现象分别是深褐色溶液、无色溶液
D.蒸干、灼烧FeCl3溶液和明矾溶液会得到对应的固体盐
解析:选C。由题意可知,甲、乙分散系都是胶体,A项错误;氢氧化铝溶于氢氧化钠溶液,而氢氧化铁不溶于氢氧化钠溶液,B项错误;FeCl3中的Fe3+能氧化I-生成I2,I2溶于水呈深褐色,C项正确;蒸干、灼烧氯化铁溶液得到氧化铁,蒸干、灼烧明矾溶液得到KAl(SO4)2,D项错误。
5.某化学兴趣小组的同学按照下面的实验方法制备氢氧化铁胶体:首先取少量蒸馏水于洁净的烧杯中,用酒精灯加热至沸腾,向烧杯中逐滴滴加饱和FeCl3溶液,继续煮沸至液体呈透明的红褐色。反应原理为FeCl3+3H2Oeq \(=====,\s\up8(△))Fe(OH)3(胶体)+3HCl。
(1)判断胶体的制备是否成功,可利用胶体的________________________。
(2)在做制备氢氧化铁胶体的实验时,有些同学没有按要求进行,结果没有观察到胶体,请你预测其现象并分析原因:
①甲同学没有选用饱和氯化铁溶液,而是将稀氯化铁溶液滴入沸水中,结果没有观察到______________________,其原因是________________________。
②乙同学在实验中没有使用蒸馏水,而是用自来水,结果会______________,原因是____________________________________。
③丙同学向沸水中滴加饱和氯化铁溶液后,长时间加热,结果会______________,原因是________________________________。
(3)丁同学按要求制备了Fe(OH)3胶体,但是他又向Fe(OH)3 胶体中逐滴加入了稀H2SO4溶液,结果出现了一系列变化。
①先出现红褐色沉淀,原因是____________________________________。
②随后沉淀溶解,此反应的离子方程式为__________________________。
答案:(1)丁达尔效应
(2)①红褐色液体 FeCl3溶液太稀,生成的Fe(OH)3太少 ②生成红褐色沉淀 自来水中含有电解质,胶体发生聚沉 ③生成红褐色沉淀 长时间加热使胶体发生聚沉
(3)①电解质H2SO4使Fe(OH)3胶体聚沉
②Fe(OH)3+3H+===Fe3++3H2O纯净物
混合物
有固定的组成和结构
无固定的组成和结构
有固定的熔、沸点
无固定的熔、沸点
保持一种物质的性质
保持原有物质各自的性质
物理变化
化学变化
三馏
分馏、蒸馏
干馏
四色
焰色反应
显色反应、颜色反应、指示剂变色反应
五解
潮解
分解、电解、水解、裂解
十八化
熔化、汽化、液化、升华
氢化、氧化、水化、风化、炭化、钝化、煤的气化、煤的液化、皂化、歧化、卤化、硝化、酯化、裂化
选项
实际应用
原理解释
A
含Na2CO3的盐碱地可用石膏降低其碱性
CaSO4具有酸性
B
二氧化硫用于纸的增白
二氧化硫具有漂白性
C
不可食用的“地沟油”可用于制肥皂
油脂在碱性条件下可水解
D
小苏打用于焙制糕点的发酵粉
NaHCO3受热易分解产生气体
分散系
溶液
胶体
浊液
分散质粒子
单个小分子或离子
大分子或离子集合体
巨大分子或离子集合体
分散质粒子直径
小于1 nm
1~100 nm
大于
100 nm
性
质
外观
均一、透明
均一
不均一、不透明
稳定性
稳定
较稳定
不稳定
能否透过滤纸
能
能
不能
能否透过半透膜
能
不能
不能
鉴别
无丁达尔效应
有丁达尔效应
静置,分层或有沉淀
分类
饱和溶液、不饱和溶液
固溶胶、液溶胶、气溶胶
悬浊液、乳浊液
实例
食盐水、蔗糖溶液
Fe(OH)3胶体
泥水、油水
相关学案
这是一份高考化学一轮复习第二章化学物质及其变化第一讲物质的组成性质和分类学案新人教版,共21页。
这是一份高考化学一轮复习第二章化学物质及其变化第一讲物质的组成性质和分类学案,文件包含湖南师大附中数学附中3次pdf、湖南师大附中数学答案附中3次pdf等2份试卷配套教学资源,其中试卷共14页, 欢迎下载使用。
这是一份新高考2022版高考化学总复习专题二化学物质及其变化第1讲物质的组成分类和性质教案学案,共23页。学案主要包含了物质的组成,物质的性质与变化,分散系等内容,欢迎下载使用。










