





高中化学人教版 (2019)必修 第一册第二节 金属材料课堂教学课件ppt
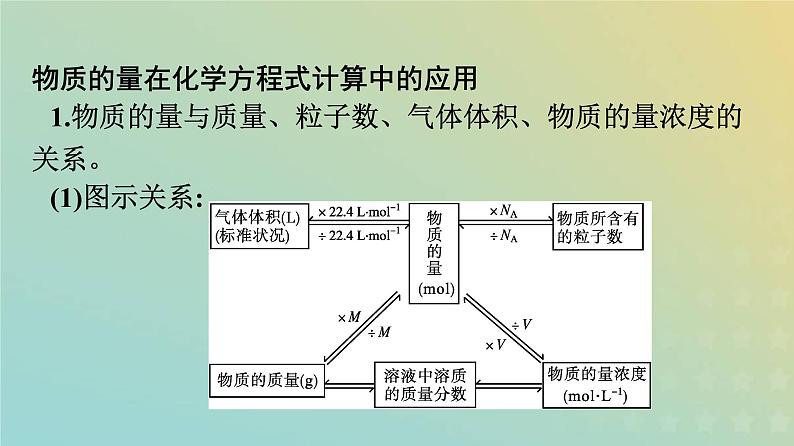
展开物质的量在化学方程式计算中的应用1.物质的量与质量、粒子数、气体体积、物质的量浓度的关系。(1)图示关系:
④已知溶液中的物质的量浓度: n(B)=c(B)·V[B(aq)] 。
2.化学方程式是表示物质间发生化学反应的式子,它必须遵循 质量 守恒定律。在化学方程式中,可反映出物质的质量关系、粒子数目关系、物质的量关系等。
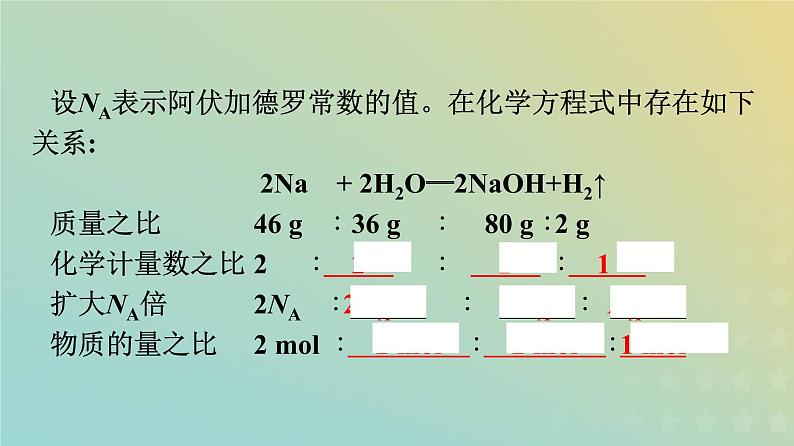
设NA表示阿伏加德罗常数的值。在化学方程式中存在如下关系: 2Na + 2H2O══2NaOH+H2↑质量之比46 g ∶ 36 g ∶ 80 g ∶2 g化学计量数之比2 ∶ 2 ∶ 2 ∶ 1 扩大NA倍2NA ∶2NA ∶ 2NA ∶ NA 物质的量之比2 ml ∶ 2 ml ∶ 2 ml ∶1 ml
结论:化学方程式中各物质的化学计量数之比,等于 粒子数目 之比,等于 物质的量 之比,在同一条件下也等于 气体体积 之比。
微训练1.物质在发生化学反应时( )。A.它们的质量一定相等B.它们的物质的量一定相等C.它们的质量之比等于方程式中化学计量数之比D.它们的物质的量之比等于方程式中化学计量数之比答案:D解析:化学方程式中各物质的化学计量数之比等于其物质的量之比。
2.标准状况下,3.25 g锌与足量的盐酸反应生成x L氢气,下列比例式正确的是( )。A.Zn+2HCl══ZnCl2+H2↑B.Zn+2HCl══ZnCl2+H2↑ 1 ml 1 ml 65 g 1 L 3.25 g x L 3.25 g x LC.Zn+2HCl══ZnCl2+H2↑D.Zn+2HCl══ZnCl2+H2↑ 1 ml 22.4 L 65 g 1 ml 0.05 ml x L 3.25 g x L
答案:C解析:根据化学方程式计算时,已知物理量和待求物理量要保证上下单位相同,左右单位相互对应。
3.若18 g某金属与足量盐酸充分反应,生成2 g H2,则该金属是( )。 A.AlD.Zn答案:A4.12 g镁完全燃烧生成氧化镁,消耗氧气的物质的量是 ,生成氧化镁的质量是 。 答案:0.25 ml 20 g
应用化学方程式计算的步骤、方法重难归纳物质的量应用于化学方程式计算的依据是参加反应的各物质的物质的量之比等于化学方程式中各物质的化学计量数之比。物质的量又可将物质的质量、物质的量浓度、气体体积联系起来融入计算之中。
2.注意事项。(1)在计算过程中应注意表达格式的规范化:各物理量、物质的名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。(2)单位运用对应化:一般来说,在一个题目中如果都用统一的物理量,不会出现错误,但如果题目所给的物理量不同,若换算成同一个物理量,有时显得烦琐,这时只要做到不同物理量“上下一致,左右对应”即可。
(1)你同意哪位同学的说法?(2)观察下面的化学方程式及各物质对应的物理量,思考并回答相关问题。2Na + 2H2O══2NaOH + H2↑2×23 g2 ml 2 ml 22.4 Lm(Na)n(H2O) n(NaOH) V(H2)
①以上计算过程正确吗?②上述反应是在常温常压下进行的吗?说明你的判断理由。提示:(1)甲。若题目所给物质的物理量不同,这时只要做到各个物理量“上下一致,左右相当”即可。(2)①正确。同一种物质用不同的物理量表示时,计算时“上下”列式的比例是相同的。②不是。因为在计算中1 ml氢气的体积是22.4 L,说明一定不是在常温常压下进行的。
典例剖析【例1】 把铁和铝的混合物1.1 g溶于200 mL 5 ml·L-1盐酸中,反应后盐酸的浓度变为4.6 ml·L-1(溶液体积变化忽略不计)。求:(1)反应中消耗HCl的物质的量;(2)该混合物中铝、铁的物质的量。答案:(1)消耗HCl的物质的量为0.08 ml。(2)铝的物质的量为0.02 ml,铁的物质的量为0.01 ml。
解析:(1)消耗HCl的物质的量为0.2 L×5 ml·L-1-0.2 L×4.6 ml·L-1=0.08 ml。(2)设Al、Fe的物质的量分别为x、y。2Al + 6HCl═2AlCl3+3H2↑,2 ml 6 ml x 3xFe + 2HCl═FeCl2+H2↑1 ml 2 mly 2y
【例2】 将4.6 g Na和2.7 g Al同时加入足量的水中充分反应,将反应后的溶液稀释至500 mL。下列说法中正确的是( )。A.反应中放出的气体在标准状况下的体积为2.24 LB.参加反应的水的质量与加入Al的质量相等C.所得溶液中Na+和Al3+的物质的量之比为2∶1D.所得溶液中阳离子和阴离子的物质的量之比为1∶1答案:D
解析:Na与Al两种金属加入足量水中,首先Na与H2O反应生成H2和NaOH,然后再发生Al与NaOH溶液的反应,根据反应的化学方程式可得:2Na + 2H2O══2NaOH + H2↑46 g 36 g 2 ml 1 ml4.6 g 3.6 g 0.2 ml 0.1 ml
金属铝与生成的NaOH溶液反应时,NaOH过量,故按照Al的量进行计算:2Al + 2NaOH + 2H2O══2NaAlO2+3H2↑ 54 g 2 ml 36 g 2 ml 3 ml 2.7 g 0.1 ml 1.8 g 0.1 ml 0.15 ml
方法规律 判断反应物过量的方法。(1)假设法。假设一种反应物完全反应,而另一种反应物的量未知,把所求得的结果与实际量相比较,若小于实际值,则说明假设成立,反之则说明假设不成立,即该反应物过量。
学以致用1.将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中Fe3+和Fe2+的物质的量浓度相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )。A.2∶3B.3∶2C.1∶2D.1∶1
答案:A解析:设参加反应的Fe3+物质的量为x,未参加反应的Fe3+的物质的量为y,由反应的化学方程式:2FeCl3+Fe═3FeCl2可
2.0.3 ml氯气和足量的金属M反应,生成0.2 ml MCln,则n等于( )。A.1B.2C.3D.4答案:C解析:根据氯原子守恒,可知0.3 ml Cl2和0.2 ml MCln均含0.6 ml Cl。
3.向500 mL NaOH溶液中投入10.8 g Al,两者恰好完全反应,计算:(1)Al的物质的量;(2)参加反应的NaOH的物质的量和NaOH溶液中NaOH的物质的量浓度;(3)生成的H2在标准状况下的体积。
答:(1)Al的物质的量为0.4 ml。(2)参加反应的NaOH的物质的量为0.4 ml,NaOH的物质的量浓度为0.8 ml·L-1。(3)生成的H2在标准状况下的体积为13.44 L。
1.对于反应aA+bB══cC+dD(A、B、C、D表示物质的化学式,a、b、c、d为化学方程式中的化学计量数),下列说法不正确的是( )。A.如果质量为m1的A与质量为m2的B恰好完全反应,则生成的C、D的质量之和一定等于(m1+m2)B.参加反应的A和B中的原子总数一定等于生成的C和D的原子总数C.(a+b)不一定等于(c+d)D.A和B中的元素种类,不一定等于C和D中的元素种类
答案:D解析:化学反应遵循质量守恒,即化学反应中元素种类守恒、原子个数守恒,D项错误。
2.铁粉在高温下可与水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )。A.0.5 mlB.1 mlC.1.5 mlD.2 ml
3.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液的浓度为( )。A.1.0 ml·L-1B.2.0 ml·L-1C.1.5 ml·L-1D.3.0 ml·L-1
答案:B解析:2Al+2NaOH+2H2O═2NaAlO2+3H2↑2 ml 67.2 Ln(NaOH) 33.6 L
4.某金属R的氯化物溶液20 mL,浓度为0.05 ml·L-1。它恰好能与20 mL 0.15 ml·L-1 AgNO3溶液完全反应,则该氯化物的化学式为( )。A.RClB.RCl2C.RCl3D.RCl5
答案:C解析:可设该氯化物的化学式为RClx,n(RClx)=0.02 L×0.05 ml·L-1=0.001 ml,n(AgNO3)=0.02 L×0.15 ml·L-1=0.003 ml。RClx + xAgNO3═xAgCl↓+R(NO3)x 1 x 0.001 ml0.003 ml
5.把足量的铁粉投入H2SO4和CuSO4的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与 的物质的量浓度之比为( )。A.1∶4B.2∶7C.1∶2D.3∶8答案:A
解析:设原溶液中H2SO4和CuSO4的物质的量分别为x、y。Fe +H2SO4═FeSO4+H2↑ Δm(固体质量减小)56 g 1 ml 56 gx 56xFe + CuSO4═FeSO4+Cu Δm(固体质量增大)56 g 1 ml 64 g 8 gy 8y
6.在标准状况下进行甲、乙、丙三组实验。三组实验各取30 mL同浓度的盐酸,加入同一种镁铝混合物粉末,产生气体,有关数据列表如下:
(1)甲、乙两组实验中,哪一组盐酸是不足量的? (填“甲”或“乙”)。理由是 。 (2)要算出盐酸中HCl的物质的量浓度,题中可作为计算依据的数据是 ,求得盐酸中HCl的物质的量浓度为 。 (3)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是 ,求得Mg、Al的物质的量之比为 。
答案:(1)乙 因甲、乙生成H2的体积不等,则产生H2体积小的,说明还有酸未反应,因此甲中盐酸过量,混合物反应完全;若乙中盐酸过量,则可产生H2的体积V(H2)= ×280 mL≈423 mL,而实际为336 mL,说明乙中盐酸不足,金属过量(2)336 mL 1 ml·L-1(3)255 mg和280 mL 1∶1
解析:(2)由表中数据可知,丙中盐酸反应完全,则可根据2HCl ~ H22 1
化学必修 第一册第二节 金属材料教课ppt课件: 这是一份化学必修 第一册第二节 金属材料教课ppt课件,共35页。PPT课件主要包含了第二节金属材料,粒子个数,物质的量,随堂演练•知识落实等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 金属材料教课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料教课课件ppt,共35页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料图片ppt课件: 这是一份人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料图片ppt课件,共29页。PPT课件主要包含了自主预习·悟新知,各物质的粒子数,各物质的物质的量,微点拨,合作探究·提素养,守恒法,随堂检测·精评价等内容,欢迎下载使用。













