



高中化学第三节 氧化还原反应课前预习课件ppt
展开
这是一份高中化学第三节 氧化还原反应课前预习课件ppt,共52页。
一、氧化剂和还原剂1.基本概念。(1)氧化剂和还原剂。氧化剂:在反应中,所含元素的化合价 降低 ,即 得到 电子(或电子对 偏向 )的反应物。 还原剂:在反应中,所含元素的化合价 升高 ,即 失去 电子(或电子对 偏离 )的反应物。
(2)氧化产物和还原产物。氧化产物:在反应中,还原剂 失去 电子、被 氧化 后所得到的生成物; 还原产物:在反应中,氧化剂 得到 电子、被 还原 后所得到的生成物。
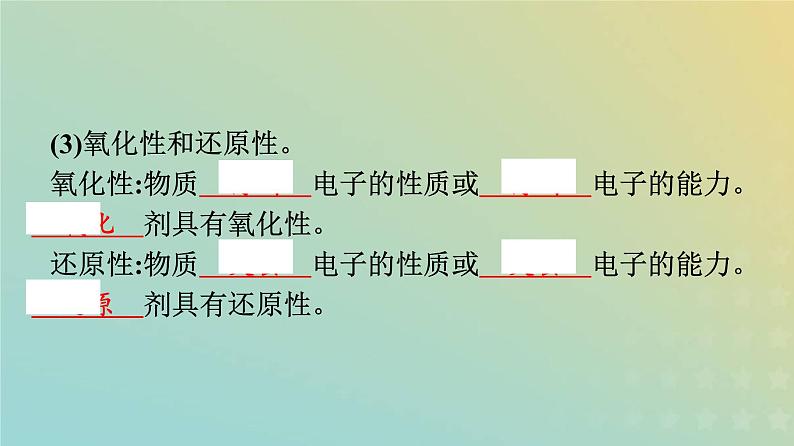
(3)氧化性和还原性。氧化性:物质 得到 电子的性质或 得到 电子的能力。 氧化 剂具有氧化性。 还原性:物质 失去 电子的性质或 失去 电子的能力。 还原 剂具有还原性。
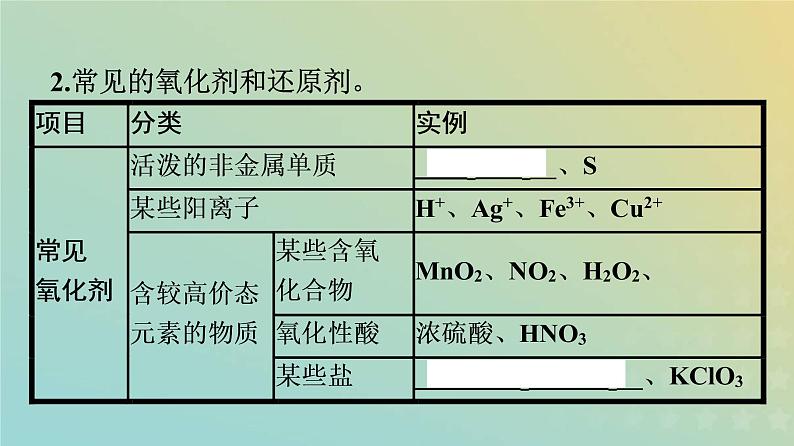
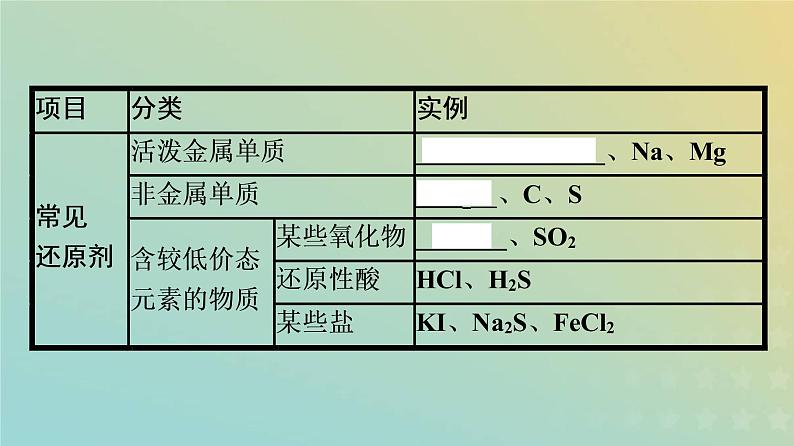
2.常见的氧化剂和还原剂。
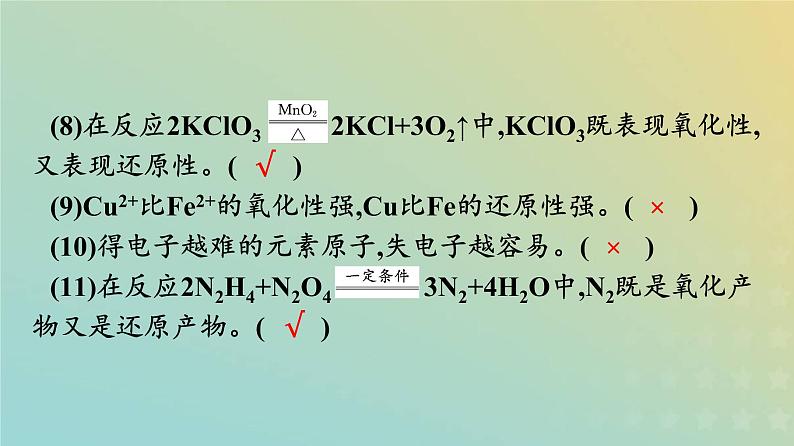
微判断(1)氧化剂得电子被氧化为还原产物。( )(2)金属单质在反应中只做还原剂。( )(3)非金属单质在反应中只做氧化剂。( )(4)还原剂失去电子,具有氧化性。( )(5)氧化还原反应中,氧化剂发生氧化反应。( )(6)还原剂失电子的能力越强,其还原性越强。( )(7)金属原子失电子越多,其对应单质的还原性越强。( )
二、氧化还原反应的应用氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。填写下列空白:
我们研究氧化还原反应,是为了掌握其中的规律,尽可能做到趋利避害,使之更好地为社会的发展服务。
一 氧化还原反应的基本概念重难归纳1.概念间的关系图。
2.概念分析的方法。
新切开的苹果切面的颜色会逐渐变深,有一种解释说是新切开的苹果中含有的Fe2+与空气中的氧气接触而被氧化所致。苹果汁是人们喜欢的饮料,现榨的苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生。(1)苹果汁在空气中由淡绿色变为棕黄色的过程中,氧化剂和还原剂分别是什么物质?
(2)若榨汁时加入维生素C,可有效防止现榨的苹果汁在空气中由淡绿色变为棕黄色,这说明维生素C具有氧化性还是还原性?(3)在氧化还原反应中,氧化剂只有氧化性,还原剂只有还原性吗?具有氧化性的物质与具有还原性的物质之间一定可以发生氧化还原反应吗?
提示:(1)氧气是氧化剂,Fe2+是还原剂。(2)说明维生素C具有还原性,且维生素C的还原性比Fe2+的还原性强。(3)氧化剂具有氧化性,还原剂具有还原性;但在一些氧化还原反应中,氧化剂和还原剂可能是同一种物质,则该物质既有氧化性也有还原性。具有氧化性的物质与具有还原性的物质也不一定能发生氧化还原反应,如Cu具有还原性,HCl中的H+具有氧化性,但Cu与HCl不能发生反应。
典例剖析氢化钙可作为生氢剂,与水可发生反应,反应的化学方程式为CaH2+2H2O══Ca(OH)2+2H2↑。下列说法错误的是( )。A.CaH2既是氧化剂,又是还原剂B.H2既是氧化产物,又是还原产物C.CaH2是还原剂,H2O是氧化剂D.氧化产物与还原产物的质量比为1∶1答案:A
解析:分析反应:由反应前后元素的化合价变化可知,CaH2是还原剂,H2O是氧化剂,H2既是氧化产物又是还原产物,且H2中来源于CaH2中的氢原子的个数和来源于H2O中的氢原子的个数相等,即氧化产物与还原产物的质量比为1∶1。
学以致用1.银与空气中的硫化物反应,生成黑色的硫化银。变黑的原理是4Ag+2H2S+O2══2Ag2S+2H2O,其中H2S是( )。A.氧化剂 B.还原剂C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂答案:D解析:题述反应中,H2S中的氢元素和硫元素的化合价均未发生改变,故H2S既不是氧化剂也不是还原剂。
2.亚硝酸(HNO2)在反应中既可做氧化剂,又可做还原剂。当它做还原剂时,其氧化产物可能是( )。A.NH3B.N2C.NO2D.NO答案:C解析:当它做还原剂时,HNO2中N元素的化合价升高,判断选项中N元素的化合价大于+3价即可。A项,NH3中N元素的化合价为-3价,A项不符合题意;B项,N2中N元素的化合价为0价,B项不符合题意;C项,NO2中,N元素的化合价为+4价,C项符合题意;D项,NO中N元素的化合价为+2价,D项不符合题意。
二 氧化性、还原性及其强弱的比较重难归纳1.对氧化性、还原性的理解。(1)氧化性(还原性)是指物质得电子(失电子)的性质或能力,物质的氧化性(还原性)强,指的是该物质容易得到(失去)电子,与得(失)电子数的多少无关。例如:1个Na原子能失去1个电子变成Na+,1个Al原子能失去3个电子变成Al3+,但是Na比Al活泼得多,Na更容易失去电子,因此Na比Al的还原性强。
(2)氧化性、还原性与元素化合价的关系:最高价 ——只有氧化性↓↑中间价态——既具有氧化性,又具有还原性↓↑最低价 ——只有还原性对于同一元素而言,一般价态越高,氧化性越强,价态越低,氧化性越弱。如氧化性Fe3+>Fe2+,SAl。
(1)葡萄酒中加入的SO2有什么作用?说明SO2具有什么性质?焦亚硫酸钾(K2S2O5)中硫元素的化合价是多少?抗氧化剂的实质是什么?(2)物质的氧化性越强,得电子数目越多;物质的还原性越强,失电子数目越多,这种说法对吗?请举例说明原因。
提示:(1)加入SO2是防止葡萄酒的某些成分在储存的过程中被氧气氧化而使葡萄酒的口感变差,故SO2是还原剂,具有还原性。K2S2O5中硫元素是+4价,抗氧化剂实质上就是还原剂。(2)不对。因为氧化性实质是物质得到电子的性质,还原性实质是物质失去电子的性质,氧化性和还原性的强弱取决于物质得失电子的难易程度,与得失电子的数目多少无关。如Mg、Al与盐酸反应时,一个金属原子失去的电子数分别是2、3,但是还原性Mg>Al。
典例剖析金属钛具有许多优异的性能,是航空、军工、电力等领域的必需材料。金红石[主要成分为二氧化钛(TiO2)]是地壳中钛矿石中的一种。目前,大规模生产钛的方法如下:第一步,让金红石、碳单质在高温下与氯气反应,制得四氯化钛(TiCl4);第二步,在氩气氛围中加热,使金属镁与四氯化钛反应制得金属钛。
(1)写出制备金属钛的两步反应的化学方程式: , ,第一步化学反应中的氧化剂是 。 (2)Cl2、TiCl4和Ti三种物质的氧化性从强到弱的顺序为 。
学以致用1.下列叙述正确的是( )。A.阳离子只有氧化性,阴离子只有还原性B.含氧酸可做氧化剂,而无氧酸不能C.在8NH3+3Cl2══N2+6NH4Cl反应中,氧化剂与还原剂的分子数之比是2∶3D.已知还原性:Fe2+>Br-,可知反应2Fe3++2Br-══2Fe2++Br2不易进行
答案:D解析:Fe2+既有氧化性,又有还原性,A项错误。酸均具有氧化性,B项错误。C中的氧化剂是氯气,还原剂是氨气,两者的分子数之比是3∶2,错误。氧化还原反应中,还原剂的还原性必须强于还原产物的还原性,D项正确。
2.一定条件下,KClO3与I2可发生反应:2KClO3+I2═2KIO3 +Cl2↑,下列推断正确的是( )。A.该反应属于复分解反应B.氧化性:I2>KClO3C.还原性:KClO3>I2D.还原剂为I2,氧化剂为KClO3
答案:D解析:该反应属于置换反应,A项错误。
氧化剂 还原剂 氧化产物 还原产物氧化性:KClO3>KIO3,KClO3>I2;还原性:I2>Cl2,I2>KClO3,故D项正确。
1.下列反应中,CO2是氧化剂的是( )。
答案:B解析:若CO2在反应中是氧化剂,则其所含碳元素的化合价降低。A项,CO2中碳元素的化合价无变化;B项,CO2中碳元素的化合价由+4价降低为+2价;C、D两项中,CO2均为氧化产物。故B项符合题意。
2.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应中水的作用与Br2+SO2+2H2O══H2SO4+2HBr中水的作用不相同的是( )。A.3NO2+H2O══2HNO3+NOB.4Fe(OH)2+O2+2H2O══4Fe(OH)3C.Cl2+H2O══HCl+HClOD.2Al+2NaOH+2H2O══2NaAlO2+3H2↑
答案:D解析:在反应Br2+SO2+2H2O══H2SO4+2HBr中,水既非氧化剂又非还原剂。A、B、C项中水既非氧化剂又非还原剂;D项中水是氧化剂。
3.高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,已知它的氧化性强于KMnO4,在反应中被还原为Fe3+,将它溶入浑浊的泥水中,既能起杀菌消毒作用,又能使泥沙沉降。制取高铁酸钠的化学方程式为2Fe(NO3)3+16NaOH+3Cl2 ══2Na2FeO4+6NaNO3+6NaCl+8H2O。该反应中的氧化剂和氧化产物分别为( )。A.Fe(NO3)3 NaOHB.NaOH Cl2C.Fe(NO3)3 Na2FeO4D.Cl2 Na2FeO4
答案:D解析:反应物中,Cl2中Cl元素的价态是0价,而在生成物NaCl中Cl元素的价态是-1价(化合价降低),因此,Cl2是氧化剂;Fe(NO3)3中Fe元素由+3价升高到+6价(Na2FeO4),Na2FeO4是Fe(NO3)3被氧化以后的产物,即氧化产物。
4.下列变化中,加入还原剂才能实现的是( )。A.Na2O→NaOHB.H2SO4→H2C.CuO→CuSO4D.SO2→SO3答案:B解析:加入还原剂才能实现,说明发生的变化应为还原反应,故应找有元素化合价降低的过程。A、C项中元素的化合价无变化;B项中,H元素的化合价降低;D项中,S元素的化合价升高。故B项符合题意。
5.根据反应:O2+2H2S══2S↓+2H2O,Na2S+I2══2NaI+S↓, 4NaI+O2+2H2SO4══2I2+2Na2SO4+2H2O,判断下列物质的氧化性强弱,正确的是( )。A.O2>I2>SB.H2S>NaI>H2OC.S>I2>O2D.H2O>NaI>H2S
答案:A解析:依据同一反应中,氧化剂的氧化性强于氧化产物的氧化性进行判断。在第一个反应中,O2是氧化剂,S是氧化产物,所以氧化性O2>S;在第二个反应中,I2是氧化剂,S是氧化产物,所以氧化性I2>S;在第三个反应中,O2是氧化剂,I2是氧化产物,所以氧化性O2>I2。综上分析可得氧化性O2>I2>S,A项正确。
6.(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是 ,其中氧化性强的是 。 (2)氧化还原反应在工农业生产、日常生活中都有广泛的用途。如人通过呼吸作用提供能量以维持生命活动。已知人呼吸作用涉及的反应为C6H12O6+6O2→6CO2+6H2O。在该反应中,做还原剂的是 。
(3)有些氧化还原反应却有危害。例如:钢铁的腐蚀、食物的腐败等。因此,要想方设法阻碍此类氧化还原反应的发生。①为防止一些食品在空气中氧化变质,延长其保质期,罐头、火腿肠、果汁等都会添加一些防腐剂。从氧化还原反应的角度看,防腐剂具有 性。 ②在氧化还原反应中,氧化和还原、氧化剂和还原剂总是同时存在的。根据这一知识,如何有效避免有危害的氧化还原反应的发生(可通过实例说明): 。
答案:(1)Cl2、H+ Cl2(2)C6H12O6(3)①还原 ②钢铁用具(或其他物品)表面涂上油漆(或其他物品),避免其与氧气接触,可起到防止锈蚀的效果(合理即可)。
解析:(1)Cl-中氯元素处于最低价态,只表现还原性;H+中氢元素处于最高价态,只表现氧化性;Cl2中氯元素处于中间价态,且Cl2是常见的强氧化剂,所以具有氧化性的是Cl2和H+;又由于铁在氯气中反应得到FeCl3,Fe3+的价态为+3价,而铁与盐酸反应生成FeCl2,Fe2+的价态为+2价,则Cl2的氧化性强于H+的氧化性。(2)人的呼吸作用是通过氧气将C6H12O6氧化,靠反应释放的能量来维持生命活动,所以还原剂是C6H12O6。
相关课件
这是一份人教版 (2019)必修 第一册第三节 氧化还原反应图片课件ppt,共35页。
这是一份高中化学第三节 氧化还原反应说课课件ppt,共35页。
这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应作业ppt课件,共36页。PPT课件主要包含了H2O2,还原剂,浓硝酸等内容,欢迎下载使用。










