





化学必修 第一册第三节 物质的量教课内容ppt课件
展开
这是一份化学必修 第一册第三节 物质的量教课内容ppt课件,共50页。PPT课件主要包含了答案C,答案B,答案A等内容,欢迎下载使用。
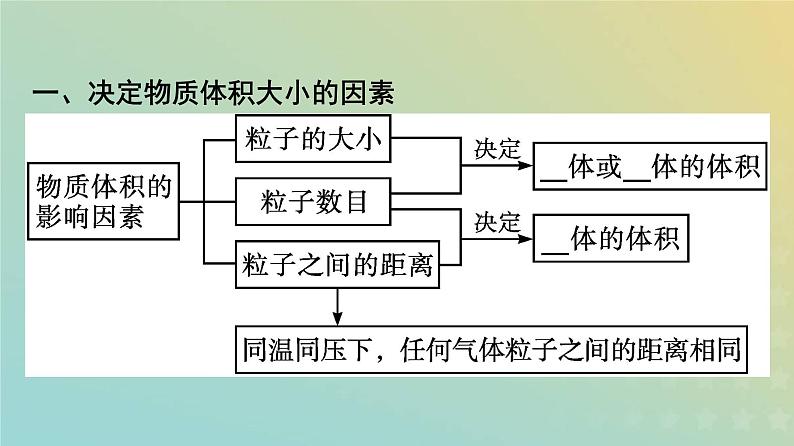
一、决定物质体积大小的因素
结论:(1)在相同条件下粒子数相同的不同固态或液态物质的体积 不相同 ; (2)在同温同压条件下,粒子数相同的任何气体的体积都 相同 。
微训练1同温同压下,1 ml H2和1 ml O2,它们的( )。A.质量相同,体积不同 B.分子数相同,质量不同C.体积相同,分子数不同D.体积相同,原子数不同答案:B解析:同温同压下,1 ml H2和1 ml O2的分子数相同,原子数相同,但质量不同。
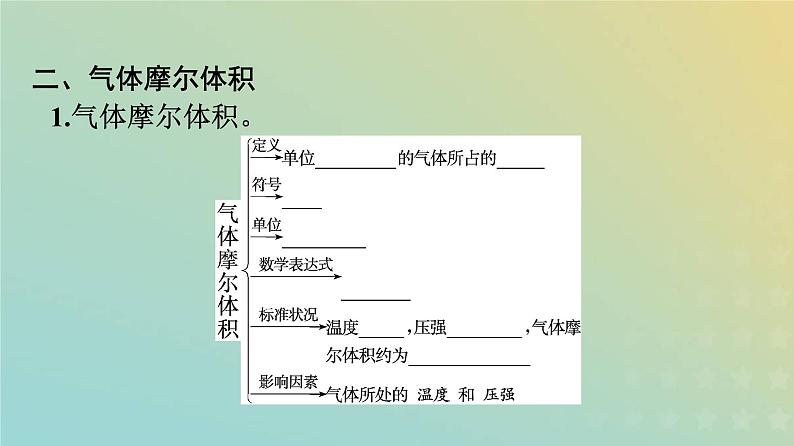
二、气体摩尔体积1.气体摩尔体积。
2.在相同的温度和压强下,相同 体积 的任何气体都含有 相同数目的粒子 。
微判断(1)设NA为阿伏加德罗常数的值。22.4 L氧气中含有NA个氧气分子。( )(2)标准状况下,气体摩尔体积约为22.4 L。( )(3)标准状况下,1 ml任何物质的体积都约为22.4 L。( )(4)在标准状况下,22.4 L H2和N2的混合气体的物质的量约为1 ml。( )(5)44 g CO2的体积约为22.4 L。( )(6)标准状况下,0.5 ml H2O的体积约为11.2 L。( )
(7)单位物质的量的气体所占的体积就是气体摩尔体积。( )(8)相同物质的量的气体的气体摩尔体积也相同。( )
微训练2下列四幅图中,小白球代表的是氢原子,大灰球代表的是氦原子。最适合表示同温同压下,等质量的氢气与氦气的混合气体的图示是( )。
一 影响物质体积大小的因素重难归纳1.粒子数目相同的物质体积关系。
2.在气体分子个数、温度、压强一定时,气体体积的大小决定于气体分子间的平均距离,与分子种类无关。如相同温度和压强下,1 ml O2和1 ml空气的体积相同,因为当温度和压强相同时,任何气体分子的间距都近似相等,所以不管1 ml单一气体还是混合气体的体积都近似相等。
同温同压下,相同质量的H2和O2所占的体积相同吗?其体积比是多少?提示:不相同。设两者质量均为1 g,同温同压下,气体的物质
典例剖析下列关于决定物质体积大小的因素的说法不正确的是( )。A.物质的体积取决于粒子数目、粒子大小和粒子间距离B.相同条件下,粒子数相同的任何气体都具有相同的体积C.同温同压下,1 ml任何物质所占有的体积均相同D.等质量的H2,压强越小、温度越高,气体所占体积越大
答案:C解析:从微观角度来说,物质的体积由粒子数目、粒子大小和粒子之间的距离决定,A项正确。相同条件下气体分子间的距离相同,故粒子数相同的气体,体积也相同,B项正确。C项结论只适用于气体,C项错误。等质量的气体,压强越小、温度越高,体积越大,D项正确。
学以致用1.同温同压下,若两种气体所占体积不同,其主要原因是( )。A.气体分子的大小不同B.气体分子间平均距离不同C.气体的物质的量不同D.气体的摩尔质量不同答案:C
2.现有下列四种因素:①温度和压强;②所含粒子数;③粒子本身大小;④粒子间的距离。其中对气态物质体积有显著影响的是( )。A.②③④B.②③C.①③④D.①②④答案:D解析:气态物质粒子之间的距离要比粒子本身的直径大很多倍,故粒子本身的大小对气态物质体积无显著影响。
二 气体摩尔体积重难归纳1.标准状况下的气体摩尔体积。
(1)1个条件:必须为标准状况。非标准状况下,1 ml气体的体积不一定是22.4 L。因此在使用气体摩尔体积时,一定要看清气体所处的状态。(2)1种状态:必须为气体。如水、酒精、CCl4等物质在标准状况下不是气体。(3)2个数据:“1 ml”“约22.4”。
2.气体摩尔体积的适用范围。气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,如0.2 ml H2与0.8 ml O2的混合气体在标准状况下的体积约为22.4 L。
典例剖析设NA代表阿伏加德罗常数,下列说法正确的是( )。A.在常温常压下,11.2 L Cl2含有的分子数为 0.5NAB.在常温常压下,1 ml氦气含有的原子数为NAC.32 g氧气含原子数为NAD.NA个O2的质量只有在标准状况下才是32 g
答案:B解析:在A中,标准状况下,11.2 L Cl2含有的分子数为0.5NA,而题中为常温常压,故A项错误。B中氦气为单原子分子,1 ml氦气含有的原子数目为NA,B项正确。C中O2的摩尔质量为32 g·ml-1 ,且O2为双原子分子,所以32 g O2含原子数为 ×2NA=2NA,C项错误。NA个O2的质量为32 g,与状态无关,与外界条件无关,D项错误。
理解感悟 在有关阿伏加德罗常数的正误判断题目中,常考查标准状况下的气体摩尔体积,常见问题如下:(1)忽视外界条件是标准状况,如常温常压下,1 ml H2的体积不是22.4 L;(2)忽视研究对象是气体,如标准状况下H2O、酒精、SO3等不是气体;(3)将1 ml气体的体积与气体摩尔体积的单位混淆,前者单位为L,后者单位为L·ml-1;(4)气体的质量或物质的量与外界条件(温度、压强)无关。
学以致用1.下列叙述正确的是( )。A.1 ml任何气体的体积都为22.4 LB.1 ml固体在标准状况下所占的体积为22.4 LC.只有在标准状况下,气体摩尔体积才约为22.4 L·ml-1D.标准状况下,22.4 L任何气体的物质的量都是1 ml
答案:D解析:A中没有指明该物质所处的条件,即温度、压强,错误;B中1 ml固体在标准状况下体积不是22.4 L,错误;C中在非标准状况下,气体的摩尔体积也可能是22.4 L·ml-1,错误;D中是对气体摩尔体积概念的应用,正确。
2.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )。A.常温常压下,11.2 L CO2所含的原子数为1.5NAB.常温常压下,48 g O3含有的氧原子数为3NAC.标准状况下,22.4 L H2O所含分子数为NAD.标准状况下,22.4 L H2所含原子数为NA
三 阿伏加德罗定律及重要推论 重难归纳1.阿伏加德罗定律。(1)内容:同温同压下,相同体积的任何气体都含有相同数目的粒子。(2)适用范围:阿伏加德罗定律及其推论适用于气体,可以是单一气体,也可以是混合气体,对固体和液体不适用。(3)“三同定一同”规律:同温、同压、同体积、同分子数中只要有“三同”,则必有“第四同”。
2.阿伏加德罗定律的推论。
④把气囊中的物质缓缓倒入锥形瓶中,让它们充分反应,直至完全。反应完全后,可以观察到什么现象?请说明原因。(忽略气体的溶解)
步骤1:连接装置并检查装置气密性。步骤2:B管用排石蜡油法收集氨气,使集气管中充满与大气压强相等的纯净氨气,关闭活塞K4、K5。步骤3:在A管中充满与大气压强相等的干燥HCl气体。操作是 。 步骤4:缓慢开启活塞K3,A管中的现象是 。 问题讨论:要达到实验目的,当反应完成并恢复到室温时,B管中预期的现象是 。
提示:(1)两个气球几乎一样大。因为两个反应生成的气体的物质的量相同,在相同条件下,占有的体积也相同。(2)步骤3:关闭活塞K3,打开活塞K1、K2,从K2处通入干燥的HCl气体,直到K1出现白色酸雾时,关闭K1、K2 步骤4:产生白烟 问题讨论:石蜡油充满B管
典例剖析在容积相同的两个密闭容器中分别充满气体O2、O3,当这两个容器内温度和压强相等时,下列说法正确的是( )。A.两种气体的物质的量不相等B.两种气体的质量相等C.两种气体所含的原子数目相等D.两种气体的分子数目相等
答案:D解析:等温等压等体积的气体具有相等的物质的量和分子数,A项错误,D项正确。因O2和O3的摩尔质量不相等,两者的质量不相等,B项错误。因O2和O3的分子组成不相同,在分子数相同的前提下,两者的原子数是不相同的,C项错误。
学以致用1.下列叙述正确的是( )。 A.同温同压下,相同体积的物质,其物质的量必然相等B.任何条件下,等物质的量的氧气和一氧化碳所含的分子数必然相等C.1 L一氧化碳气体一定比1 L氧气的质量小D.同温同压下,等体积的物质所含的分子数一定相等
答案:B解析:只有气体物质才符合阿伏加德罗定律——在同温同压下,具有相同体积的气体的物质的量相等,A、D项错误。具有相同物质的量的两种由分子构成的物质具有相同的分子数,B项正确。因温度、压强不能确定,故1 L CO和1 L O2的物质的量大小也不能确定,即两者的质量大小无法比较,C项错误。
2.如图有两瓶体积相等的气体,在同温同压下瓶内气体的关系一定正确的是( )。A.原子数相等B.密度相等C.质量相等D.摩尔质量相等
的物质的量相同,又都是双原子分子,所以原子的物质的量相同,由原子个数之比等于其物质的量之比可得两瓶内分子所含原子数相同,A项正确;两瓶内分子的物质的量相等,由m=nM,M不一定相等,故m不一定相等,同时由ρ= 也可得ρ不一定相等。
1.下列各组物质中,分子数不相同的是( )。A.同温同压下2 L SO2和2 L CO2B.标准状况下1 ml氧气和22.4 L乙醇C.9 g水和标准状况下11.2 L CO2D.0.2 ml氯气和7.3 g氯化氢气体
答案:B解析:A项,同温同压下,2 L SO2和2 L CO2的物质的量相等,含有分子数相同;B项,标准状况下乙醇不是气体,则22.4 L乙醇的物质的量不是1 ml,两者含有的分子数不同;C项,9 g水的物质的量为0.5 ml,标准状况下11.2 L CO2的物质的量为0.5 ml,两者的物质的量相等,含有的分子数相同;D项,7.3 g氯化氢的物质的量为 =0.2 ml,两者的物质的量相等,则含有的分子数相同。
2.下列说法正确的是( )。A.20 ℃、1.01×105 Pa时,同体积的O2和CO2含有相同数目的分子数B.1 ml气态物质,当体积为22.4 L时,该气体一定处于标准状况C.常温常压下,2 ml任何气体体积都约为44.8 LD.同温同压下,相同体积的任何气体单质所含分子数和原子数都相同
答案:A解析:根据阿伏加德罗定律,同温同压下,同体积的任何气体都含有相同数目的分子数,A项正确,D项错误。B项中,1 ml气态物质在非标准状况时,体积也有可能等于22.4 L。C项中,标准状况下,气体的摩尔体积才是22.4 L·ml-1。
3.标准状况下,若11.2 L氧气含有x个氧原子,则阿伏加德罗常数的数值可表示为( )。A.4xD.x答案:D
4.下列说法不正确的有( )。A.NA个氧分子与NA个氢分子的质量比等于16∶1B.标准状况下,22.4 L以任意比混合的氢气和一氧化碳混合物所含原子数为2NAC.标准状况下,0.5NA个H2O分子所占体积约为11.2 LD.16 g O2和O3的混合物中共含有NA个氧原子答案:C解析:标准状况下,H2O不是气态,C项错误。
相关课件
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量图文课件ppt,共31页。PPT课件主要包含了自主预习·悟新知,不相同,气体摩尔体积,物质的量,合作探究·提素养,任务1气体摩尔体积,情境导入,问题生成,答案没有,答案不能等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量课前预习ppt课件
这是一份人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量课文配套课件ppt,共46页。PPT课件主要包含了自主预习·新知导学,合作探究·释疑解惑,课堂小结,物质的量浓度等内容,欢迎下载使用。









