高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律第1课时学案
展开第1课时 元素性质的周期性变化规律
(含实验活动3 同周期、同主族元素性质的递变)
课程解读
课标要点
学科素养
元素周期律
1.通过元素周期律的学习,提高学生变化观念与平衡思想的素养
2.知道可以通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律
(见学生用书P74)
1.1~18号元素原子结构的变化规律
(1)元素原子最外层电子数的变化规律
由上图可得,随着原子序数的递增,元素原子最外层电子的排布呈现周期性变化,除H、He元素外,最外电子层上的电子数重复出现从__1__递增至__8__的变化。
(2)元素原子半径的变化规律
从3→9,11→17的元素中,随着原子序数的递增,元素的原子半径呈现由__大__到__小__的变化规律。
【提醒】稀有气体元素原子半径的测定依据与其他元素的不同,不与其他元素的原子半径作比较。
2.元素化合价
以第三周期元素为例
元素
钠
镁
铝
硅
磷
硫
氯
元素符号
Na
Mg
Al
Si
P
S
Cl
最外层电子数
1
2
3
4
5
6
7
最高正价
+1
+2
+3
+4
+5
+6
+7
最低负价
—
—
—
-4
-3
-2
-1
分析上表,可以得出:
(1)主族元素的最高化合价 = 原子核外__最外层电子数__(O、F除外);元素的最低化合价 =__原子核外最外层电子数-8__。
(2)随着原子序数的递增,元素的最高正化合价由__+1价__递增到__+7价__(O、F除外),元素的最低负化合价按硅、磷、硫、氯的顺序,由__-4价__递增到__-1价__。
3.元素的金属性和非金属性
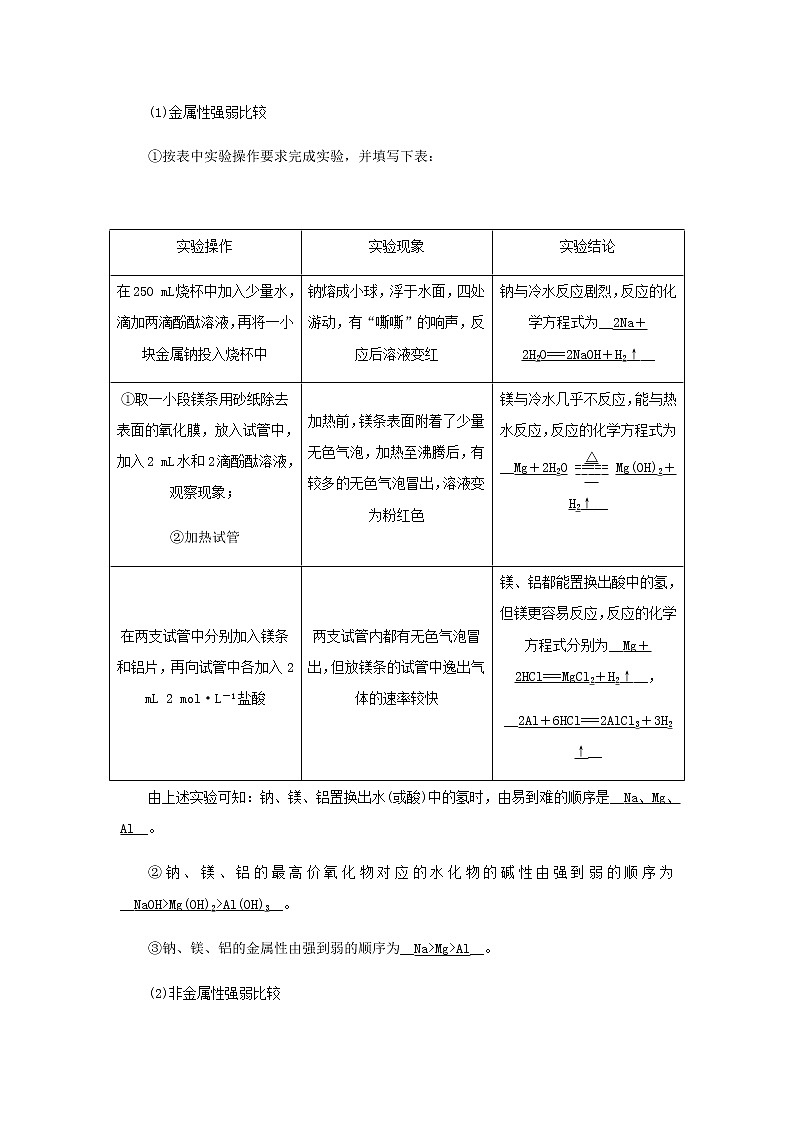
(1)金属性强弱比较
①按表中实验操作要求完成实验,并填写下表:
实验操作
实验现象
实验结论
在250 mL烧杯中加入少量水,滴加两滴酚酞溶液,再将一小块金属钠投入烧杯中
钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液变红
钠与冷水反应剧烈,反应的化学方程式为__2Na+2H2O===2NaOH+H2↑__
①取一小段镁条用砂纸除去表面的氧化膜,放入试管中,加入2 mL水和2滴酚酞溶液,观察现象;
②加热试管
加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,溶液变为粉红色
镁与冷水几乎不反应,能与热水反应,反应的化学方程式为__Mg+2H2OMg(OH)2+H2↑__
在两支试管中分别加入镁条和铝片,再向试管中各加入2 mL 2 mol·L-1盐酸
两支试管内都有无色气泡冒出,但放镁条的试管中逸出气体的速率较快
镁、铝都能置换出酸中的氢,但镁更容易反应,反应的化学方程式分别为__Mg+2HCl===MgCl2+H2↑__,
__2Al+6HCl===2AlCl3+3H2↑__
由上述实验可知:钠、镁、铝置换出水(或酸)中的氢时,由易到难的顺序是__Na、Mg、Al__。
②钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为__NaOH>Mg(OH)2>Al(OH)3__。
③钠、镁、铝的金属性由强到弱的顺序为__Na>Mg>Al__。
(2)非金属性强弱比较
元素
Si
P
S
Cl
单质与H2
反应的条件
高温
磷蒸气与
H2能反应
加热
光照或
点燃
气态氢化物
的化学式
SiH4
PH3
H2S
HCl
氢化物的
热稳定性
不稳定
不稳定
受热分解
稳定
通过分析比较可以得出:
①硅、磷、硫、氯单质与氢气化合时条件由易到难的顺序为__Cl2、S、P、Si__。
②硅、磷、硫、氯对应氢化物的热稳定性强弱顺序:__SiH4
__Cl>S>P>Si__。
4.探究元素金属性与非金属性的强弱规律
(1)填写下表:
元素
钠
镁
铝
硅
最高价氧化
物对应水化
物的化学式
__NaOH__
Mg(OH)2
Al(OH)3
H2SiO3
最高价氧化
物对应水化
物的类型
强碱
中强碱
两性氢
氧化物
弱酸
元素
磷
硫
氯
最高价氧化
物对应水化
物的化学式
H3PO4
H2SO4
__HClO4__
最高价氧化
物对应水化
物的类型
中强酸
强酸
最强无
机酸
分析上表,可以得出:
①11~17号元素最高价氧化物对应水化物的酸碱性强弱的变化规律:从左到右,碱性逐渐__减弱__,酸性逐渐__增强__。
②11~17号元素的金属性和非金属性强弱的变化规律:从左到右,金属性逐渐__减弱__,非金属性逐渐__增强__。
(2)按要求完成下列实验
①在两支洁净的试管中分别加入2 mL 1 mol·L-1的AlCl3溶液,逐滴加入稀氨水至过量,观察到的实验现象是__产生白色絮状沉淀__,反应的化学方程式是
__AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl__。
②向实验①的一支试管中逐滴滴入2 mol·L-1的盐酸,观察到的实验现象是白色沉淀逐渐溶解,得到澄清溶液,反应的离子方程式为__Al(OH)3+3H+===Al3++3H2O__。
③向实验①的另一支试管中逐滴加入2 mol·L-1的NaOH溶液,观察到的实验现象是白色沉淀逐渐溶解,得到澄清溶液。反应的化学方程式为__Al(OH)3+NaOH===NaAlO2+2H2O__。
结论:Al(OH)3既可以与酸反应生成盐和水,又可以与碱反应生成盐和水,为__两性氢氧化物__。
【提醒】元素的金属(非金属)性是指元素原子失(得)电子能力。比较元素金属(非金属)性强弱,其实质是看元素原子失去(得到)电子的难易程度,越容易失去(得到)电子,元素的金属性(非金属性)越强。
5.元素周期律
(1)概念:元素的性质随着__原子序数__的递增而呈周期性变化的规律叫做元素周期律。
(2)内容:随着元素__原子序数__的递增,元素的__原子半径__(稀有气体除外)、元素的__金属__性和__非金属__性、元素的主要__化合价__都呈现周期性变化。
(3)实质:元素性质的周期性变化是元素原子的__核外电子排布__周期性变化的必然结果。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)同周期元素,随着原子序数的递增,最外层电子排布均呈现由1个电子递增至8个电子的周期性变化。( × )
(2)原子序数越大,原子半径一定越小。( × )
(3)最外层电子数:Na
(5)任何元素均有正价和负价。( × )
(6)元素的金属性、非金属性强弱从根本上取决于其原子核外电子的排布情况。( √ )
(7)随着原子序数的递增,原子的最外层电子排布、原子半径、元素的主要化合价及元素的相对原子质量都呈周期性变化。( × )
2.下列关于核电荷数为1~18的元素的说法正确的是( C )
A.最外层只有1个电子的元素一定是金属元素
B.最外层有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是金属元素
D.最外层电子数为7的元素,最高正价为+7价
【解析】A项,最外层只有1个电子的有H、Li、Na;B项,最外层有2个电子的有He、Be、Mg;C项,各层电子数相等的元素是Be,Be属于金属元素;D项,最外层电子数为7的元素有F、Cl,F无正化合价。
3.原子序数为11~17的元素中:
(1)原子半径最小的元素是__Cl__(填元素符号)。
(2)金属性最强的元素是__Na__(填元素符号)。
(3)最高价氧化物对应水化物酸性最强的酸是__HClO4__(填化学式,下同)。
(4)最不稳定的气态氢化物是__SiH4__。
(5)最高价氧化物对应水化物碱性最强的是__NaOH__。
【解析】原子序数为11~17的元素是同周期元素,电子层数相同,核电荷数越大,原子半径越小,非金属性越强;核电荷数越小,金属性越强。(1)原子半径最小的是Cl。(2)金属性最强的是Na。(3)非金属性越强的元素,其最高价氧化物对应水化物的酸性越强,氯的非金属性最强,其对应的最高价含氧酸是HClO4。(4)非金属性最弱的非金属元素Si的气态氢化物最不稳定。(5)金属性最强的Na对应的NaOH的碱性最强。
4.(1)试从原子结构的角度分析同周期元素性质的递变规律产生的原因。
(2)同周期元素从左到右,原子半径逐渐减小吗?
(3)随着原子序数的递增,第二周期元素的最高正价是逐渐递增的吗?
(4)你能根据元素周期律,比较H3PO4、H2SO4、HClO4的酸性强弱以及P3-、S2-、Cl-的还原性强弱吗?
答:(1)同周期主族元素从左到右,随着原子序数的递增,原子半径逐渐减小,原子核对核外电子的作用力逐渐增强,因此失电子能力逐渐减弱,金属性逐渐减弱;得电子能力逐渐增强,非金属性逐渐增强。
(2)不是。比较同周期元素的原子半径时,往往只比较主族元素,因为非主族元素的原子半径的测量方法与主族元素不同。
(3)不是。因为F无正价,O无最高正价。
(4)酸性:H3PO4
(见学生用书P76)
项目
同周期(左→右)
同主族(上→下)
原
子
结
构
核电荷数
逐渐增大
逐渐增大
电子层数
相同
逐渐增多
原子半径
逐渐减小
逐渐增大
离子半径
阳离子半径逐渐减小,阴离子半径逐渐减小,r(阴离子)>r(阳离子)
逐渐增大
性
质
化合价
最高正化合价由+1→+7(O、F除外),最低负化合价=-(8-主族序数)
相同,最高正化合价=主族序数(O、F除外)
元素的金属性
和非金属性
金属性逐渐减弱;
非金属性逐渐增强
金属性逐渐增强;
非金属性逐渐减弱
续表
项目
同周期(左→右)
同主族(上→下)
性
质
离子的氧化
性、还原性
阳离子的氧化性逐渐增强;
阴离子的还原性逐渐减弱
阳离子的氧化性逐渐减弱;
阴离子的还原性逐渐增强
气态氢化物
的稳定性
逐渐增强
逐渐减弱
最高价氧化
物对应水化
物的酸碱性
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
下列叙述不正确的是( B )
A.Na、Mg、Al最高正化合价依次升高
B.N、O、F非金属性依次减弱
C.P、S、Cl最高价氧化物对应水化物的酸性依次增强
D.Li、Na、K原子的电子层数依次增多
【解析】Na、Mg、Al最高正化合价分别为+1、+2、+3价,逐渐升高,A正确;同周期主族元素从左到右,非金属性逐渐增强,则N、O、F的非金属性逐渐增强,B错误;P、S、Cl的非金属性逐渐增强,则最高价氧化物对应水化物的酸性逐渐增强,C正确;同主族元素Li、Na、K分别处于第二、三、四周期,则电子层数依次增多,D正确。
A、B、C、D四种元素的核电荷数依次增多,它们的离子的电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等;D原子的K、L层电子数之和等于电子总数的一半。回答以下问题:
(1)四种元素的符号依次是A__S__;B__Cl__;C__K__;D__Ca__。它们的原子半径由大到小的顺序是__r(K)>r(Ca)>r(S)>r(Cl)__。
(2)写出四种元素最高价氧化物对应水化物的化学式:__H2SO4、HClO4、KOH、Ca(OH)2__,分别比较酸性或碱性的强弱:__酸性:HClO4>H2SO4,碱性:KOH>Ca(OH)2__。
(3)写出气态氢化物的分子式:__HCl、H2S__,比较其稳定性强弱:__HCl>H2S__。
【解析】因A原子的L层电子数与K、M层电子数之和相等,所以A的核电荷数为2×8=16,A为硫元素;D原子的K、L层电子数之和等于电子总数的一半,则D原子的核电荷数是(2+8)×2=20,为钙元素。根据核电荷数依次增大并都能形成离子,排除氩元素,则B为氯元素,C为钾元素。
1.同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( B )
A.单质的化学活泼性:W<X<Y<Z
B.原子最外层电子数:W<X<Y<Z
C.单质的氧化能力:W<X<Y<Z
D.元素的最高化合价:W<X<Y<Z
【解析】如Z为0族元素,则Z最不活泼,故A错误;同一短周期的元素从左到右,元素的原子序数依次增加,最外层电子数逐渐增多,故B正确;如Z为0族元素,则Z的氧化能力最弱,故C错误;如Z为F元素,没有正价,故D错误。
2.下列递变规律正确的是( C )
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.HCl、HBr、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱
D.Na+、Mg2+、Al3+的离子半径逐渐增大
【解析】A项,非金属性:Cl>S>P,则HClO4、H2SO4、H3PO4的酸性依次减弱,错误;B项,非金属性:Cl>Br>I,则HCl、HBr、HI的稳定性依次减弱,错误;C项,金属性:Na>Mg>Al,则钠、镁、铝的还原性依次减弱,正确;D项,Na+、Mg2+、Al3+的离子半径逐渐减小,错误。
3.X、Y、Z三种元素的原子电子层数相同,它们的最高价氧化物对应水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,下列判断不正确的是( A )
A.原子半径:X>Y>Z
B.气态氢化物稳定性:X>Y>Z
C.元素原子得电子能力由强到弱:X>Y>Z
D.单质与氢气反应由易到难:X>Y>Z
【解析】三种元素的原子电子层数相同,则它们位于同一周期,由酸性:HXO4>H2YO4>H3ZO4,知非金属性:X>Y>Z,同周期元素从左到右非金属性逐渐增强,则原子序数:X>Y>Z。A项,原子半径:X
1.“三看”法比较简单粒子的半径大小
2.粒子半径大小的比较
下列粒子半径大小比较正确的是( B )
A.Na+
C.Na
下列粒子半径的比较中,正确的是( B )
A.r(Na+)>r(Na) B.r(Cl-)>r(Cl)
C.r(Ca2+)>r(Cl-) D.r(Mg)>r(Na)
【解析】同种元素价态越高半径越小,则r(Na+)
1.下列各组元素是按最高正价由高到低、最低负价绝对值由低到高顺序排列的是( D )
A.Na、Mg、Al B.F、O、N
C.N、O、F D.S、P、Si
【解析】A项中最高正价由低到高,且无负价;B、C两项中F无正价;A、B、C三项均不符合题意;D项中各元素的最高正价分别为+6、+5、+4,最低负价绝对值分别为2、3、4,符合题意。
2.几种元素原子的半径如表所示:
元素
N
O
Si
P
原子结构
示意图
元素
N
O
Si
P
原子半径
(10-10 m)
0.75
0.74
1.17
r
根据以上数据,磷原子的半径可能是( B )
A.1.43×10-10 m B.1.10×10-10 m
C.1.20×10-10 m D.0.70×10-10 m
【解析】P与N最外层电子数相同,原子序数:P>N,则原子半径:P>N,即r>0.75×10-10 m;P与Si电子层数相同,原子序数:P>Si,则原子半径:P
A.O、Cl、S、P B.Al3+、Mg2+、Ca2+、Ba2+
C.K+、Mg2+、Al3+、H+ D.Li、Na、K、Cs
【解析】A项,粒子半径:P>S>Cl>O,错误;B项,粒子半径:Ba2+>Ca2+>Mg2+>Al3+,错误;C项,粒子半径:K+>Mg2+>Al3+>H+,正确;D项,粒子半径:Cs>K>Na>Li,错误。
1.下列递变规律正确的是( C )
A.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
B.Na、Mg、Al、Si的金属性逐渐增强
C.O、S、Na、K的原子半径依次增大
D.HF、HCl、H2S、PH3的稳定性依次增强
【解析】同周期元素从左到右金属性逐渐减弱,同主族元素从上到下金属性逐渐增强,金属性越强,最高价氧化物对应的水化物的碱性越强,故碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3,故A错误;Si是非金属元素,无金属性,Na、Mg、Al的金属性逐渐减弱,故B错误;同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,原子半径:O<S<Na<K,故C正确;非金属性越强,气态氢化物越稳定,非金属性:F>Cl>S>P,故稳定性:HF>HCl>H2S>PH3,故D错误。
2.能证明铝的金属性比镁弱的实验事实是( A )
A.Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能
B.铝的原子半径比镁小
C.镁的熔点低于铝
D.铝的金属光泽不如镁显著
【解析】最高价氧化物对应水化物的碱性越强,其金属性越强,Al(OH)3能跟NaOH反应体现其两性,而Mg(OH)2是中强碱,Mg比Al活泼,故A正确;元素的原子半径不能说明金属性的强弱,故B错误;单质的熔点高低是物理性质,无法证明金属性强弱,故C错误;金属光泽是物理性质,不能说明镁和铝金属性的强弱,故D错误。
3.下列比较中正确的是( A )
A.原子半径:Na>Mg
B.碱性:NaOH>KOH
C.结合H+的能力:CO
4.下列不能说明氯元素的非金属性比硫元素强的事实是( B )
①HCl比H2S稳定 ②HClO的氧化性比H2SO4强
③HClO4的酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层只有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS ⑦Cl与S为同周期元素,且Cl的核电荷数比S的大 ⑧HCl的水溶液比H2S的水溶液酸性强
A.①② B.②⑤⑧
C.②⑤⑦ D.①②④
【解析】通过含氧酸的酸性强弱来判断元素的非金属性强弱,一定是用最高价的含氧酸,②错误;没有说明电子层数相同,所以⑤错误;Cl与S同周期,且Cl在S的右边,根据元素周期律,同一周期元素从左到右非金属性逐渐增强,⑦正确;通过HCl、H2S比较Cl和S的非金属性强弱,不是比较其水溶液的酸性强弱,而是比较其稳定性强弱,⑧错误。
5.下表为元素周期表的一部分,请回答有关问题。
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
二
①
②
三
③
④
⑤
⑥
⑦
⑧
四
⑨
⑩
(1)⑤和⑧的元素符号分别是__Si__和__Ar__。
(2)表中最活泼的金属是__K__,非金属性最强的元素是__F__。(填写元素符号)
(3)表中能形成两性氢氧化物的元素是__Al__,分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式:__2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O__,__Al(OH)3+KOH===KAlO2+2H2O__。
(4)请设计一个实验,比较⑦⑩单质氧化性的强弱:__取无色溴化钠的水溶液少许,加入新制氯水,溶液变橙红色__。
【解析】(1)根据元素周期表中元素的位置可以确定①~⑩元素分别为N、F、Mg、Al、Si、S、Cl、Ar、K、Br。(2)同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强;同主族元素从上到下金属性增强,非金属性减弱,由此分析最活泼的金属为K,非金属性最强的是F。(3)Al(OH)3为两性化合物,既能与酸反应,又能与碱反应。(4)利用“氧化还原反应中,氧化剂的氧化性大于氧化产物”原理,可利用反应Cl2+2NaBr===2NaCl+Br2设计实验。
人教版 (2019)必修 第一册第二节 元素周期律导学案: 这是一份人教版 (2019)必修 第一册第二节 元素周期律导学案,共10页。
人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律第1课时导学案: 这是一份人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律第1课时导学案,共9页。
化学必修 第一册第二节 元素周期律第一课时导学案: 这是一份化学必修 第一册第二节 元素周期律第一课时导学案,共10页。