

所属成套资源:新人教版高中化学必修第一册全套课时学案
高中化学人教版 (2019)必修 第一册第二节 元素周期律第2课时学案及答案
展开
这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律第2课时学案及答案,共16页。
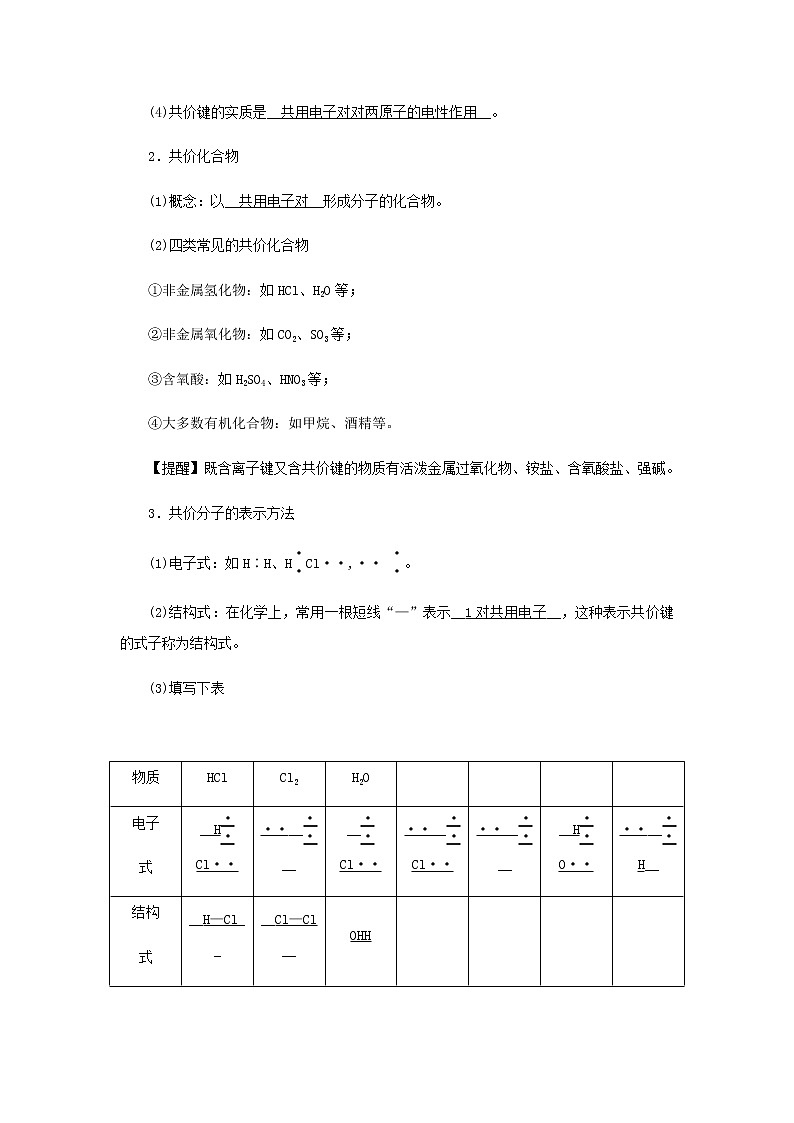
第2课时 共价键课程解读 课标要点学科素养共价键和共价化合物通过共价键的学习,培养学生宏观辨识与微观探析的能力电子式和结构式通过电子式和结构式的学习,培养学生证据推理与模型认知的能力分子间作用力通过分子间作用力的学习,培养学生宏观辨识与微观探析的能力 (见学生用书P83) 知识点一 共价键1.共价键(1)氯化氢的形成过程各提供1个电子形成__共用电子对__,从而使各原子的最外层都形成稳定的电子层结构。(2)共价键的定义原子间通过__共用电子对__所形成的相互作用叫做共价键。(3)成键粒子:__原子__。(4)共价键的实质是__共用电子对对两原子的电性作用__。2.共价化合物(1)概念:以__共用电子对__形成分子的化合物。(2)四类常见的共价化合物①非金属氢化物:如HCl、H2O等;②非金属氧化物:如CO2、SO3等;③含氧酸:如H2SO4、HNO3等;④大多数有机化合物:如甲烷、酒精等。【提醒】既含离子键又含共价键的物质有活泼金属过氧化物、铵盐、含氧酸盐、强碱。3.共价分子的表示方法(1)电子式:如H∶H、HCl··,·· 。(2)结构式:在化学上,常用一根短线“—”表示__1对共用电子__,这种表示共价键的式子称为结构式。(3)填写下表 物质HClCl2H2O 电子式__HCl····______Cl····__Cl····______HO····__H__结构式__H—Cl____Cl—Cl__OHH 物质CO2CH4 电子式O··____CO··__HC··H··H H 结构式__O===C===O____CHHHH__ 知识点二 化学键与化学反应的本质1.化学键的概念__相邻的原子__之间强烈的相互作用。2.分类3.化学反应的本质化学反应的过程,本质上就是旧化学键__断裂__和新化学键__形成__的过程。 知识点三 分子间作用力 氢键1.分子间作用力(1)定义:__分子之间存在的一种把分子聚集在一起的作用力__叫做分子间作用力,最初也称为范德华力。(2)强弱:范德华力比__化学键__弱得多。(3)影响:范德华力越大,分子的熔、沸点越__高__。2.氢键(1)特点:是一种较强的分子间作用力。(2)强弱:比__化学键__弱,但比__范德华力__强。(3)存在:H2O、DNA等。(4)影响:使物质的__熔、沸点__升高。1.判断正误(正确的打“√”,错误的打“×”)。(1)HCl分子中有一对共用电子。( √ )(2)原子间以共用电子对形成的物质是共价化合物。( × )(3)共价化合物中一定只含有共价键。( √ )(4)共价键只存在于共价化合物中。( × )(5)共价化合物中一定不含有离子键。( √ )(6)含有共价键的化合物一定是共价化合物。( × )(7)N2的电子式为N⋮⋮N。( × )2.下列变化过程中,原物质内仅有共价键被破坏,同时有离子键形成的是( D )A.盐酸和NaOH溶液反应B.氯化氢溶于水C.稀硫酸与BaCl2溶液反应D.氯化氢与氨反应生成NH4Cl固体【解析】盐酸与NaOH溶液反应只有共价键的形成,A错误;HCl溶于水时电离产生H+、Cl-,仅存在共价键的破坏,不存在化学键的形成,B错误;稀硫酸与BaCl2溶液反应生成BaSO4沉淀,不存在共价键的破坏,有离子键形成,C错误;HCl与NH3反应生成离子化合物NH4Cl,存在共价键的破坏和离子键的形成过程,D正确。3.(1)含有共价键的化合物一定是共价化合物吗?(2)氮气和氢气合成氨反应中化学键发生了怎样的变化?答:(1)不一定。含有共价键的化合物不一定是共价化合物,如NaOH中存在共价键,但是NaOH为离子化合物。(2)氮气中的氮氮三键(N≡N)和氢气中的氢氢键(H—H)断裂,形成氮氢键(N—H)。 (见学生用书P84)角度1:离子键和共价键、离子化合物和共价化合物的比较1.离子键与共价键的比较 类型离子键共价键 概念阴、阳离子间通过静电作用所形成的化学键原子间通过共用电子对的相互作用所形成的化学键 成键粒子阴、阳离子原子 成键元素活泼金属元素和活泼非金属元素(铵盐除外)大多数为非金属元素 成键实质阴、阳离子间的静电作用共用电子对对两原子产生的电性作用 形成过程NaCl的形成过程:HCl的形成过程:H×+Cl···· ―→HCl···· 续表类型离子键共价键存在范围活泼金属氧化物、强碱、大多数盐多数非金属单质、共价化合物及部分离子化合物实例CaCl2、Na2O2、NaOHCl2、CCl4、NaHCO32.离子化合物与共价化合物的比较 化合物离子化合物共价化合物构成粒子阴、阳离子分子或原子粒子间的作用离子键原子之间存在共价键熔、沸点较高一般较低,少部分很高(如SiO2)导电性熔融态或水溶液导电熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)熔化时破坏的作用力一定破坏离子键,可能破坏共价键(如NaHSO4)一般不破坏共价键,极少部分破坏共价键(如SiO2)实例强碱、大多数盐、活泼金属的氧化物酸、非金属氢化物、非金属氧化物【小结】 下列有关化学键的叙述正确的是( A )A.离子化合物中一定有离子键B.含有共价键的化合物一定是共价化合物C.非金属元素组成的化合物中只含共价键D.单质分子中都存在化学键【解析】离子化合物的定义是含有离子键的化合物,则离子化合物中一定含有离子键,A正确;只含有共价键的化合物才是共价化合物,B不正确;非金属元素组成的化合物中也可能既含共价键,又含离子键,如NH4Cl中NH与Cl-之间以离子键结合,N与H之间以共价键结合,C不正确;稀有气体分子中不含化学键,D不正确。 角度2:判断离子化合物和共价化合物的方法1.由化学键类型判断只含有共价键的化合物是共价化合物;只含离子键或既含离子键又含共价键的化合物是离子化合物。2.由化合物类型判断(1)活泼金属的氧化物、强碱和大多数盐(少数盐如AlCl3、BeCl2等除外)属于离子化合物。(2)非金属氧化物、非金属氢化物、含氧酸、多数有机物、少数盐(如AlCl3、BeCl2)属于共价化合物。3.由组成元素判断一般含金属元素或NH的化合物是离子化合物(AlCl3、BeCl2等少数除外),如NH4Cl、NH4HCO3、Ca(OH)2、KClO3等;只由非金属元素组成的化合物(铵盐等除外)属于共价化合物。 下表物质与其所含化学键类型、所属化合物类型对应完全正确的一组是( A ) 选项A.B.C.D.物质CO2MgCl2HClNH4Cl所含化学键类型共价键离子键、共价键离子键离子键、共价键所属化合物类型共价化合物离子化合物离子化合物共价化合物 【解析】依据电子式可判断化学键类型,依据离子化合物和共价化合物的定义判断化合物类型,MgCl2只含离子键,HCl是只含共价键的共价化合物,NH4Cl是离子化合物。 下列有关化学键的类型说法正确的是( C )A.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物B.不同元素的原子构成的分子只含极性共价键C.H与O、H与N均可形成既含极性共价键又含非极性共价键的化合物D.NaHCO3和HCOONa都只含离子键【解析】氯化氢是共价化合物,A项错误;不同元素的原子构成的分子有的含有非极性共价键,如H2O2,B项错误;H与O、H与N均可形成既含极性共价键又含非极性共价键的化合物,如H2O2、N2H4,C项正确; NaHCO3和HCOONa中既含离子键又含共价键,D项错误。1. 下列叙述正确的是( B )A.离子键只存在于金属阳离子与酸根阴离子之间B.两种非金属元素形成AB型化合物,它一定含共价键C.物质中化学键破坏了,一定发生化学变化D.化学键类型由元素类型决定【解析】离子键也可能存在于金属阳离子与非金属阴离子或氢氧根离子之间,如氧化钠、氢氧化钾等都含有离子键,A项错误;非金属原子之间形成的化学键一定是共价键,B项正确;物质中有旧化学键断裂,同时有新化学键形成的变化才是化学变化,而像氯化钠熔化、氢氧化钠溶于水等过程只有化学键的破坏,无新化学键的形成,不是化学变化,C项错误;化学键类型由构成粒子间的作用决定,与元素类型无关,D项错误。2.下列关于离子键、共价键的说法中正确的是( C )A.CaCl2中既有离子键又有共价键B.非极性键只存在于双原子的单质分子(如Cl2)中C.在共价化合物分子内,一定不存在离子键D.由多种元素组成的多原子分子里,一定只存在极性键【解析】CaCl2中无共价键,A项错误;非极性键可存在于单质分子和化合物中,如H2O2中氧原子间为非极性键,B、D项错误;若化合物中有离子键,则属于离子化合物,共价化合物中一定无离子键,C项正确。角度1:化学用语 原子或离子结构示意图Na: S2-: 核素符号中子数为14的镁原子表示为Mg,中子数为20的氯原子表示为Cl 电子式Ba(OH)2:[HO···· ]-Ba2+[O···· H]-H2O:HO···· H结构式CO2:O===C===OHClO:H—O—Cl 分子式、化学式臭氧:O3明矾:KAl(SO4)2·12H2O 电离方程式NaOH的电离:NaOH===Na++OH- 下列表示物质结构的化学用语正确的是( B )A.H2O2的电子式:H+[O··,·· O··,·· ]2-H+B.CS2的结构式:S===C===SC. 14C的原子结构示意图:D.CCl4的电子式:ClC··Cl,··,Cl Cl【解析】H2O2为共价化合物,电子式中存在共用电子对,不是阴阳离子,A错误;CS2的结构式为SCS,B正确;14C的质子数为6,C错误;Cl原子的最外层电子应全标出来,D错误。角度2:物质变化过程中化学键的变化1.化学反应过程(1)化学反应过程中反应物的化学键被破坏,产物中有新化学键的形成,如H2与Cl2反应生成HCl,H2、Cl2中的化学键被破坏,形成HCl中的化学键。(2)化学反应时,反应物中并不是所有的化学键都被破坏,如反应Na2SO4+BaCl2===BaSO4↓+2NaCl中,Na2SO4、BaCl2中的离子键被破坏,但SO中的共价键未被破坏。2.离子化合物的溶解或熔化过程离子化合物电离阴、阳离子。3.共价化合物的溶解或熔化过程(1)溶解过程(2)熔化4.单质的熔化或溶解过程(1)由分子构成的固体单质,如I2的升华、P4的熔化,只破坏分子间作用力,而不破坏化学键。(2)由原子构成的单质,如金刚石、晶体硅,熔化时破坏共价键。(3)对于某些活泼的非金属单质,溶于水后能与水反应,其分子内共价键被破坏,如Cl2、F2等。 下列物质的变化过程中,有共价键明显被破坏的是( C )A.从饮料酒中闻到了醇香味B.NaCl颗粒被粉碎C.H2SO4溶于水得硫酸溶液D.NaOH受热熔化【解析】闻到醇香味是因为醇的挥发,只是破坏了分子间作用力,A错误;NaCl颗粒被粉碎破坏了部分离子键,B错误;H2SO4溶于水后,电离出H+和SO,共价键被破坏,C正确;NaOH受热熔化时,电离出Na+和OH-,只破坏了离子键,而OH-中的共价键没被破坏,D错误。 1.下列物质在变化过程中,只需克服分子间作用力的是( B )A.食盐溶化 B.干冰升华C.氯化铵受热,固体消失 D.氯化氢溶于水【解析】食盐是氯化钠,属于离子化合物,溶于水克服的是离子键。干冰是CO2,属于分子晶体,升华是物理变化,克服的是分子间作用力。氯化铵受热分解生成氯化氢和氨气,克服的是化学键。氯化氢是共价化合物,溶于水克服的是共价键。2.下列说法正确的是( D )A.碳酸氢铵受热固体消失和碘升华只需克服分子间作用力B.NaF、H2SO4中所含化学键类型相同C.I2、Br2、Cl2、F2熔沸点逐渐升高D.HCl气体溶于水和NaOH熔化破坏的化学键类型不同【解析】NH4HCO3受热易分解:NH4HCO3NH3↑+CO2↑+H2O,破坏了化学键,碘升华是物理变化,只破坏分子间作用力,A项错误;NaF是离子化合物,含有离子键,H2SO4是共价化合物,只含共价键,B项错误;I2常温下为固体,Br2常温下为液体,Cl2和F2常温下为气体,则F2、Cl2、Br2、I2熔沸点逐渐升高,C项错误;HCl溶于水破坏的是共价键,NaOH溶于水破坏的是离子键,D项正确。3.下列是同学们熟悉的物质:①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3 ⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH(1)这些物质中,只含有共价键的是__①②④__;只含有离子键的是__③__;既含有共价键又含有离子键的是__⑤⑥⑦⑨⑩__;不存在化学键的是__⑧__。(2)属于共价化合物的是__④__;属于离子化合物的是__③⑤⑥⑦⑨⑩__。(3)将NaHSO4溶于水,破坏了NaHSO4中的__离子键和共价键__,写出其电离方程式:__NaHSO4===Na++H++SO____。【解析】O2、金刚石中只含有共价键;H2SO4中只含有共价键,是共价化合物;NaBr中只含有离子键,是离子化合物;Na2CO3、NH4Cl、NaHSO4、Na2O2、NaOH都是既含有离子键又含有共价键的离子化合物;稀有气体Ne是单原子分子,不含任何化学键;NaHSO4溶于水电离时,Na+与HSO之间的离子键被破坏,HSO中H+和SO之间的共价键也被破坏。1.下列说法中正确的是( C )A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高B.熔融状态下能导电的化合物一定含离子键;金属与非金属形成的化合物一定是离子化合物C.NCl3分子中所有的原子均为8电子稳定结构D.NaHCO3溶于水时发生电离:NaHCO3===Na++HCO,破坏的是共价键【解析】HF可以形成分子间氢键,所以沸点高;金属与非金属形成的化合物不一定是离子化合物,离子化合物是由活泼金属和活泼非金属形成的;NaHCO3溶于水发生电离,破坏的是离子键。2.下列说法不正确的是( A )A.H2O、H2S、H2Te分子间作用力依次增大B.石墨转化为金刚石,既有化学键的断裂,也有化学键的形成C.碘单质升华克服的是分子间作用力D.KClO3分解生成KCl和O2的过程中有离子键和共价键的断裂和形成【解析】 H2O分子间存在氢键,H2S、H2Te分子间不存在氢键,H2Te的相对分子质量大于H2S,所以H2Te的分子间作用力大于H2S,因此分子间作用力大小顺序为H2O>H2Te>H2S,A错误;石墨转化为金刚石是化学变化,既有化学键的断裂,又有化学键的形成,B正确;碘是分子晶体,碘单质升华克服的是分子间作用力,C正确;KClO3分解生成KCl和O2的过程中有离子键和共价键的断裂(K+与ClO形成的离子键、Cl—O共价键)和形成(K+与Cl-形成的离子键、O===O共价键),D正确。3.关于氢键,下列说法正确的是( D )A.所有含氢元素的化合物中都存在氢键,氢键比分子间作用力强B.H2O是一种非常稳定的化合物,是由于水分子间形成氢键所致C.氢原子和非金属性很强的元素原子(F、O、N)形成的共价键,称为氢键D.分子间形成的氢键使相应物质的熔点和沸点升高【解析】氢键存在于H和非金属性很强的原子F、O、N之间,不属于化学键,大多存在于相应分子间,少数也存在分子内,氢键的存在影响物质的熔、沸点。4.X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形成的常见化合物或者离子不可能是( C )A.只含极性键的共价化合物B.含非极性键的共价化合物C.阴、阳离子个数之比为1∶1的离子化合物D.可形成双核离子或者四核离子【解析】短周期元素X原子的最外层电子数为1,则X可能为H、Li、Na;短周期元素Y的最外层电子数为6,则Y可能为O、S。X、Y可形成只含极性键的共价化合物H2O,A正确;X、Y形成的含非极性键的共价化合物为H2O2,B正确;X、Y形成的离子化合物可能为Na2O、Na2O2、Na2S等,阴、阳离子个数比都为1∶2,C错误;X、Y形成的双核离子为OH-,形成的四核离子为H3O+,D正确。5.下列说法不正确的是( D )A.非金属单质氯气、白磷、臭氧等都含有非极性键B.化合物过氧化氢、硫酸、甲烷中都含有极性键C.二氧化碳、三氧化硫、过氧化钠中都含有共价键D.离子化合物中一定不含有共价键【解析】非金属单质(除稀有气体)都含有非极性键,故A正确;H2O2的结构式为H—O—O—H,过氧化氢、硫酸、甲烷中都含有极性共价键,故B正确;CO2、SO3属于共价化合物,Na2O2中含有的O是由非极性共价键形成,故C正确;离子化合物中可能含有共价键,如NaOH和Na2O2,故D错误。6.下列变化中:①I2升华,②烧碱溶于水,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水。未发生化学键破坏的是__①⑤__;仅发生离子键破坏的是__②③__;仅发生共价键破坏的是__④__;既发生离子键破坏,又发生共价键破坏的是__⑥__。【解析】I2升华,O2溶于水时,I2和O2均以分子形式存在,并未发生化学键的破坏;NaOH、NaCl、Na2O2、HCl溶于水时,均发生了化学键的破坏,但NaOH溶于水时H—O共价键未被破坏,Na2O2溶于水时O中的非极性键被破坏。
相关学案
这是一份高中化学人教版 (2019)必修 第一册第三节 化学键第2课时导学案及答案,共10页。
这是一份人教版 (2019)必修 第一册第二节 元素周期律第1课时学案设计,共10页。
这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律第2课时导学案及答案,共11页。










