
2021抚顺重点高中协作校高一下学期期末考试化学试卷含答案
展开抚顺市重点高中协作校2020-2021学年度下学期期末试卷
高一化学试卷
一、选择题(每题3分,共45分)
1.世界著名的科技史专家、英国剑桥大学的李约瑟博土考证说:“中国至少在距今3 000年以前,就已经使用玻璃了。”下列有关普通玻璃的说法不正确的是( )
A.制普通玻璃的原料主要是纯碱、石灰石和石英砂
B.玻璃在加热熔化时有固定的熔点
C.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅反应生成硅酸钠而使瓶塞与瓶口黏在一起
2.下列组合中不可能形成喷泉的是( )
A. HCl和H2O B. O2和H2O C. NH3和H2O D. CO2和NaOH溶液
3.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氮有关(如下图所示)。下列叙述错误的是( )
A.雾和霾的分散剂相同 B.雾霾中含有硝酸铵和硫酸铵
C.是形成无机颗粒物的催化剂 D.雾霾的形成与过度施用氮肥有关
4.可逆反应 在不同条件下的反应速率如下,其中反应速率最快的是( )
A. B.
C. D.
5.下列关于金属冶炼的说法正确的是( )
A.利用该铝热反应炼铁,1 mol氧化剂参加反应转移8NA个电子
B.金属的冶炼都是把金属单质从其矿物中分离出来
C.工业上可用电解熔融态的来制备Mg、Al
D.古代火烧孔雀石炼铜的方法属于热分解法中的焦炭法
6.下列各组化合物中不互为同分异构体的是( )
A. B.
C. D.
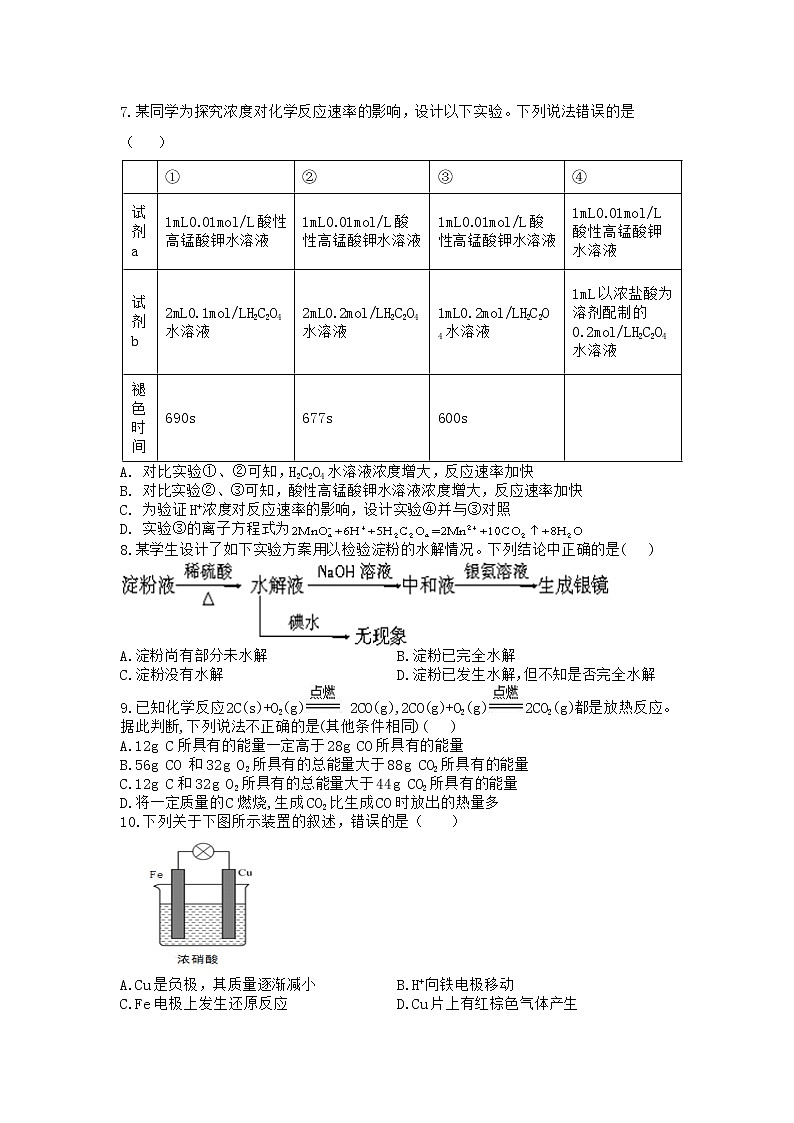
7.某同学为探究浓度对化学反应速率的影响,设计以下实验。下列说法错误的是( )
| ① | ② | ③ | ④ |
试剂a | 1mL0.01mol/L酸性高锰酸钾水溶液 | 1mL0.01mol/L酸性高锰酸钾水溶液 | 1mL0.01mol/L酸性高锰酸钾水溶液 | 1mL0.01mol/L酸性高锰酸钾水溶液 |
试剂b | 2mL0.1mol/LH2C2O4水溶液 | 2mL0.2mol/LH2C2O4水溶液 | 1mL0.2mol/LH2C2O4水溶液 | 1mL以浓盐酸为溶剂配制的0.2mol/LH2C2O4水溶液 |
褪色时间 | 690s | 677s | 600s |
|
A. 对比实验①、②可知,H2C2O4水溶液浓度增大,反应速率加快
B. 对比实验②、③可知,酸性高锰酸钾水溶液浓度增大,反应速率加快
C. 为验证H+浓度对反应速率的影响,设计实验④并与③对照
D. 实验③的离子方程式为
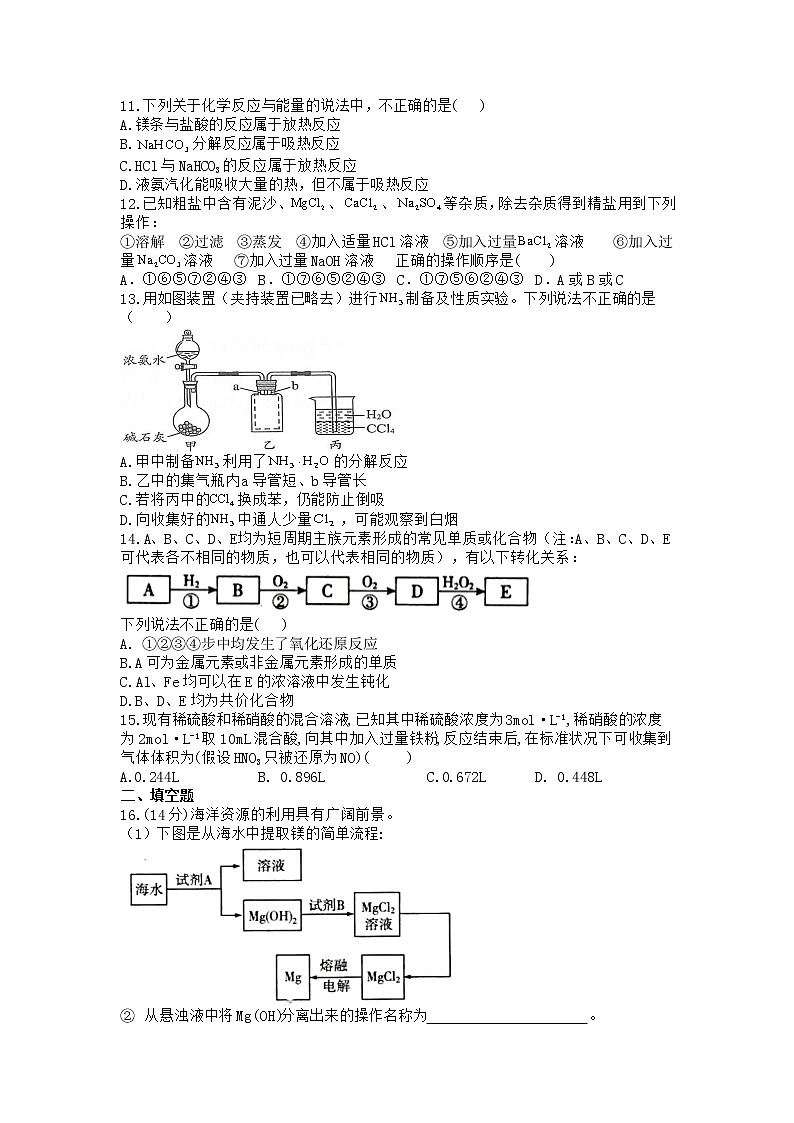
8.某学生设计了如下实验方案用以检验淀粉的水解情况。下列结论中正确的是( )
A.淀粉尚有部分未水解 B.淀粉已完全水解
C.淀粉没有水解 D.淀粉已发生水解,但不知是否完全水解
9.已知化学反应2C(s)+O2(g) 2CO(g),2CO(g)+O2(g)2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同)( )
A.12 g C所具有的能量一定高于28g CO所具有的能量
B.56 g CO 和32 g O2所具有的总能量大于88 g CO2所具有的能量
C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的能量
D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多
10.下列关于下图所示装置的叙述,错误的是( )
A.Cu是负极,其质量逐渐减小 B.H+向铁电极移动
C.Fe电极上发生还原反应 D.Cu片上有红棕色气体产生
11.下列关于化学反应与能量的说法中,不正确的是( )
A.镁条与盐酸的反应属于放热反应
B.分解反应属于吸热反应
C.HCl与NaHCO3的反应属于放热反应
D.液氨汽化能吸收大量的热,但不属于吸热反应
12.已知粗盐中含有泥沙、、、等杂质,除去杂质得到精盐用到下列操作:
①溶解 ②过滤 ③蒸发 ④加入适量HCl溶液 ⑤加入过量溶液 ⑥加入过量溶液 ⑦加入过量NaOH溶液 正确的操作顺序是( )
A.①⑥⑤⑦②④③ B.①⑦⑥⑤②④③ C.①⑦⑤⑥②④③ D.A或B或C
13.用如图装置(夹持装置已略去)进行制备及性质实验。下列说法不正确的是( )
A.甲中制备利用了的分解反应
B.乙中的集气瓶内a导管短、b导管长
C.若将丙中的换成苯,仍能防止倒吸
D.向收集好的中通人少量,可能观察到白烟
14.A、B、C、D、E均为短周期主族元素形成的常见单质或化合物(注:A、B、C、D、E可代表各不相同的物质,也可以代表相同的物质),有以下转化关系:
下列说法不正确的是( )
A. ①②③④步中均发生了氧化还原反应
B.A可为金属元素或非金属元素形成的单质
C.Al、Fe均可以在E的浓溶液中发生钝化
D.B、D、E均为共价化合物
15.现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸浓度为3mol·L-1,稀硝酸的浓度为2mol·L-1取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到气体体积为(假设HNO3只被还原为NO)( )
A.0.244L B. 0.896L C.0.672L D. 0.448L
二、填空题
16.(14分)海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程:
② 从悬浊液中将Mg(OH)分离出来的操作名称为 。
②Mg(OH)2转化为MgCl2的离子方程式是 。
③由无水MgCl2制取Mg的化学方程式是 。
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
①灼烧所用仪器是下列中的哪一种______________(填字母序号);
a.蒸发皿 b.坩埚 c.烧杯
②向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2,请写出该反应的离子方程式:___________;
③上述反应结束后,可加入萃取剂,采用萃取一分液的方法从碘水中提取碘。下列试剂中可以用于萃取碘单质的是_______________(填字母序号)。
a.乙酸 b.四氯化碳 c.硝酸 d.苯
17.(13分)一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:
(1)反应的化学方程式为_______________。
(2)反应达到最大限度的时间是____min,该时间内的平均反应速率v(N)= ,v(M)= 。
(3)反应达到平衡状态时,放出80kJ的热量,当容器中充入1mol N时,反应放出的热量为( )(填序号)
A.等于Q kJ B.小于Q kJ C.大于Q kJ D.等于2Q kJ
(4)判断该反应达到平衡状态的依据是( )(填序号)
A.该条件下,正、逆反应速率都为零
B.该条件下,混合气体的密度不再发生变化
C.该条件下,混合气体的压强不再发生变化
D.条件下,单位时间内消耗2mol N的同时,消耗1mol M
(5)能加快反应速率的措施是( )(填序号)
A.升高温度 B.容器容积不变,充入惰性气体Ar
C.容器压强不变,充入惰性气体Ar D.使用催化剂
三、实验题
18.(14分)甲、乙两组同学用不同的方法制备SO2并探究其性质。(夹持装置已略去)
I.甲组同学设计的实验装置如图所示,回答下列问题:
(1)试管①中反应的化学方程式为________________。
(2)试管②中的品红溶液褪色。欲证明品红褪色的原因是SO2,需要补充的实验操作及应出现的实验现象是 。
(3)试管③中的试剂是NaOH溶液,反应的离子方程式为 。
II.乙组同学设计的实验装置如下图所示,回答下列问题:
已知:BaSO3是白色难溶于水的物质,但可溶解于盐酸。
(4)④中反应的化学方程式为_____ ___________。
(5)⑤中产生了不溶于盐酸的白色沉淀,该沉淀是________________。
(6)经过分析,乙组同学认为装置中的空气是出现白色沉淀的原因。他们在不改变实验装置的情况下增加了某操作过程,证实了这种猜测是正确的。他们的操作及实验现象是___ __________。
19.(14分)已知有机化合物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图甲所示。
(1)A分子中官能团的名称是_____________,D分子中官能团的名称是____________,反应①的反应类型是_____________反应,反应②的反应类型是_____________反应。
(2)反应②的化学方程式是____ _________;
反应④的化学方程式是____ _____________。
(3)E是常见的高分子材料,合成E的化学方程式是___________________。
(4)某同学用如图乙所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、难溶于水的油状液体。
① 实验开始时,试管甲中的导管不伸入液面下的原因是____________;
②上述实验中饱和碳酸钠溶液的作用是______________(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
高一化学参考答案
一、选择题(每题3分共45分)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
B | B | C | C | A | B | C | B |
9 | 10 | 11 | 12 | 13 | 14 | 15 |
|
A | D | C | C | C | B | D |
|
二、填空题(共55分 ,未标注每空2分)
16.(14分)(1)过滤;②Mg(OH)2+2H+=Mg2++2H2O;
③MgCl2(熔融)Mg+Cl2↑(3分);
(2)①b;②2I-+H2O2+2H+=I2+2H2O(3分);③b
17.(13分) (1)2NM
(2) 6min(1分) 0.5mol/(L·min) 0.25 mol/(L·min)
(3)B(4)CD(5)AD
18.(14分) (1)Cu + 2H2SO4(浓)CuSO4+SO2↑+ 2H2O;
(2)取下试管②并加热,试管内液体恢复红色
(3)SO2+2OH-=+H2O;
(4)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O(3分)
(5)BaSO4
(6)开始反应之前打开弹簧夹,向装置中鼓入一定量N2,夹紧弹簧夹,SO2气体产生后⑤中无白色沉淀(3分)
19.(14分)
(1)碳碳双键;羧基;加成 ;氧化反应(各1分)
(2);
(3)
(4)①防止倒吸;②BC;
辽宁省抚顺市重点高中六校协作体2022-2023学年高一下学期期中考试化学试题(Word版含答案): 这是一份辽宁省抚顺市重点高中六校协作体2022-2023学年高一下学期期中考试化学试题(Word版含答案),共13页。试卷主要包含了本试卷主要考试内容,可能用到的相对原子质量,某教师设计了如图装置等内容,欢迎下载使用。
2023届辽宁省抚顺市重点高中六校协作体高三下学期二模联考化学试题: 这是一份2023届辽宁省抚顺市重点高中六校协作体高三下学期二模联考化学试题,文件包含2023届辽宁省抚顺市重点高中六校协作体高三下学期二模联考化学试题pdf、化学答案pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
2020抚顺六校协作体高一上学期期末考试化学试题PDF版含答案: 这是一份2020抚顺六校协作体高一上学期期末考试化学试题PDF版含答案,文件包含首发辽宁省抚顺市六校协作体2019-2020学年高一上学期期末考试化学试题PDF版pdf、首发辽宁省抚顺市六校协作体2019-2020学年高一上学期期末考试化学答案PDF版pdf等2份试卷配套教学资源,其中试卷共6页, 欢迎下载使用。












