

所属成套资源:2022学年全国部分地区高考化学模拟试题(含答案解析)
2022年江苏省徐州七中高考化学模拟试卷(2月份(含答案解析)
展开
这是一份2022年江苏省徐州七中高考化学模拟试卷(2月份(含答案解析),共21页。试卷主要包含了NH4Cl等内容,欢迎下载使用。
2022年江苏省徐州七中高考化学模拟试卷(2月份)
1. 2021年4月29日,中国空间站核心舱“天和号”成功送入预定轨道,它与化学有着密切联系。下列说法错误的是( )
A. 中国空间站推进器的推进剂氙气(Xe)属于稀有气体
B. “天和号”推进器的氮化硼陶瓷基材料属于新型无机非金属材料
C. 宇航服材料中的聚氯乙烯属于有机高分子材料
D. 空间站太阳能电池板的主要材料属于硅酸盐
2. 三元催化器是汽车排气系统中重要的净化装置,可同时将碳氢化合物、一氧化碳和氮氧化物转化为无害物质,其工作原理如图。下列说法错误的是( )
A. N2分子中有1个σ键和2个π键 B. CO2的电子式为
C. H2O是非极性分子 D. 中子数为8的碳原子可表示为 614C
3. 下列物质性质与用途的对应关系不正确的是( )
A. 小苏打能与碱反应,可用作抗酸药
B. Al2O3熔点高,可用作耐高温材料
C. Na2O2能吸收CO2产生O2,可用作呼吸面具供氧剂
D. 漂白粉具有强氧化性,可用于生活用水的消毒
4. 2021年5月15日我国“祝融号”火星车成功着陆火星。研究表明,火星夏普山矿脉中含有原子序数增大的短周期主族元素W、X、Y、Z.已知W、Z同主族,且Z的原子序数是W的2倍,X的氢化物可用于蚀刻玻璃,Y与Z最外层电子数之和等于8。下列说法正确的是( )
A. W与Z有相同的最高正价
B. 原子半径:Z>Y>W>X
C. 化合物YZW4中含离子键和共价键
D. 电负性大小:W>X>Z
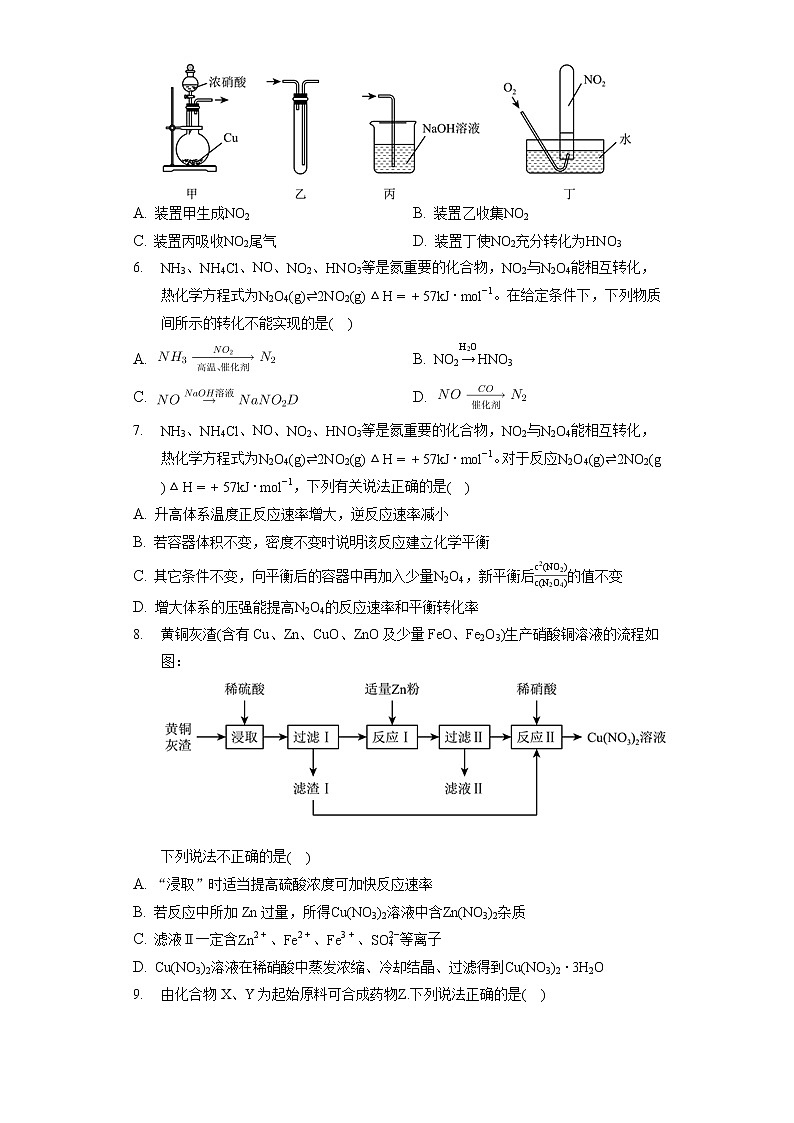
5. NH3、NH4Cl、NO、NO2、HNO3等是氮重要的化合物,NO2与N2O4能相互转化,热化学方程式为N2O4(g)⇌2NO2(g)ΔH=+57kJ⋅mol−1。已知2NO2+2OH−=NO3−+NO2−+H2O。下列装置不能达到相应实验目的的是( )
A. 装置甲生成NO2 B. 装置乙收集NO2
C. 装置丙吸收NO2尾气 D. 装置丁使NO2充分转化为HNO3
6. NH3、NH4Cl、NO、NO2、HNO3等是氮重要的化合物,NO2与N2O4能相互转化,热化学方程式为N2O4(g)⇌2NO2(g)△H=+57kJ⋅mol−1。在给定条件下,下列物质间所示的转化不能实现的是( )
A. B. NO2→H2OHNO3
C. D.
7. NH3、NH4Cl、NO、NO2、HNO3等是氮重要的化合物,NO2与N2O4能相互转化,热化学方程式为N2O4(g)⇌2NO2(g)△H=+57kJ⋅mol−1。对于反应N2O4(g)⇌2NO2(g)△H=+57kJ⋅mol−1,下列有关说法正确的是( )
A. 升高体系温度正反应速率增大,逆反应速率减小
B. 若容器体积不变,密度不变时说明该反应建立化学平衡
C. 其它条件不变,向平衡后的容器中再加入少量N2O4,新平衡后c2(NO2)c(N2O4)的值不变
D. 增大体系的压强能提高N2O4的反应速率和平衡转化率
8. 黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量FeO、Fe2O3)生产硝酸铜溶液的流程如图:
下列说法不正确的是( )
A. “浸取”时适当提高硫酸浓度可加快反应速率
B. 若反应中所加Zn过量,所得Cu(NO3)2溶液中含Zn(NO3)2杂质
C. 滤液Ⅱ一定含Zn2+、Fe2+、Fe3+、SO42−等离子
D. Cu(NO3)2溶液在稀硝酸中蒸发浓缩、冷却结晶、过滤得到Cu(NO3)2⋅3H2O
9. 由化合物X、Y为起始原料可合成药物Z.下列说法正确的是( )
A. X分子中所有碳原子可处于同一平面
B. X、Z分子中均含有2个手性碳原子
C. 1molZ最多只能与2molBr2发生反应
D. X、Y、Z均可与NaOH稀溶液发生反应
10. MFC−电芬顿技术不需要外加能即可发生,通过产生羟基自由基(⋅OH)处理有机污染物,可获得高效的废水净化效果。其耦合系统原理示意图如图,下列说法不正确的是( )
A. 电子移动方向为a→Y,X→b
B. Y电极上得到双氧水的反应为O2+2e−+2H+=H2O2
C. 乙池可在酸性较弱的环境中使用
D. 理论上当乙池中产生1mol羟基自由基时,甲池中有2molH+从M室移动到N室
11. 二甲醚催化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)=CH3COOCH3(g)△H1=akJ⋅mol−1
反应Ⅱ:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g)△H2=bkJ⋅mol−1
反应Ⅰ、Ⅱ的平衡常数的对数lgK1、lgK2与温度的关系如图−1所示;固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图−2所示。下列说法正确的是( )
A. a>0
B. 测得X点CH3CH2OH的物质的量分数是10%,则X点反应Ⅱ有:
C. 由CH3COOCH3的曲线知,600K后升高温度对反应Ⅰ的影响程度大于反应Ⅱ
D. 曲线B表示H2的物质的量分数随温度的变化
12. [Cu(OH)(NH3)]+是汽车尾气脱硝的催化剂,其催化机理如图所示,下列说法错误的是( )
A. [Cu(OH)(NH3)]+中O和N原子是配位原子
B. 该催化循环中Cu的成键数目发生了变化
C. 反应过程中存在非极性键的断裂和形成
D. 总反应的化学方程式为:4NH3+2NO+2O2−[Cu(OH)(NH3)]+3N2+6H2O
13. CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如图:
(1)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为 ______。
②当n(Na2SO3):n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是 ______。
③当1.0S,即X>W>Z,故D错误;
故选:C。
原子序数依次增大的短周期主族元素W、X、Y、Z,W、Z同主族,且Z的原子序数是W的2倍,则W为O,Z为S;X的氢化物可用于蚀刻玻璃,则X为F元素;Y与Z最外层电子数之和等于8,Y的最外层电子数为8−6=2,Z的原子序数大于Y,则Y为Mg元素,则W、X、Y、Z分别是O、F、Mg、S元素;
A.W、Z分别是O、S元素,O没有+6价;
B.电子层数越多,原子半径越大,同一周期元素,原子半径随着原子序数增大而减小
C.MgSO4中阴阳离子之间存在离子键、酸根离子中存在共价键;
D.元素吸引电子能力越强,其电负性越大。
本题考查原子结构与元素周期律的应用,为高频考点,把握有主族序数、物质性质来推断元素为解答关键,注意掌握元素周期律内容及常见元素化合物性质,试题侧重考查学生的分析与应用能力,题目难度不大。
5.【答案】B
【解析】解:A.Cu与浓硝酸反应生成二氧化氮,图中固液不加热装置可制备二氧化氮,故A正确;
B.二氧化氮的密度比空气密度大,应长导管进气收集,故B错误;
C.二氧化氮与NaOH溶液反应,图中装置可吸收尾气,故C正确;
D.二氧化氮与氧气、水反应生成硝酸,可使NO2充分转化为HNO3,故D正确;
故选:B。
A.Cu与浓硝酸反应生成二氧化氮;
B.二氧化氮的密度比空气密度大;
C.二氧化氮与NaOH溶液反应;
D.二氧化氮与氧气、水反应生成硝酸。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备、尾气处理、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
6.【答案】C
【解析】解:A.氨气和二氧化氮发生归中反应生成氮气,故,可以实现转化,故A正确;
B.二氧化氮和水反应生成硝酸和NO,可以实现转化,故B正确;
C.NO是不成盐氧化物,与NaOH不发生反应,故不能实现,故C错误;
D.NO和CO发生归中反应生成氮气,可以实现转化,故D正确;
故选:C。
A.氨气和二氧化氮发生归中反应生成氮气;
B.二氧化氮和水反应生成硝酸和NO;
C.NO是不成盐氧化物;
D.NO和CO发生归中反应生成氮气。
本题考查了氮元素化合物知识,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大。
7.【答案】C
【解析】解:A.升高体系温度,正逆反应速率均加快,故A错误;
B.反应前后气体总质量不变,容器容积不变,容器内气体的密度始终不变,故密度不变不能判断反应是否达到平衡状态,故B错误;
C.其它条件不变,向平衡后的容器中再加入少量N2O4,平衡正向移动,但新平衡后c2(NO2)c(N2O4)=K,温度不变,K值不变,故新平衡后c2(NO2)c(N2O4)的值不变,故C正确;
D.增大体系的压强,N2O4的反应速率加快,平衡逆向移动,N2O4的平衡转化率减小,故D错误;
故选:C。
A.升温,反应速率加快;
B.结合公式ρ=mV判断;
C.温度不变,平衡常数不变;
D.加压,反应速率加快,平衡向气体分子数减小的方向移动。
本题考查化学反应速率和化学平衡,题目难度中等,掌握外界条件改变对化学反应速率和化学平衡的影响是解题的关键。
8.【答案】C
【解析】解:A.“浸取”时适量增加硫酸的浓度,氢离子浓度增大,可加快化学反应速率,故A正确;
B.加Zn过量,会导致过滤所得的滤渣中有Zn,加硝酸溶解后会在硝酸铜中混有Zn(NO3)2杂质,故B正确;
C.铁离子的氧化性大于铜离子的氧化性,则Zn先与三价铁离子反应,再与铜离子反应,若将铜离子转化为铜单质,则三价铁离子一定完全反应,滤液Ⅱ中不存在Fe3+,故C错误;
D.硝酸易挥发,且加热促进铜离子水解,则Cu(NO3)2溶液在稀硝酸中蒸发浓缩、冷却结晶、过滤得到Cu(NO3)2⋅3H2O,故D正确;
故选:C。
由制备流程可知,黄铜灰渣加硫酸浸取,铜不与硫酸反应,Zn、CuO、ZnO及少量FeO、Fe2O3均与硫酸反应,过滤分离出滤渣I为Cu,滤液含硫酸锌、硫酸铜、硫酸亚铁、硫酸铁,滤液中加入适量的Zn将溶液中的铜置换出来,过滤得到铜单质,将两次过滤得到的铜单质溶于硝酸生成硝酸铜,滤液Ⅱ含硫酸锌、硫酸亚铁,以此来解答。
本题考查物质的制备实验,为高频考点,把握物质的性质、发生的反应、混合物的分离提纯为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
9.【答案】B
【解析】解:A.X含有饱和碳原子,具有甲烷的结构特征,则所有的碳原子不可能处于同一平面,故A错误;
B.连接4个不同的原子或原子团的碳原子为手性碳原子,X中六元环中连接支链的C为手性碳原子,Z中连接苯环和双键的碳原子为手性碳原子,则X、Z分子中均含有2个手性碳原子,故B正确;
C.Z中含有碳碳双键和酚羟基,可分别与溴发生加成反应、取代反应,则1molZ最多只能与3molBr2发生反应,故C错误;
D.X含有醇羟基,与氢氧化钠溶液不反应,故D错误。
故选:B。
A.X含有饱和碳原子,具有甲烷的结构特征;
B.X中六元环中连接支链的C为手性碳原子,Z中连接苯环和双键的碳原子为手性碳原子;
C.Z中含有碳碳双键和酚羟基,可分别与溴发生加成反应、取代反应;
D.X与氢氧化钠溶液不反应。
本题考查有机物的结构与性质,为高频考点,侧重考查学生的分析能力,把握有机物官能团与性质的关系为解答的关键,难点不大。
10.【答案】C
【解析】解:A.原电池和电解池工作时,电子由负极(a)经外电路流向阴极(Y),由阳极(X)经外电路回流到正极(b),故A正确;
B.Y极为阴极,电极反应式为O2+2e−+2H+=2H2O2,故B正确;
C.酸性较弱,Fe3+生成氢氧化铁沉淀,故C错误;
D.由反应Fe2++H2O2+H+=Fe3++⋅OH可知,当乙池中产生1mol羟基自由基时,消耗1mol过氧化氢,电路中转移2mol电子,由电荷守恒可知,甲池中有2molH+从M室移动到N室,故D正确;
故选:C。
由图可知,甲为燃料电池,b极氧元素价态降低得电子,电极反应式为O2+4e−+4H+=2H2O,a极为负极,乙为电解池,X极为阳极,Y极为阴极,电极反应式为O2+2e−+2H+=2H2O2,据此作答。
本题考查原电池原理和电解池原理,题目难度中等,能依据图象和题目信息准确判断正负极和阴阳极是解题的关键。
11.【答案】C
【解析】解:A.由图可知,温度升高,lgK1减小,则平衡常数K1减小,说明温度升高,平衡逆向移动,逆向吸热,正向放热,a1.33时,比值越大CuCl产率越小,
故答案为:随着n(Na2SO3):n(CuSO4)不断增大,溶液的碱性不断增强,Cu2+的水解程度增大;
③当1.0
相关试卷
这是一份15,江苏省徐州市第七中学2023-2024学年高一上学期9月月考化学试卷,共8页。
这是一份全国高中学生化学竞赛(决赛)理论试题14版,共7页。
这是一份安徽省宣城市泾县重点中学2022-2023学年高一下学期竞赛选拔化学试题含解析,共19页。试卷主要包含了单选题等内容,欢迎下载使用。









