







人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率教学课件ppt
展开人教版化学选修一
《活化能》教学设计
课题名 | 活化能 |
教学目标 | 1.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响;知道催化剂可以改变反应历程,能从调控化学反应速率的角度分析和选择反应条件。 2. 能用简单碰撞理论说明反应条件对化学反应速率的影响,体会理论模型的建构过程,强化模型认知意识。 |
教学重点 | 用简单碰撞理论说明反应条件对化学反应速率的影响 |
教学难点 | 用简单碰撞理论说明反应条件对化学反应速率的影响 |
教学准备 | 教师准备:课件、例题 学生准备:复习影响化学反应速率的因素 |
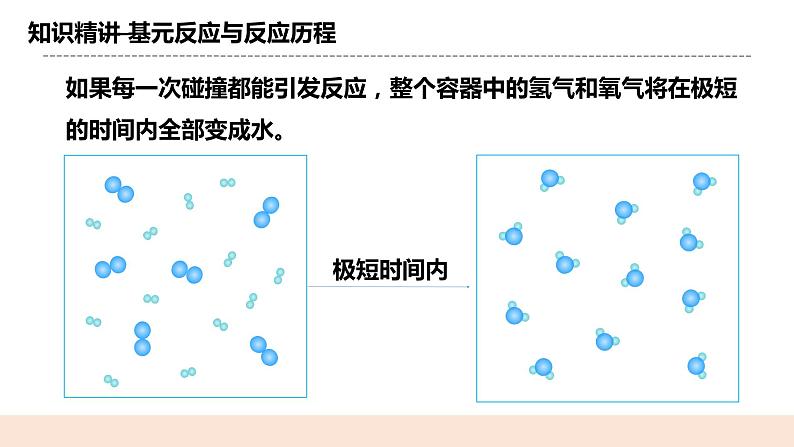
教学过程 | 一. 新课导入 提问: Q1:化学反应的本质是什么? 反应物中旧化学键的断裂,生成物中新化学键的形成 Q2:分子间发生化学反应的必要条件是什么? 分子相互碰撞是引发反应的必要条件。 二.知识精讲 (一) 基元反应与反应历程 设置疑问:如果每一次碰撞都能引发反应,整个容器中的氢气和氧气将在极短的时间内全部变成水。 解析:大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。 例:2HI=H2+I2,实际上是经过下列两步反应完成的: 基元反应→2HI→H2+2I∙ 反应历程 基元反应→2I∙→I2 或反应机理 概念:1.每一步反应称为基元反应 2.基元反应发生的先决条件是反应物的分子必须发生碰撞 3. 自由基:带有单电子的原子或原子团叫自由基。 如 I·自由基、O·自由基。 自由基反应活性很强,寿命极短。 总结:①反应不同,反应历程也不相同 ②同一反应,在不同条件下,反应历程也可能不同 ③反应历程的差别造成了化学反应速率的不同 ④对于由多个基元反应组成的化学反应,其反应的快慢由最慢的一步基元 反应决定
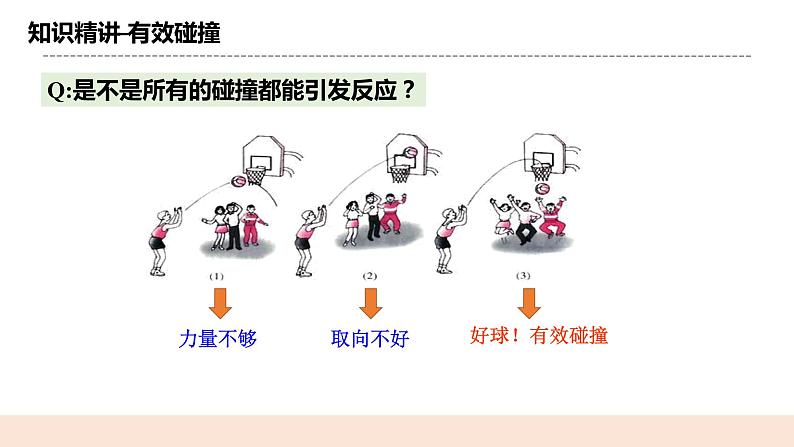
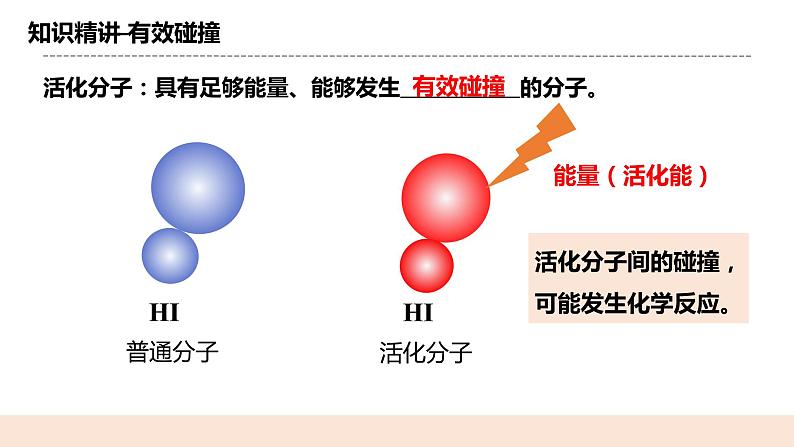
(二)有效碰撞 提问:是不是所有的碰撞都能引发反应? 举例解析: 引入概念:活化分子 活化分子:具有足够能量、能够发生有效碰撞的分子。 概念:1.有效碰撞的概念:能发生化学反应的碰撞称为有效碰撞。 2.有效碰撞必须满足的条件: (1)分子具有足够的能量;(即活化分子) (2)分子在碰撞时具有合适的取向。 3.有效碰撞与反应速率的关系: 有效碰撞的频率越高,则反应速率越快。
(三)活化能 活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差
(四)有效碰撞理论对影响化学反应速率因素的解释 1.浓度
反应物浓度增大 → 反应物中活化分子百分数不变→ 单位体积内活化分子总数增多 → 单位时间内有效碰撞次数增多 → 反应速率增大; 2.压强
增大压强(压缩体积) → 反应物中活化分子百分数不变 → 单位体积内活化分子总数增多 → 单位时间内有效碰撞次数增多 → 反应速率增大 3.温度
升高温度 → 活化分子百分数增多 → 单位体积内分子总数不变 → 活化分子总数增多→ 单位时间内有效碰撞次数增多 → 反应速率增大; 4.催化剂
加入催化剂 → 活化分子百分数增多 → 单位体积内活化分子总数增多 → 单位时间内有效碰撞次数增多 → 反应速率增大;
(五)化学反应的速率常数和速率方程 1. 化学反应速率通常指一定时间内反应的平均速率。 2. 在化学反应进程中,未达平衡时,瞬时反应速率一般是不断变化的。 3. 对于基元反应,化学反应速率通常与各反应物浓度的幂之积成正比。 4. 速率常数和速率方程 对于反应: aA + bB + … → 产物 速率方程为 v = k·cx(A)·cy(B)·… ,式中的 k 称为速率常数。
三、课堂小结
四、随堂练习 例1:(1)增大反应物的浓度使反应速率加快的主要原因( ) (2)对于气体参与体系增大压强使反应速率加快的主要原因是( ) (3)升高温度使反应速率加快的主要原因是( ) (4)使用催化剂使反应速率加快的主要原因是( ) A.活化分子百分数不变,但提高单位体积内活化分子的总数 B.增大分子的运动速率而使有效碰撞增加 C.升高反应物分子的能量,使活化分子的百分数增加 D.降低反应所需的能量,使活化分子百分数增加 例2:如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列说法正确的是 A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的催化剂 B.升高温度,活化分子的百分数不变,但反应速率加快 C.增大Cl2的浓度,可提高反应速率,但不影响△H的大小 D.第一步反应的速率大于第二步反应
|
布置作业 | 化学课时作业《活化能》 |
板书设计 | 活化能 一.基元反应与反应历程 二.活化分子 三.有效碰撞 1.有效碰撞的概念:能发生化学反应的碰撞称为有效碰撞。 2.有效碰撞必须满足的条件: (1)分子具有足够的能量;(即活化分子) (2)分子在碰撞时具有合适的取向。 四.有效碰撞理论对影响化学反应速率因素的解释 五.化学反应的速率常数和速率方程 1.速率常数和速率方程 对于反应: aA + bB + … → 产物 速率方程为 v = k·cx(A)·cy(B)·… ,式中的 k 称为速率常数。
|
教学反思 | 本节课内容较为抽象,教师在教学中应重视学生核心素养的体香,帮助学生体会理论模型的构建过程,帮助学生感受宏观状态和微观解释之间联系。 |
高中人教版 (2019)第一节 化学反应速率说课课件ppt: 这是一份高中人教版 (2019)第一节 化学反应速率说课课件ppt,文件包含人教版化学选择性必修一213活化能课件pptx、有效碰撞活化分子和活化能mp4、活化能的动画解释mp4等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
化学第三节 金属的腐蚀与防护教学ppt课件: 这是一份化学第三节 金属的腐蚀与防护教学ppt课件,文件包含人教版化学选修一432《金属的防护》课件pptx、人教版化学选修一432《金属的防护》教学设计docx等2份课件配套教学资源,其中PPT共17页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池教学ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池教学ppt课件,文件包含人教版化学选修一421《电解原理》课件pptx、人教版化学选修一421《电解原理》教学设计docx等2份课件配套教学资源,其中PPT共19页, 欢迎下载使用。














