
2021汪清四中高一第二学期第一次阶段考试化学试卷含答案
展开www.ks5u.com汪清四中2020-2021学年度第二学期
高一年级化学学科第一次阶段考试试题
时间:90分 总分:100分
常用原子量:H:1 C:12 O:16 N:14 S:32 Fe:56 Cu:64 Zn:65
一、单选题(1-10小题每题2分,共20分)
1.为了检验某固体物质中是否含有,下列试纸和试剂组合正确的是( )
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀
A.①③ B.④⑤ C.①②③ D.①④⑤
2. 如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )。
选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸挥发出的HCl反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
3. 石英砂(主要成分为SiO2)是一种常用工业原料,其中常混有少量碳酸钙。要除去石英砂中的少量碳酸钙,应采用的方法是( )。
A.用水溶解后过滤分离
B.用稀硫酸溶解后过滤分离
C.用酒精灯加热
D.用稀盐酸溶解后过滤分离
4.空气污染已成为人类社会面临的重大威胁。下列气体不属于大气污染物的是( )
A.NO B. C.CO D.
5.以下关于铜跟浓、稀反应的说法中错误的是( )
A.1mol浓被还原转移2mol电子
B.Cu与浓反应比与稀反应剧烈
C.Cu与浓、稀反应都不需要加热
D.生成等量的,消耗浓的量多
6.下列有关浓硝酸的说法不正确的是( )
A.实验室常用浓硝酸与金属锌反应制备氢气
B.常温下浓硝酸能使金属铝钝化
C.浓硝酸不稳定,见光易分解,需要避光保存
D.浓硝酸易挥发,打开瓶塞,瓶口有白雾产生
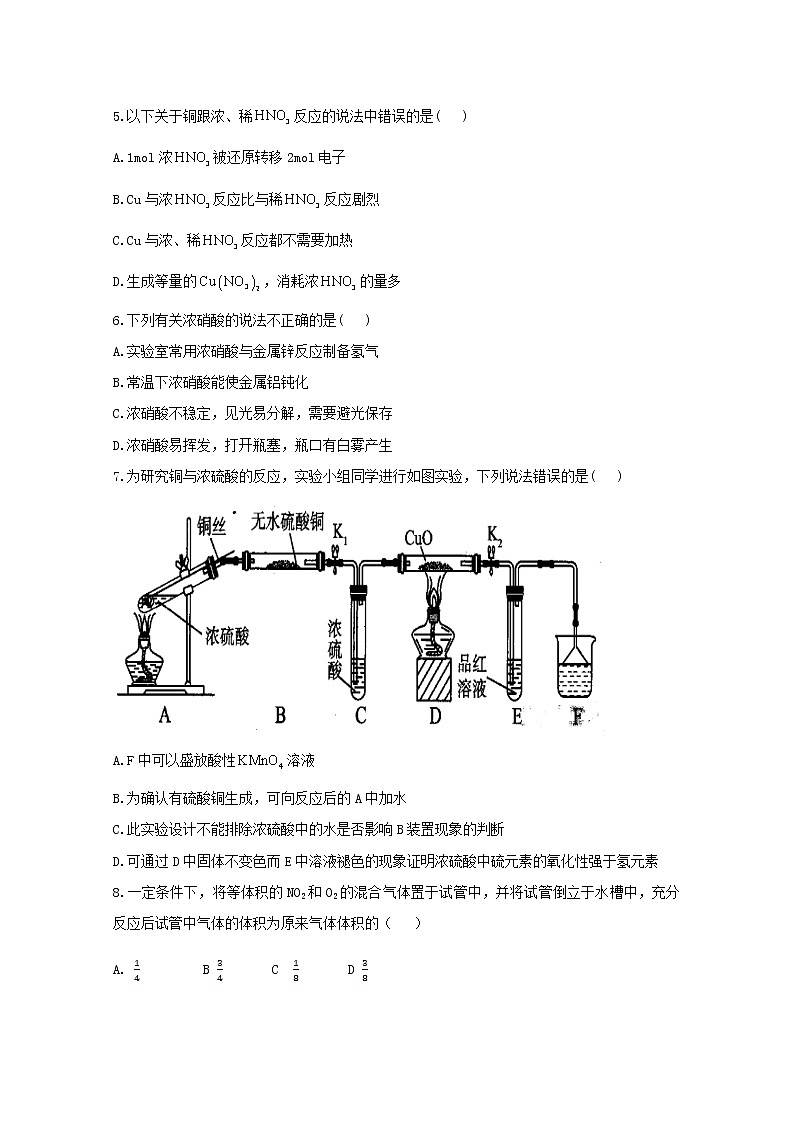
7.为研究铜与浓硫酸的反应,实验小组同学进行如图实验,下列说法错误的是( )
A.F中可以盛放酸性溶液
B.为确认有硫酸铜生成,可向反应后的A中加水
C.此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断
D.可通过D中固体不变色而E中溶液褪色的现象证明浓硫酸中硫元素的氧化性强于氢元素
8.一定条件下,将等体积的NO2和O2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后试管中气体的体积为原来气体体积的( )
A. B C D
9.把硫和强碱(如NaOH)加热至沸,反应后,硫转化为和,则反应的S和生成的、的物质的量之比为( )
A.2:1:1 B.3:2:1 C.3:1:2 D.4:1:3
10.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
A.该过程中可得到化工产品
B.该工艺流程目的是除去煤中的
C.该过程中化合价发生改变的元素有Fe、O和S
D.图中涉及的反应之一为Fe2(SO4)3 +SO2 + 2H2O=2FeSO4+2H2SO4
二、单选题(11-20题每小题3分,共30分)
11.将过量的金属锌投入热浓硫酸中,下列判断正确的是( )
A. 金属锌表面因生成致密氧化膜而不反应B. 会立即生成
C. 会立即生成,且只生成 D. 除了外,还会有产生
12.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.在Z导管出来的气体中没有二氧化碳
D.在Z导管口排出无色气体
13过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几 个实验步骤,可制得纯净的食盐水:①加入稍过量的 Na2CO3溶液;②加入稍过量的NaOH溶液;③加人稍 过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是( )
A.③②①⑤④ B. ①②③⑤④ C.②③①④⑤ D.③⑤②①④
14检验某未知溶液中是否含有,下列操作最合理的是( )
A.加入稀HNO3酸化的Ba(NO3)2溶液
B.先加稀盐酸酸化,再滴加BaCl2溶液
C.加入稀HNO3酸化的BaCl2溶液
D.先用稀HNO3酸化,再滴加Ba(NO3)2溶液
15.在实验探究课上,同学们积极思考,设计出如图所示的四种实验装置用以验证浓硫酸的吸水性,其中在理论上可行的是( )
A.①②③④ B.①③④ C.①②④ D.②③④
16.下列过程中,发生吸热反应的是( )
A.碘的升华 B.生石灰溶于水
C. 与 D.盐酸和氢氧化钠溶液混合
17.在某一化学反应中,反应物Q的浓度在20s内从1.8mol/L变为0.4mol/L,则在这20s内Q的化学反应速率为( )
A.0.035mol/L B.0.035mol/(L·s) C.0.07mol/L D.0.07mol/(L·s)
18.反应A+3B=2C+4D在四种不同情况下的反应速率如下,大小顺序为( )
①ν(A)=1.5mol/(L·min) ②ν(B)=0.08mol/(L·s)
③ν(C)=1.5mol/(L·s) ④ν(D)=4.0mol/(L·min)
A.①>②>③>④ B. ④>①>③>② C. ②>①>③>④ D. ③>②>①>④
19.把下列四种X溶液分别加入四个盛有10mL,2mol/L盐酸的烧杯中,加水稀释到50mL,此时,X与盐酸缓慢地进行反应,其中反应最快的是( )
A.10℃ 20 mL,3mol/L的X溶液
B.20℃ 30 mL,2mol/L的X溶液
C.10℃ 30 mL,2mol/L的X溶液
D.20℃ 10mL,3mol/L的X溶液
20.某学生用如图所示装置进行化学反应能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处下降、乙处上升。下列关于该反应的叙述中正确的是( )
① 该反应为放热反应 ②该反应为吸热反应 ③生成物的总能量比反应物的总能量高 ④反应物的总能量比生成物的总能量高 ⑤该反应过程可以看成是“贮存”于X、Y内部的部分能量转化为热能形式释放出来
A.①④⑤ B.①④ C.①③ D.②③⑤
三、填空题
21(10分)我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
(1)④步所加试剂是___________。
(2)第⑥步发生反应的离子方程式为__________、__________。
(3)第⑦步的操作名称_________,需要的玻璃仪器有__________、__________。
(4)通过步骤⑤中过滤后的滤液,检验已除尽的操作方法是______________。
22(10分)下图是自然界不同价态的硫元素之间的转化关系图,利用有关知识回答下列问题:
(1)石膏的化学式为__________;芒硝在浓硫酸中失水的过程是_________(填“化学”或“物理”)变化。
(2)由图示及有关知识可以推知,中Fe的化合价为_________;雄黄和雌黄中S的含量较高的是:__________(填名称)。
(3)框中物质中属于电解质的是__________,属于非电解质的是__________。
(4)利用凝聚法,将气体通入稀溶液中能够得到S胶体,该反应的化学方程式为______________;验证得到胶体的常用方法为__________。
23(20分).(Ⅰ)亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有________________,反应的现象是________________,反应的离子方程式为________________ __________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有________________,看到的现象是________________,反应的化学方程式为_______________ ________。
(Ⅱ)某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为__________________________________________;
(2)实验过程中,装置B、C中发生的现象分别是________________、________________,这些现象分别说明SO2具有的性质是________和________;装置B中发生反应的离子方程式为______________________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象__________________________________________; _________________________________________;
(4)尾气可采用________溶液吸收。
24(10分)甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成有关问题的解答。
1.甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2g铜。
①请写出铜与稀硝酸反应的离子反应方程式:__________
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有__________
③若a中液体为浓硝酸,则仪器c中收集的气体主要是__________(填化学式)。
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,生成沉淀的质量是__________g
2.乙组同学对铁与稀硝酸的反应进行探究。他们用a mol Fe和含有b mol HNO3的稀硝酸进行实验, 若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。
① 反应结束后溶液中NO3-的物质的量的取值范围是__________(用含a的代数式表示)。
② 若反应结束后的溶液中Fe3+、Fe2+的物质的量之比[n(Fe3+):n(Fe2+)]为3:1,则b:a的值为__________。
汪清四中2020-2021学年度第二学期高一年级化学学科第一次阶段考试答案
一、单选题:1~5 C A D B A 6~10 A B D B B
二、选择题:11~15 D B A B A 16~20 C D D B A
三、填空题:
21(10分)(1)Na2CO3
(2) H+ + OH- = H2O CO32- + 2H+ = CO2 + H2O
(3) 蒸发结晶 玻璃棒、酒精灯
(4)取少量的滤液于试管中,滴加盐酸酸化溶液,若没有现象,说明已除尽
22(10分)(1) ; 化学
(2)+2 ; 雌黄
(3) ;
4);利用丁达尔效应或用激光笔照射液体,可以看到 光亮的“通路”
23(20分)
Ⅰ(1)溴水;溴水退色 Br2 + Na2SO3 +H2O = 2HBr + Na2SO4
(2) Na2S溶液和稀硫酸 有淡黄色沉淀产生
2Na2S + Na2SO3 +3 H2SO4 = 3S + 3H2O + 3 Na2SO4
Ⅱ (1)圆底烧瓶 Na2SO3 + H2SO4 = SO2 + H2O + Na2SO4
(2)B中酸性KMnO4溶液退色,C中产生淡黄色沉淀;还原性 氧化性;
5 SO2 + 2 MnO4- +2H2O = 5SO42- +2Mn2+ + 4H+
(3)品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色。
(4)NaOH
24(10分)(1).①3Cu+8H++2=3Cu2++2NO↑+4H2 ②酸性和强氧化性 ③NO ④4.9
2. ①2a mol<n() <3a mol ②
2021汪清四中高二第二学期第一次阶段考试化学试卷含答案: 这是一份2021汪清四中高二第二学期第一次阶段考试化学试卷含答案
2021衡水十四中高一下学期二调考试化学试卷含答案: 这是一份2021衡水十四中高一下学期二调考试化学试卷含答案,共13页。试卷主要包含了请将答案正确填写在答题卡上,B【解析】A等内容,欢迎下载使用。
2021汪清四中高二下学期第二阶段考试化学试卷含答案: 这是一份2021汪清四中高二下学期第二阶段考试化学试卷含答案,共10页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。












