衡水金卷先享题考前悟题——新高考 考前悟题 化学
展开A.EIDD-1931的分子式为C8H11O6N3
B.EIDD-2801分子中所有的碳原子可能共面
C.该转化反应属于取代反应,其另一种产物为
D.EIDD-2801和EIDD-1931均能使酸性K2Cr2O7溶液变为无色
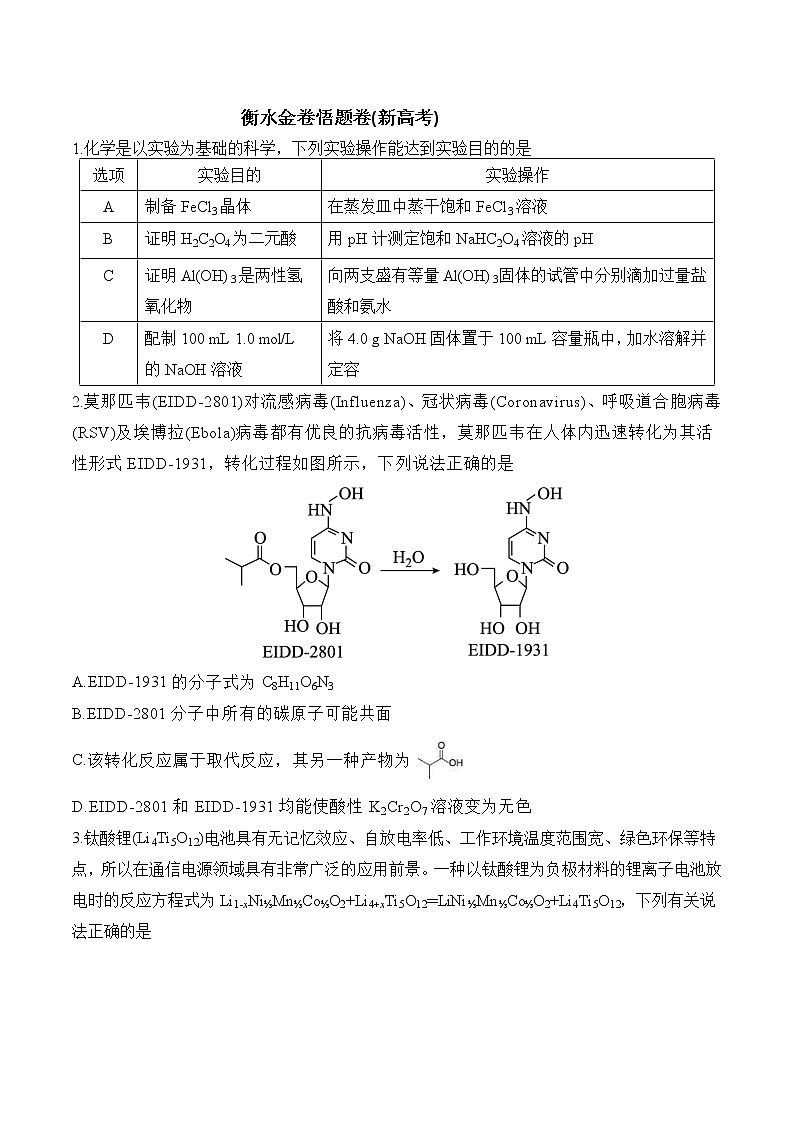
3.钛酸锂(Li4Ti5O12)电池具有无记忆效应、自放电率低、工作环境温度范围宽、绿色环保等特点,所以在通信电源领域具有非常广泛的应用前景。一种以钛酸锂为负极材料的锂离子电池放电时的反应方程式为Li1-xNi⅓Mn⅓C⅓O2+Li4+xTi5O12═LiNi⅓Mn⅓C⅓O2+Li4Ti5O12,下列有关说法正确的是
A.图示为该电池放电时的工作原理示意图
B.放电时,当外电路转移0.2 ml电子时,理论上负极质量增加1.4 g
C.放电时,负极的电势高于正极的电势
D.充电时,阳极的电极反应式为LiNi⅓Mn⅓C⅓O2-xe-═Li1-xNi⅓Mn⅓C⅓O2+xLi+
4.(14分)
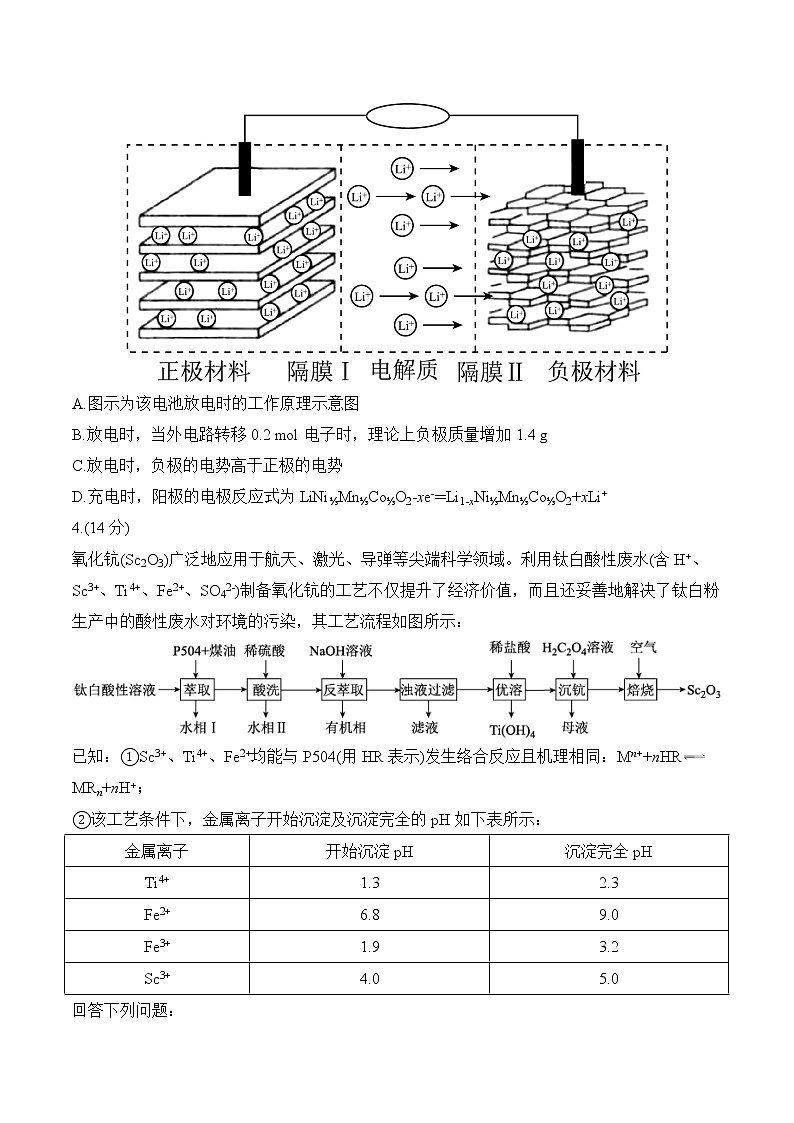
氧化钪(Sc2O3)广泛地应用于航天、激光、导弹等尖端科学领域。利用钛白酸性废水(含H+、Sc3+、Ti4+、Fe2+、SO42-)制备氧化钪的工艺不仅提升了经济价值,而且还妥善地解决了钛白粉生产中的酸性废水对环境的污染,其工艺流程如图所示:
已知: = 1 \* GB3 ①Sc3+、Ti4+、Fe2+均能与P504(用HR表示)发生络合反应且机理相同:Mn++nHRMRn+nH+;
②该工艺条件下,金属离子开始沉淀及沉淀完全的pH如下表所示:
回答下列问题:
(1)萃取相比(O/W)指的是萃取时有机相与被萃取的酸性废水的体积比。“萃取”工序中萃取相比与Sc3+的萃取率如下表所示:
则该工序中应选择的适宜O/W是 ,O/W高于此值的缺点是 。
(2)水相Ⅱ的主要成分为FeSO4和少量Ti(SO4)2,则Sc3+、Ti4+、Fe2+三种离子中与P504络合能力最强的是 (填离子符号),其络合机理为 (用离子方程式表示)。
(3)“反萃取”工序中加入NaOH溶液的目的为 ,“浊液过滤”工序中所得滤液中溶质的主要成分为 (填化学式)。
(4)“优溶”工序中加入盐酸时应调节溶液的pH范围为 。
(5)“沉钪”工序中得到的Sc2(C2O4)3·6H2O在“焙烧”工序中反应时,焙烧温度区间和其得到的固体产物如下表所示:
化合物A的化学式为 ,由B生成C的化学方程式为 。
5.(14分)
利用限域催化原理高选择性地将合成气直接制乙烯和丙烯的工业,因具有流程短、能耗低的优势,具有广阔的应用前景。其制备反应分别如下:
反应Ⅰ.2CO(g)+4H2(g)CH2=CH2(g)+2H2O(g) ΔH1=-231 kJ·ml-1;
反应Ⅱ.3CO(g)+6H2(g)CH3CH=CH2(g)+3H2O(g) ΔH2=-384 kJ·ml-1。
回答下列问题:
(1)已知相关化学键的键能数据如下表所示,则根据反应Ⅰ进行计算可知表中的x= 。
(2)已知ln K=(R、C均为常数),反应Ⅰ、Ⅱ的平衡常数与温度T的变化关系如图所示,其中表示反应Ⅰ的是曲线 (填“L1”或“L2”)。
(3)623 K时,向体积为1 L的刚性密闭容器中充入1 ml CO、2 ml H2,在催化剂的作用下同时发生反应Ⅰ和反应Ⅱ。达到平衡时C2H4的物质的量分数为,CO的平衡转化率为80%。
①平衡时,H2的物质的量浓度为 ;CH3CH=CH2(g)的物质的量分数为 。
②623 K时,反应Ⅱ的平衡常数K= 。
③其他条件不变,若向上述平衡体系中再充入少量氩气,则反应Ⅰ的v正 v逆(填“>”“<”或“=”)。
(4)在723 K、p=100 kPa、n(H2)∶n(CO)为2∶1的条件下,经过相同反应时间(未达平衡)测得如下实验数据:
注:乙烯的选择性=×100%
则在该条件下制备乙烯,适宜选择的催化剂为 ,理由为 。
参考答案及解析
1.B【解析】FeCl3溶液受热易水解生成Fe(OH)3,蒸干饱和FeCl3溶液无法制得FeCl3晶体,A项错误;用pH计可测得饱和NaHC2O4溶液呈酸性,说明HC2O4-的电离程度大于其水解程度,可证明H2C2O4为二元酸,B项正确;Al(OH)3不溶于氨水,实验操作无法证明Al(OH)3是两性氢氧化物,C项错误;配制溶液时,固体的溶解不能在容量瓶中进行,D项错误。
2.C【解析】由EIDD-1931的结构简式可知,其分子式为C9H13O6N3,A项错误;EIDD-2801分子中含有结构,故所有的碳原子不可能共面,B项错误;EIDD-2801转化为EIDD-1931的反应属于酯的水解反应,属于取代反应,另一种产物为2-甲基丙酸,C项正确;EIDD-2801和EIDD-1931中均含有羟基,均能被酸性K2Cr2O7溶液氧化,但还原产物Cr3+呈绿色,D项错误。
3.D【解析】由Li+移动方向可知,题给图示为该电池充电时的工作原理示意图,A项错误;放电时,负极的电极反应式为Li4+xTi5O12-xe-═Li4Ti5O12+xLi+,负极质量减小,B项错误;放电时,负极的电势低于正极的电势,C项错误;充电时,左侧电极为阳极,电极反应式为LiNi⅓Mn⅓C⅓O2-xe-═Li1-xNi⅓Mn⅓C⅓O2+xLi+,D项正确。
4.(14分)
(1)1∶20(1分) 萃取剂使用量大,增大生产成本(1分,其他合理答案也给分)
(2)Sc3+(2分) Sc3++3HRScR3+3H+(1分)
(3)将ScR3、TiR4转化为不溶于P504有机相的Sc(OH)3和Ti(OH)4(2分) NaR(1分)
(4)2.3≤pH<4.0(2分)
(5)Sc2(C2O4)3·H2O(2分) 2Sc2(C2O4)3+3O22Sc2O3+12CO2(2分)
【解析】(1)由表中数据可知,O/W小于1∶20,Sc3+的萃取率低;当O/W大于等于1∶20,Sc3+的萃取率相同,但有机相使用量大,增大生产成本,因此“萃取”工序中应选择的适宜O/W是1∶20。
(2)由已知①可知,Sc3+、Ti4+、Fe2+三种离子均能与HR发生络合反应,Sc3+的络合机理为Sc3++3HRScR3+3H+;由水相Ⅱ的主要成分为FeSO4和少量Ti(SO4)2 可知,“酸洗”工序是将FeR2和部分TiR4从有机相中去除,故与P504络合能力最强的离子是Sc3+。
(3)结合后续的工序可知,“反萃取”工序中加入NaOH溶液的目的为将ScR3、TiR4转化为不溶于P504有机相的Sc(OH)3和Ti(OH)4 ;“浊液过滤”工序中所得滤液中溶质的主要成分为NaR。
(4)“优溶”工序中加入稀盐酸的目的是调节溶液的pH使Sc(OH)3溶解,但不能使Ti(OH)4溶解,由已知②可知,应调节溶液的pH范围为2.3≤pH<4.0。
(5)根据题给表格数据可知,Sc2(C2O4)3·6H2O的相对分子质量为462,设初始有1 ml Sc2(C2O4)3·6H2O,在383~423 K时失重率为19.48%,失重质量为462 g×19.48%≈90 g,即失去了5 ml H2O,则化合物A的化学式为Sc2(C2O4)3·H2O;在463~508 K时失重率为23.38%,失重质量为462 g×23.38%≈108 g,即失去了6 ml H2O,则化合物B的化学式为Sc2(C2O4)3;在583~873 K时失重率为70.13%,失重质量为462 g×70.13%≈324 g,剩余质量为2 ml Sc和3 ml O的质量之和,则化合物C的化学式为Sc2O3,故由B生成C的化学方程式为2Sc2(C2O4)3+3O22Sc2O3+12CO2。
5.(14分)
(1)615(2分)
(2)L2(2分)
(3)①0.4 ml/L(2分) (2分)
②1562.5(2分)
③=(1分)
(4)Fe基复合催化剂(1分) 乙烯的产率=CO的转化率×乙烯的选择性,在Fe基复合催化剂下乙烯的产率更高(2分)
【解析】(1)由ΔH1=反应物总键能-生成物总键能=2×1076 kJ·ml-1+4×436 kJ·ml-1-x kJ·ml-1-4×413 kJ·ml-1-4×465 kJ·ml-1=-231 kJ·ml-1,解得x=615。
(2)反应Ⅰ和反应Ⅱ的正反应均为放热反应,升高温度平衡逆向移动,K值减小,即ln K随增大而增大,且反应Ⅰ放热较少,故斜率较小的L2曲线对应反应Ⅰ。
(3)根据题意建立三段式如下:
2CO(g)+4H2(g)CH2=CH2(g)+2H2O(g)
起始(ml): a m 0 0
变化(ml): 2x 4x x 2x
平衡(ml): a-2x m-4x x 2x
3CO(g)+6H2(g)CH3CH=CH2(g)+3H2O(g)
起始(ml): b n 0 0
变化(ml): 3y 6y y 3y
平衡(ml):b-3y n-6y y 3y
CO的转化率为80%,即×100%=80%,a+b=1,所以2x+3y=0.8;再根据乙烯的物质的量分数为,可得,m+n=2,化简得10x+5y=3,联立2x+3y=0.8解得x=0.25、y=0.1。
①平衡时H2的物质的量为2 ml-4x ml-6y ml=0.4 ml,则c(H2)=0.4 ml/L;CH3CH=CH2(g)的物质的量为y ml=0.1 ml,平衡体系中气体的总物质的量为1.75 ml,则CH3CH=CH2(g)的物质的量分数为。
②平衡时,H2O(g)的物质的量浓度为0.8 ml/L,CH3CH=CH2(g)的物质的量浓度为0.1 ml/L,H2(g)的物质的量浓度为0.4 ml/L,CO的物质的量浓度为0.2 ml/L,将数据代入反应Ⅱ的平衡常数表达式=1562.5。
③恒温恒容条件下通入惰性气体,平衡不移动,故反应Ⅰ的正、逆反应速率相等。
(4)由于乙烯的产率=CO的转化率×乙烯的选择性,由表中数据计算可知,在Fe基复合催化剂下乙烯的产率更高,故适宜选用Fe基复合催化剂。选项
实验目的
实验操作
A
制备FeCl3晶体
在蒸发皿中蒸干饱和FeCl3溶液
B
证明H2C2O4为二元酸
用pH计测定饱和NaHC2O4溶液的pH
C
证明Al(OH)3是两性氢氧化物
向两支盛有等量Al(OH)3固体的试管中分别滴加过量盐酸和氨水
D
配制100 mL 1.0 ml/L的NaOH溶液
将4.0 g NaOH固体置于100 mL容量瓶中,加水溶解并定容
金属离子
开始沉淀pH
沉淀完全pH
Ti4+
1.3
2.3
Fe2+
6.8
9.0
Fe3+
1.9
3.2
Sc3+
4.0
5.0
萃取相比(O/W)
1∶10
1∶15
1∶20
1∶25
1∶30
1∶35
1∶40
Sc3+的萃取率/%
95
95
95
83
75
62
58
草酸钪络盐
焙烧温度区间(K)
固体失重百分率(%)
生成的含钪化合物
Sc2(C2O4)3·6H2O
(摩尔质量为462 g/ml)
383~423
19.48
A
463~508
23.38
B
583~873
70.13
C
化学键
C≡O
H—H
H—O
C=C
C—H
键能/kJ·ml-1
1076
436
465
x
413
T(℃)
催化剂
CO的转化率(%)
乙烯的选择性(%)
450
Fe-M-cat
24.1
40.2
450
Fe基复合催化剂
48.3
26.8
衡水金卷先享题考前悟题——新教材新高考化学考前悟题: 这是一份衡水金卷先享题考前悟题——新教材新高考化学考前悟题,共4页。试卷主要包含了旧高考考前悟题第3题,旧高考考前悟题第4题,5 kJ·ml-1;,01 ml CO2和0,3 kJ·ml-1等内容,欢迎下载使用。
2023新高考化学【衡水金卷·先享题·信息卷】模拟试题(辽宁卷)06: 这是一份2023新高考化学【衡水金卷·先享题·信息卷】模拟试题(辽宁卷)06,文件包含39171139_2023新高考化学衡水金卷·先享题·信息卷模拟试题辽宁卷06pdf、39171139_2023新高考化学衡水金卷·先享题·信息卷模拟试题辽宁卷06答案pdf等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。
2023新高考化学【衡水金卷·先享题·信息卷】模拟试题(辽宁卷)04: 这是一份2023新高考化学【衡水金卷·先享题·信息卷】模拟试题(辽宁卷)04,文件包含39171137_2023新高考化学衡水金卷·先享题·信息卷模拟试题辽宁卷04pdf、39171137_2023新高考化学衡水金卷·先享题·信息卷模拟试题辽宁卷04答案pdf等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。