
备战高考错题本电化学
展开电化学
☞易错题查找
【易错题】12. 用铅蓄电池电解CuSO4溶液(如右图)。已知铅蓄电池的总反应为:
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
若电极材料均为石墨,电解一段时间后测得b极附近溶液PH减小,下列说法 正确的是
A.b极为负极
B.利用该池精炼铜,a极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+ SO(aq)+4e-=PbSO4(s)+2H2O(l)
D.当析出6.4gCu时,池中产生气体1.12L(标准状况下)
☞查缺行动
【知识补缺】
1、池型判断
(1)根据概念:原电池是将化学能转化为电能,电解池是将电能转化为化学能。
(2)根据是否有外接电源判断:有的为电解池。
(3)根据可充电电池判断:放电为原电池,充电为电解池。
2、电极方程式的书写
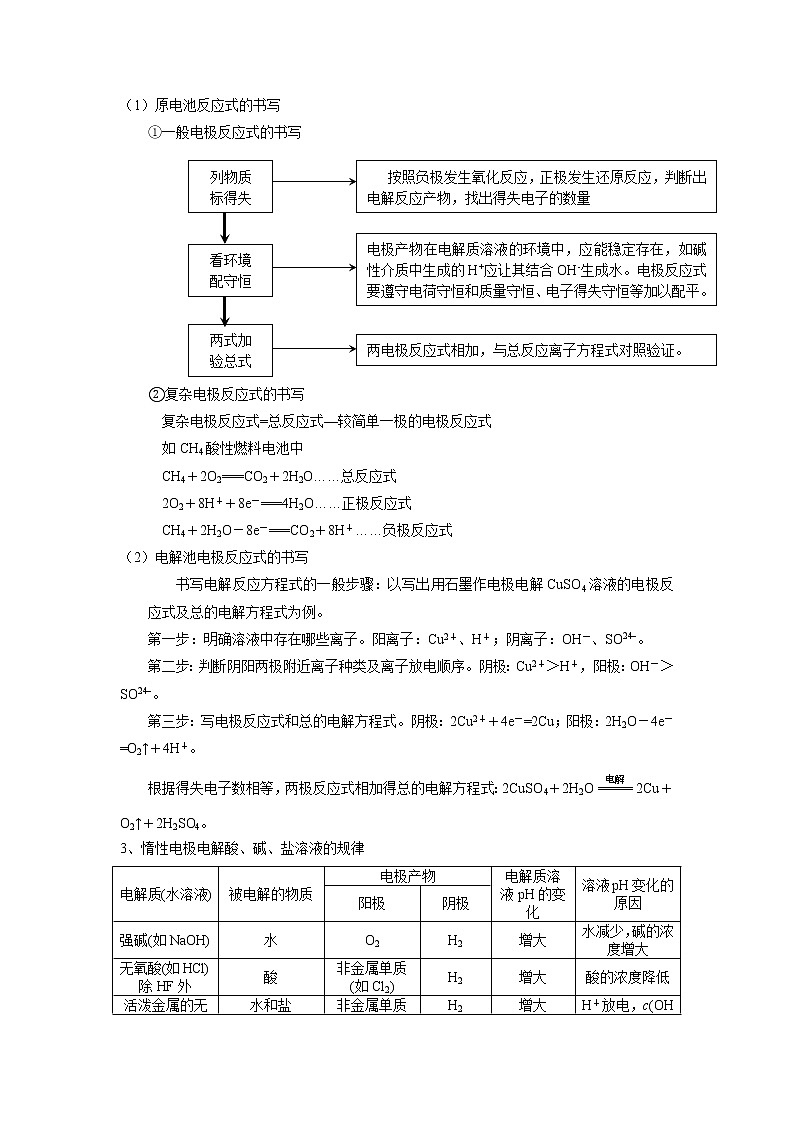
(1)原电池反应式的书写
①一般电极反应式的书写
②复杂电极反应式的书写
复杂电极反应式=总反应式—较简单一极的电极反应式
如CH4酸性燃料电池中
CH4+2O2===CO2+2H2O……总反应式
2O2+8H++8e-===4H2O……正极反应式
CH4+2H2O-8e-===CO2+8H+……负极反应式
(2)电解池电极反应式的书写
书写电解反应方程式的一般步骤:以写出用石墨作电极电解CuSO4溶液的电极反应式及总的电解方程式为例。
第一步:明确溶液中存在哪些离子。阳离子:Cu2+、H+;阴离子:OH-、SO。
第二步:判断阴阳两极附近离子种类及离子放电顺序。阴极:Cu2+>H+,阳极:OH->SO。
第三步:写电极反应式和总的电解方程式。阴极:2Cu2++4e-=2Cu;阳极:2H2O-4e-=O2↑+4H+。
根据得失电子数相等,两极反应式相加得总的电解方程式:2CuSO4+2H2O2Cu+O2↑+2H2SO4。
3、惰性电极电解酸、碱、盐溶液的规律
电解质(水溶液) | 被电解的物质 | 电极产物 | 电解质溶液pH的变化 | 溶液pH变化的原因 | |
阳极 | 阴极 | ||||
强碱(如NaOH) | 水 | O2 | H2 | 增大 | 水减少,碱的浓度增大 |
无氧酸(如HCl)除HF外 | 酸 | 非金属单质(如Cl2) | H2 | 增大 | 酸的浓度降低 |
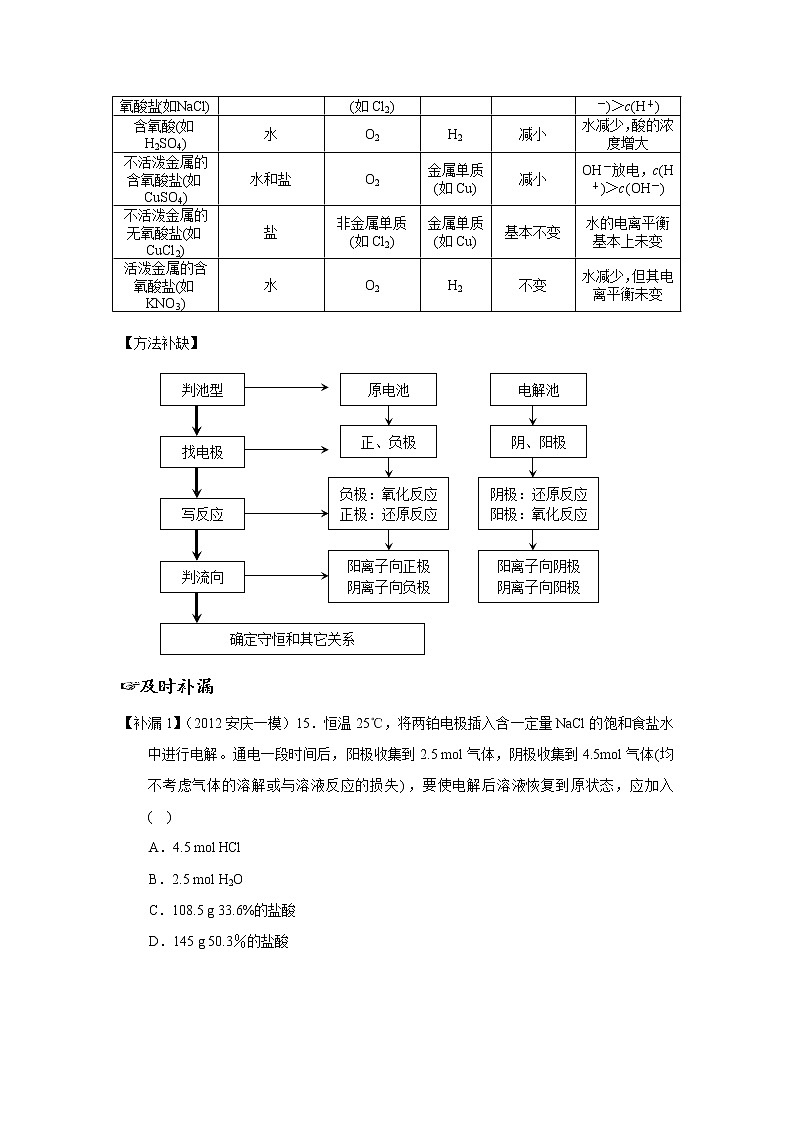
活泼金属的无氧酸盐(如NaCl) | 水和盐 | 非金属单质(如Cl2) | H2 | 增大 | H+放电,c(OH-)>c(H+) |
含氧酸(如H2SO4) | 水 | O2 | H2 | 减小 | 水减少,酸的浓度增大 |
不活泼金属的含氧酸盐(如CuSO4) | 水和盐 | O2 | 金属单质(如Cu) | 减小 | OH-放电,c(H+)>c(OH-) |
不活泼金属的无氧酸盐(如CuCl2) | 盐 | 非金属单质(如Cl2) | 金属单质(如Cu) | 基本不变 | 水的电离平衡基本上未变 |
活泼金属的含氧酸盐(如KNO3) | 水 | O2 | H2 | 不变 | 水减少,但其电离平衡未变 |
【方法补缺】
☞及时补漏
【补漏1】(2012安庆一模)15.恒温25℃,将两铂电极插入含一定量NaCl的饱和食盐水中进行电解。通电一段时间后,阳极收集到2.5 mol气体,阴极收集到4.5mol气体(均不考虑气体的溶解或与溶液反应的损失),要使电解后溶液恢复到原状态,应加入 ( )
A.4.5 mol HCl
B.2.5 mol H2O
C.108.5 g 33.6%的盐酸
D.145 g 50.3%的盐酸
【补漏3】(2011·浙江理综,10)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如右图所示。导致该现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )。
A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-===4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:
Cu-2e-===Cu2+
【补漏5】(2013山东临沂期末)有关右图装置的叙述中,正确的是
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐 蚀,这种方法称为外接电源的阴极保护法
B.若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变
C.若X为银棒,Y为硝酸银溶液,开关K置于N处,铁棒质量将增加,溶液中银离子浓度将减小
D.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铁电极移动
备战高考错题本化学实验基本操作: 这是一份备战高考错题本化学实验基本操作,共6页。学案主要包含了易错题2,知识补缺,方法补缺,考点定位,错因分析等内容,欢迎下载使用。
备战高考错题本离子方程式的书写及判断: 这是一份备战高考错题本离子方程式的书写及判断,共6页。学案主要包含了知识补缺,方法补缺,易错点分析,考点定位等内容,欢迎下载使用。
备战高考错题本有机化学答题规范: 这是一份备战高考错题本有机化学答题规范,共10页。学案主要包含了标准答案,知识补缺,方法补缺,解题模板,考点定位,答题规范提示等内容,欢迎下载使用。












