所属成套资源:2022年高三二轮复习考点突破试卷
高考化学二轮复习考案:18专题十八《物质结构与性质》(选修)
展开
这是一份高考化学二轮复习考案:18专题十八《物质结构与性质》(选修),共6页。
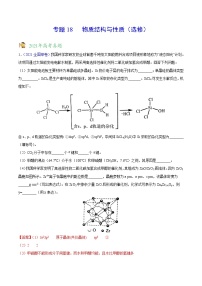
专题十八 物质结构与性质(选修) 【专题考案】1.下列性质比较正确的是( ) A.离子半径: K+>Cl->Na+>F- B.酸性: HClO4>H3PO4>H2S>H3AlO3C.还原性: Cl->Br->I->S2- D.沸点: 甲醛>甲醇>甲烷2.在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图)。该晶体可能为: A.NaCl B.CsCl C.CO2 D.SiO2 3.下列有关物质的性质比较,不正确的是A.熔点:Li>Cs B.还原性:F>IC.热稳定性:H2O>H2S D.酸性:H3PO4>H3AsO44.若不断地升高温度,实现"雪花→水→水蒸气→氧气和氢气"的变化。在变化的各阶段被破坏的粒子间主要的相互作用依次是A.氢键;分子间作用力;非极性键 B.氢键;氢键;极性键C.氢键;极性键;分子间作用力 D.分子间作用力;氢键;非极性键5.下面图像是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的是 ① ② ③ ④ A.①和④ B.②和③ C.①和③ D.只有①6.观察下列模型并结合有关信息,判断有关说法正确的是A. 单质硼属原子晶体.结构单元中含有30个B—B键.含20个正三角形B. SF6是由极性键构成的极性分子 。C. 固态硫S。属于原子晶体D. HCN的结构式为H∶C∶∶N7. 通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是A.分子中N—C1键键长比CCl4分子中C—C1键键长长B.分子中的所有原于均达到8电子稳定结构C.NCl3分子是非极性分子D.NBr3比NCl3易挥发8.关于氢键,下列说法正确的是A. 每个水分子内含有两个氢键
B. H2O是一种非常稳定的化合物,这是由于氢键所致
C. 由于氢键原因导致冰的密度比水小
D. 冰、水和水蒸气中都存在氢键9.下列说法正确的是 A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体; 甲醇、乙二醇和丙三醇互为同系物 B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 C.HI的相对分子质量大于HF,所以HI的沸点高于HF D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,可能是含有共价键的离子化合物10.短周期元素A、B、C、D、E、F的原子序数依次增大,其中A为周期表中原子半径最小的元素; B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;Cn—与D+、E3+具有相同的电子层结构,E、F的质子数之和是Cn—电子数的3倍。试回答下列问题:(1)A2C2的电子式为 。(2)写出F元素基态原子电子排布式 。(3)由A和B两元素可以按原子数1︰1形成多种化合物,写出符合题意的2种常见物质的结构简式: 、 。(4)D元素与F元素第一电离能较大的是 (用元素符号表示)。D与F形成的化合物,其晶体熔化后用惰性电极电解,电解反应方程式为: 。(5)我国首创利用C、E两元素单质在海水中的反应所设计的原电池广泛运用于海水标示灯,该电池的正极反应式为___________________________________________。11.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子数总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8;E与B的质量比为1:1。试回答: (1)写出D原子的电子排布式 。 (2)用电子式表示AE2的形成过程 。 (3)B、C两元素的第一电离能较大的元素是: (填写元素符号)。 (4)根据VSEPR模型预测C的氢化物的立体结构为 ,中心原子C的轨道 杂化类型为 。 (5)C的单质中π键的数目为 ,B、D两元素的气态氢化物的稳定性大小 关系为: > (填写化学式)。12.A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。 (1)写出A元素在周期表中的位置: 。(2)画出B元素的原子结构示意图: 。(3)写出C元素的核外电子排布式: 。 (4)写出C的单质和强碱溶液反应的离子方程式 。(5)由B、C两种元素组成的化合物x,常温下为易挥发的淡黄色液体,X分子为三角锥形分子.且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的电子式为 ,X与水反应的化学 方程式是 。 (6)A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为 ,Y晶体的熔点比金刚石熔点 (填“高”或“低”)。13.原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F—少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:化合物甲乙原子个数比B:A=1:4C:A=1:3 (1)元素E的基态原子的电子排布式为 。 (2)写出化合物乙的结构式 ,该分子中C的原子轨道发生的是 杂化。 (3)B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到8电子稳定结构,则x的化学式为 。 (4)D在F中燃烧的产物属于 晶体,其晶体中与D+最近且等距离的F—有 个。14.(1)由A、B两元素组成的离子晶体结构(甲)如图所示,则该晶体的化学式是: 。(2)C原子的最外层电子排布为nsnnpm,其某一激发态可使这两个亚层的每一个轨道都处于充满状态,1个C原子与2个D原子结合,使双方都达到8电子稳定结构。则在C与D形成的分子中,C原子发生轨道的杂化方式是 ,分子构型是 ,从成键方式看,该分子中含有的共价键的类型和数目分别是 。(3)C与D形成的常见晶体(乙),与甲晶体的熔点相比,乙 甲,其原因是 。
参考答案123456789BABBAABCD 10.答案:(1) (2)1s22s22p63s23p5(3) (4)Cl 2NaCl2Na + Cl2↑ (5)O2+2H2O+4e—= 411.答案:(1)1s22s22p63s23p2 (2)·S·+·C·+·S·→ S::C::S (3)N (4)三角锥形,sp3 (5)2,H2O,SiH412.答案:(1)A:第二周期ⅣA族 B:氮的结构示意图略 (2)1S22S22P63S23P5 (3)C12+2=++H2O(4) (5)C3N4;高13.答案:(1)1s22s22p63s23p4 (2)H—N—H sp3 H (3)C3N4(或B3C4) (4)离子晶体 614.答案:(1)AB或BA (2)sp 直线型 2个σ键 、2个π键 (3)<,二氧化碳(或二硫化碳)晶体为分子晶体,其作用力较弱的分子间作用力,而AB晶体为离子晶体,其作用力为较强的离子键www.ks5u.comwww.ks5u.comw.w.w.k.s.5.u.c.o.m www.ks5u.com
相关试卷
这是一份专题18 物质结构与性质(选修)——【新高考专用】三年(2020-2022)高考化学真题分类汇编(原卷版+解析版),文件包含专题18物质结构与性质选修新高考专用三年2020-2022高考化学真题分类汇编解析版docx、专题18物质结构与性质选修新高考专用三年2020-2022高考化学真题分类汇编原卷版docx等2份试卷配套教学资源,其中试卷共36页, 欢迎下载使用。
这是一份2020-2022近三年高考化学真题汇编(新高考)专题18 物质结构与性质(选修)Word版含解析,共24页。
这是一份高考化学二轮复习考案:19专题十九《实验化学》(选修),共9页。