
河南省豫南省级示范高中联盟2021-2022学年高三下学期考前模拟三理科综合化学试题(含答案)
展开河南省豫南省级示范高中联盟高三下学期考前模拟三
理科综合化学试题
考生注意:
1.本试卷共150分,考试时间150分钟。
2.请将各题答案填写在答题卡上。
3.本试卷主要考试内容:高考全部内容。
7.从古至今化学与生产、生活密切相关。下列说法不正确的是( )
A.中华酒文化源远流长,酿酒过程中涉及水解反应、氧化反应等多种反应类型
B.我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造机钛合金结构件;高温时可用金属钠还原相应的氯化物来制取金属钛
C.新冠疫情席卷全球,目前使用的一次性医用口罩(SMS),其原料是聚丙烯,能使溴水或酸性高锰酸钾溶液褪色
D.垃圾分类很重要,充电电池和硒鼓墨盒都属于有害垃圾
8.已知NA为阿伏加德罗常数的值,下列说法正确的是( )
A.60g NaHSO4固体中含有H+的数目为0.5 NA
B.标准状况下,11.2L O2和22.4L NO在密闭容器中充分混合后,气体分子总数小于NA
C.44.0g环氧乙烷中含有7.0NA个极性键
D.14gC2H4和C3H4的混合物含有2NA个共用电子对
9.一种新药物结构如图所示,下列有关该化合物说法正确的是( )
A.分子式为C17H18N2O6
B.能发生水解反应、聚合反应、取代反应、消去反应
C.该分子中所有碳原子可能在同一平面上
D.能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应
10.氮化钡(Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气反应生成氮化钡。可用下图装置制备氮化钡。已知:Ba3N2遇水反应;BaH2在潮湿空气中能自燃,遇水反应。下列说法不正确的是( )
A.在实验室中可以用装置乙制备氯气
B.气流从左向右的字母连接顺序为 c→b→a→d→e→g→f
C.实验时,先点燃装置丙中的酒精喷灯,后点燃装置乙中的酒精灯
D.装置甲中的浓硫酸和装置丁中的碱石灰作用相同,均可防止水蒸气进入装置丙中
11.某新型漂白剂( )可用于漂白各种动物皮毛,其中W、Y、Z为不同周
期不同主族的短周期元素,W、X对应的简单离子核外电子排布相同。下列叙述错误的是( )
A.原子半径W>Y>X>Z
B.X、Z形成的化合物常温下为液态
C.Y的最高价氧化物对应水化物为弱酸
D.工业上冶炼W采用电解W和X形成的化合物的熔融态
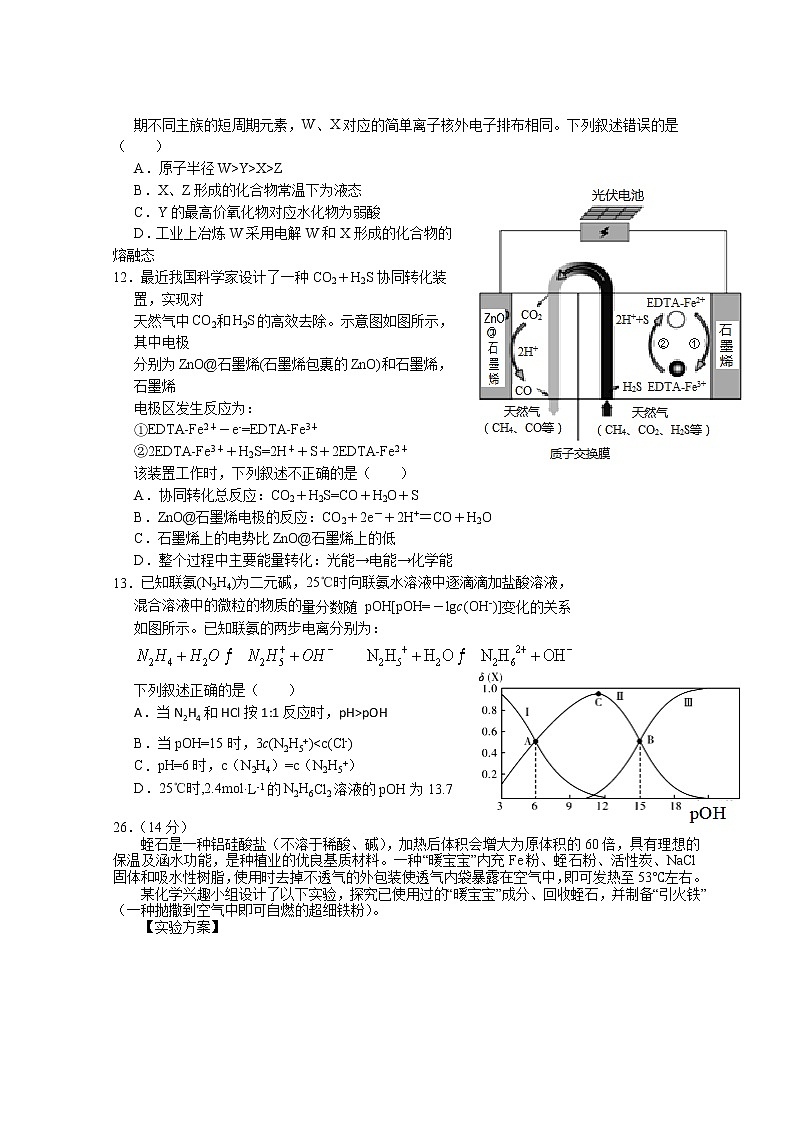
12.最近我国科学家设计了一种CO2+H2S协同转化装置,实现对
天然气中CO2和H2S的高效去除。示意图如图所示,其中电极
分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯
电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
该装置工作时,下列叙述不正确的是( )
A.协同转化总反应:CO2+H2S=CO+H2O+S
B.ZnO@石墨烯电极的反应:CO2+2e-+2H+=CO+H2O
C.石墨烯上的电势比ZnO@石墨烯上的低
D.整个过程中主要能量转化:光能→电能→化学能
13.已知联氨(N2H4)为二元碱,25℃时向联氨水溶液中逐滴滴加盐酸溶液,
混合溶液中的微粒的物质的量分数随 pOH[pOH=-lgc(OH-)]变化的关系
如图所示。已知联氨的两步电离分别为:
下列叙述正确的是( )
A.当N2H4和HCl按1:1反应时,pH>pOH
B.当pOH=15时,3c(N2H5+)<c(Cl-)
C.pH=6时,c(N2H4)=c(N2H5+)
D.25℃时,2.4mol·L-1的N2H6Cl2溶液的pOH为13.7
26.(14分)
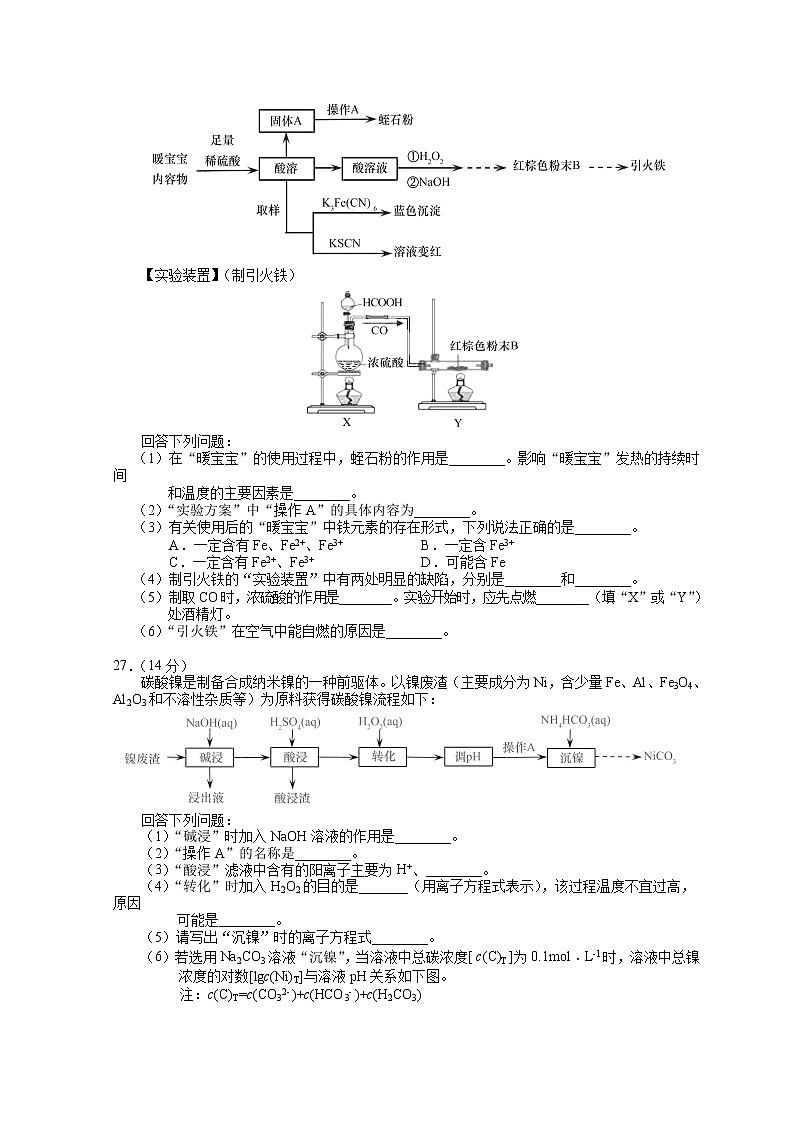
蛭石是一种铝硅酸盐(不溶于稀酸、碱),加热后体积会增大为原体积的60倍,具有理想的保温及涵水功能,是种植业的优良基质材料。一种“暖宝宝”内充Fe粉、蛭石粉、活性炭、NaCl固体和吸水性树脂,使用时去掉不透气的外包装使透气内袋暴露在空气中,即可发热至53℃左右。
某化学兴趣小组设计了以下实验,探究已使用过的“暖宝宝”成分、回收蛭石,并制备“引火铁”(一种抛撒到空气中即可自燃的超细铁粉)。
【实验方案】
【实验装置】(制引火铁)
回答下列问题:
(1)在“暖宝宝”的使用过程中,蛭石粉的作用是________。影响“暖宝宝”发热的持续时间
和温度的主要因素是________。
(2)“实验方案”中“操作A”的具体内容为________。
(3)有关使用后的“暖宝宝”中铁元素的存在形式,下列说法正确的是________。
A.一定含有Fe、Fe2+、Fe3+ B.一定含Fe3+
C.一定含有Fe2+、Fe3+ D.可能含Fe
(4)制引火铁的“实验装置”中有两处明显的缺陷,分别是________和________。
(5)制取CO时,浓硫酸的作用是________。实验开始时,应先点燃________(填“X”或“Y”)
处酒精灯。
(6)“引火铁”在空气中能自燃的原因是________。
27.(14分)
碳酸镍是制备合成纳米镍的一种前驱体。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料获得碳酸镍流程如下:
回答下列问题:
(1)“碱浸”时加入NaOH溶液的作用是________。
(2)“操作A”的名称是________。
(3)“酸浸”滤液中含有的阳离子主要为H+、________。
(4)“转化”时加入H2O2的目的是_______(用离子方程式表示),该过程温度不宜过高,原因
可能是________。
(5)请写出“沉镍”时的离子方程式________。
(6)若选用Na2CO3溶液“沉镍”,当溶液中总碳浓度[ c(C)T ]为0.1mol·L-1时,溶液中总镍
浓度的对数[lgc(Ni)T]与溶液pH关系如下图。
注:c(C)T=c(CO32- )+c(HCO3- )+c(H2CO3)
①a点(pH≈8.2)时溶液中析出的沉淀主要为________(填化学式)。
②b点溶液中Ni2+是否沉淀完全__________(填“是”或“否”)[溶液中总镍浓度c(Ni)T≤
10-5mol·L-1时,Ni2+沉淀完全] 。
(7)取“操作A”所得的NiSO4溶液VmL,用c mol·L-1 EDTA(Na2H2Y)的标准溶液滴定至
终点(发生反应Ni2++H2Y2-=NiY2-+2H+),消耗标准液20.00 mL,则“沉镍”过程中,
当NiCO3开始沉淀时,溶液中CO32-浓度为________。
[已知常温下,Ksp(NiCO3)=1.42×10-7,只列计算式,不考虑杂质反应]。
28.(15分)
高纯度的氢氟酸是制造芯片的重要原料之一。
(1)已知:HF(aq)H+(aq)+F-(aq) ΔH=-10.4kJ/mol
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol
则:HF(aq) +NaOH(aq) =NaF(aq) +H2O(l)的ΔH=________。
(2)HF无论是气态还是在水溶液中均可二聚形成(HF)2。HF能二聚的原因是________,写出
(HF)2发生第二步电离的电离方程式________。
(3)如图为恒温、带有可自由移动隔板的刚性容器。当两边分别充入4g氦气和20g单分子态
的HF气体时,隔板位于“5”处,隔板两边容器内的压强均为100kPa。
若固定隔板于“5”处,当右侧容器内反应2HF(g)(HF)2(g)达到平衡状态时,右侧容器内压强为P1;松开隔板,隔板移至“6”处并达到新的平衡,此时右侧容器内压强为P2,则P1________P2(填“大于”“小于”或“等于”)。该温度下,2HF(g)(HF)2(g) 反应的平衡常数KP=________kPa-1(KP为以分压表示的平衡常数,计算结果保留2位有效数字)。
(4)若将上述容器改为绝热容器,固定隔板在“5”处,下列不能说明右侧容器内反应已达平
衡状态的是________。
A.容器右侧气体的密度不再改变
B.容器右侧的温度不再改变
C.容器右侧气体的压强不再改变
D.容器右侧气体的平均相对分子质量不再改变
E.
(5)某温度下,将分析浓度(总浓度)相同的HCl、HF和CH3COOH三种溶液,分别加水稀
释时,溶液pH变化如图所示。
图中,氢氟酸溶液在稀释初期的pH上升特别快,据此判断,(HF)2与HF的酸性相比,较强的是________。
(6)NaF和HF的混合溶液具有一定的缓冲能力,即加入少量的酸或碱时,溶液的pH基本保
持不变。试结合方程式和必要的文字解释之。
35.【化学——选修3:物质结构与性质】(15分)钠、铁、铜、锌的单质及其化合物在社会实际中有着广泛的应用。回答下列相关问题:
(1)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如图所示,则A的化学式是___________,A中铜元素的化合价为___________。
(2)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的沉淀,该物质中的通过___________键与中心离子结合,分子中N原子的杂化方式是___________。与分子互为等电子体的一种阳离子是___________。
(3)某的晶胞如图1所示,可以完全替代该晶体中a位置的或者b位置的,形成替代型产物。转化为两种替代型产物的能量变化如图2所示,其中更稳定的替代型产物的化学式为___________。
(4)在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方晶体结构如下图所示,其晶胞边长为,密度为___________(列式并计算),a位置与b位置之间的距离为___________(列式表示)。
36.【化学——选修5:有机化学基础】(15分)PX(对二甲苯)是一种重要的化工原料。以PX为原料合成高分子树脂E和P的路线如图:
已知:1mol D分别与足量的NaHCO3和Na反应生成等量的气体。
回答下列问题:
(1)A的结构简式是______________;
(2)D中所含官能团的名称是______________;
(3)M→N的反应类型是_______________。
(4)F的名称为___________________
(5)写出D→E的反应方程式:
(6)Q是F的同系物,相对分子质量比F大14,写出同时满足下列条件Q的同分异构体的数目_______。在Q的同分异构体中,核磁共振氢谱有6组峰的结构简式为_______。
①能与FeCl3溶液发生显色反应;
②能发生银镜反应;
③能与NaHCO3溶液反应;
④分子结构中不存在甲基
参考答案
7.C 8.B 9.A 10.C 11.D 12.C 13.B
26.(14分)
(1)保温(1分)透气膜透过空气的速度和铁粉的含量(无铁粉的含量不扣分)(1分)
(2)在空气中灼烧(2分)
(3)BD(2分)
(4)缺少除CO中甲酸气体的装置(1分) 尾气未处理(1分)
(5)催化剂和脱水剂(2分) X(2分)
(6)铁粉的表面积大,能与空气充分接触,反应速率大(2分)
27.(14分)
(1)除去Al和Al2O3 (1分)
(2)过滤 (1分)
(3)Fe2+、Ni2+、Fe3+ (错写、漏写不给分,全对给2分)
(4)H2O2+2Fe2++2H+=2Fe3++2H2O (2分)
温度过高时,H2O2分解,导致除铁不完全(合理即可)(2分)
(5)Ni2++2HCO3-=NiCO3↓+CO2↑+H2O (2分)
(6)Ni2CO3 (1分) 否(1分)
(7) (2分)
28.(15分)
(1)–67.7 kJ/mol(2分)
(2)HF分子间可形成氢键(1分) (2分)
(3)小于(2分) 0.024 (2分)
(4)AE (2分)
(5)(HF)2 (2分)
(6)溶液中存在平衡HFF-+H+,F-和HF的浓度均较大,当加入少量酸时,平衡左移,当加入少量碱时,平衡右移,溶液中c(H+)变化不大,故溶液pH基本不变(表达合理且有平衡方程式即可)(2分)
35.(15分)
(1) (2分); 价 (1分)
(2) 配位 (2分); (2分); (2分)
(3)(2分)
(4) (2分) 或或 (2分)
36.(15分)
(1) (2分)
(2)羧基、羟基(2分)
(3)加成反应(2分)
(4)对苯二甲酸(2分)
(5) (2分)
(6)23(3分);(2分)
湖北省鄂东南省级示范高中教育教学改革联盟学校2023届高三化学5月模拟试卷(Word版附答案): 这是一份湖北省鄂东南省级示范高中教育教学改革联盟学校2023届高三化学5月模拟试卷(Word版附答案),共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2022年秋季鄂东南省级示范高中教育教学改革联盟学校期中联考高三化学试题(含答题卡、答案): 这是一份2022年秋季鄂东南省级示范高中教育教学改革联盟学校期中联考高三化学试题(含答题卡、答案),文件包含高三化学试卷pdf、高三化学参考答案20221020pdf、高三化学答题卡pdf等3份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
2021河南省九师联盟高三下学期四月联考理科综合化学试题含答案: 这是一份2021河南省九师联盟高三下学期四月联考理科综合化学试题含答案,共7页。试卷主要包含了5 Cu 64 Ag 108,化学与生产、生活密切相关等内容,欢迎下载使用。












