






6.2原电池 化学电源
展开考纲要求1.了解原电池的工作原理,能写出电极反应和电池反应方程式。2.了解常见化学电源的种类及其工作原理。
考点一 原电池工作原理
基础梳理·自我排查1.概念和反应本质:原电池是把化学能转化为________的装置,其反应本质是____________。2.构成条件(1)能自发地发生氧化还原反应(原电池必备条件)。(2)两个__________的电极(材料可以是金属或导电的非金属)。①负极:活泼性较强的金属。②正极:活泼性较弱的金属或能导电的非金属。(3)电极均插入电解质溶液中。(4)构成________(两电极接触或用导线连接)。
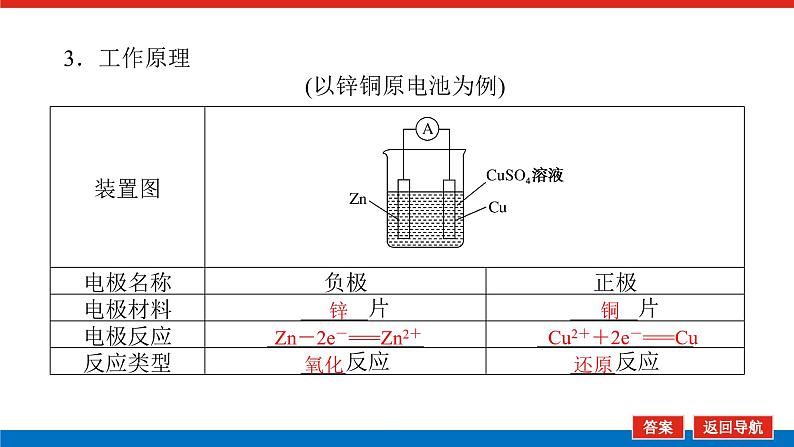
3.工作原理(以锌铜原电池为例)
Zn-2e-===Zn2+
Cu2++2e-===Cu
Zn+Cu2+===Zn2++Cu
4.原电池原理的应用(1)比较金属的活动性强弱:原电池中,负极一般是活动性较________的金属,正极一般是活动性较________的金属(或非金属)。(2)加快化学反应速率:氧化还原反应形成原电池时,反应速率加快。(3)用于金属的防护:将需要保护的金属制品作原电池的________而受到保护。
[思考]下图是根据原电池原理设计的LED灯发光的装置:(1)该装置中,存在怎样的能量转化过程?(2)如果将硫酸换成柠檬汁,导线中会不会有电子流动?如果将锌片换成铁片,电路中的电流方向是否改变?
答案:(1)装置中存在“化学能→电能→光能”的转换。(2)柠檬汁显酸性也能作电解质溶液,所以将硫酸换成柠檬汁,仍然构成原电池,所以导线中有电子流动;金属性Cu比Zn、Fe弱,Cu作正极,所以电路中的电流方向不变。
[判断] (正确的打“√”,错误的打“×”)(1)在原电池中,负极材料的活泼性一定比正极材料强( )(2)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应( )(3)带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长( )(4)在“锌-硫酸铜溶液-铜”原电池中,锌为负极,发生还原反应( )(5)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动( )(6)原电池放电时,电流方向由电源的负极流向正极( )
考点专练·层级突破练点一 原电池基础判断1.如图所示是一位同学在测试水果电池,下列有关说法错误的是( )A.若金属片A是正极,则该金属片上会产生H2B.水果电池的化学能转化为电能C.此水果发电的原理是电磁感应D.金属片A、B可以一个是铜片,另一个是铁片
2.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是( )A. (1)(2)中Mg作负极,(3)(4)中Fe作负极B.(2)中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.(3)中Fe作负极,电极反应式为Fe-2e-===Fe2+D.(4)中Cu作正极,电极反应式为2H++2e-===H2↑
解析:(1)中Mg作负极;(2)中Al作负极;(3)中铜作负极;(4)是铁的吸氧腐蚀,Fe作负极。
方法总结正、负极的判断方法
练点二 盐桥原电池3.有关下图所示原电池的叙述不正确的是( )A.电子沿导线由Cu片流向Ag片B.正极的电极反应是Ag++e-===AgC.Cu片上发生氧化反应,Ag片上发生还原反应D.反应时盐桥中的阳离子移向Cu(NO3)2溶液
解析:该装置是原电池装置,实质上发生的是Cu与硝酸银的反应,所以Cu失去电子,发生氧化反应,则Cu是负极,Ag是正极,电子从负极流向正极,A正确;正极是Ag+发生还原反应,得到电子生成Ag,B正确;根据以上分析,Cu片上发生氧化反应,Ag片上发生还原反应,C正确;原电池中,阳离子向正极移动,所以盐桥中的阳离子移向AgNO3溶液,D错误。
4.根据下图,下列判断中正确的是( )A.烧杯a中的溶液pH降低B.烧杯b中发生氧化反应C.烧杯a中发生的反应为2H++2e-===H2↑D.烧杯b中发生的反应为2Cl--2e-===Cl2↑
解析:由题给原电池装置可知,电子经过导线,由Zn电极流向Fe电极,则O2在Fe电极发生还原反应:O2+2H2O+4e-===4OH-,烧杯a中c(OH-)增大,溶液的pH升高。烧杯b中,Zn发生氧化反应:Zn-2e-===Zn2+。
练后归纳两种原电池装置的比较
Ag++e-===Ag
方法总结原电池的设计和制作方法①首先将氧化还原反应分成两个半反应。②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。如:根据反应2FeCl3+Cu===2FeCl2+CuCl2设计的原电池为:
考点二 常见化学电源的类型
基础梳理·自我排查1.一次电池(1)碱性锌锰干电池总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。负极材料:________。电极反应:___________________________。正极材料:碳棒。电极反应:___________________________________。
Zn+2OH--2e-===Zn(OH)2
2MnO2+2H2O+2e-===2MnOOH+2OH-
(2)纽扣式锌银电池总反应:_____________________________。电解质是________。负极材料:________。电极反应:____________________________。正极材料:________。电极反应:______________________________。
Zn+Ag2O+H2O===Zn(OH)2+2Ag
Ag2O+H2O+2e-===2Ag+2OH-
(3)锂电池Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为8Li+3SOCl2===6LiCl+Li2SO3+2S。①负极材料为________,电极反应为____________________。②正极的电极反应为_______________________________。
8Li-8e-===8Li+
2.二次电池(以铅蓄电池为例)(1)放电时的反应①负极反应:________________________;②正极反应:____________________________________;③总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O。
(2)充电时的反应①阴极反应:______________________;②阳极反应:___________________________________;③总反应:2PbSO4+2H2O===Pb+PbO2+2H2SO4。
微点拨可充电电池充电时电极与外接电源的正、负极的连接应符合以下特点:
3.燃料电池氢氧燃料电池是目前最成熟的燃料电池,可分为酸性和碱性两种。
2H2+4OH--4e-===4H2O
O2+4H++4e-===2H2O
[判断] (正确的打“√”,错误的打“×”)(1)可充电电池充电时,外接电源正极,内接它的负极( )(2)铅蓄电池放电时,正极与负极质量均增加( )(3)碱性锌锰干电池是一次电池,其中MnO2是催化剂,可使锌锰干电池的比能量高、可储存时间长( )(4)氢氧燃料电池以KOH作电解质溶液时,工作一段时间,pH将变大( )(5)氢氧燃料电池以H2SO4作电解质溶液时,工作一段时间,pH将变大( )(6)燃料电池工作时燃料在电池中燃烧,然后热能转化为电能( )
考点专练·层级突破练点一 化学电源中基本工作原理分析1.利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质。下列分析不正确的是( )A.电子经外电路流向Pt电极B.电池工作时,电解质中Ag+数目减少C.正极反应:Cl2+2e-+2Ag+===2AgClD.空气中c(Cl2)越大,Ag极消耗速率越快
解析:Ag的金属活泼性强于Pt,则Ag电极是负极,Ag失去电子,则电子经外电路流向Pt电极,A正确;正极是Cl2得到电子,与Ag+结合生成AgCl,即电极反应式为Cl2+2e-+2Ag+===2AgCl,但由于负极Ag失去电子转化为Ag+,所以电池工作时,电解质中Ag+数目不变,B错误,C正确;空气中c(Cl2)越大,则得到的电子数越多,因此消耗的银越多,则Ag极消耗速率越快,D正确。
2.气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。
则下列说法中正确的是( )A.上述气体检测时,敏感电极均作电池正极B.检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同C.检测H2S时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-===4OH-D.检测Cl2时,敏感电极的电极反应式为Cl2+2e-===2Cl-
解析:原电池中的正极发生还原反应,得到电子,元素的化合价降低,而待测气体为CO时,反应产物为二氧化碳,C元素的化合价升高,发生氧化反应,所以此时敏感电极作电池负极,同理,待测气体为H2S时,S元素的化合价也升高,敏感电极作电池负极,A错误;H2S和CO体积分数相同,则二者物质的量相同,二者失去的电子的物质的量不同,CO失去2个电子,而H2S中S则失去8个电子,所以在气体的扩散速度相同的前提下,传感器上产生的电流大小不同,B错误;检测H2S时,因为电极产物为H2SO4,所以电解质溶液为硫酸,对电极为正极,发生还原反应,充入空气,则正极反应式为O2+4H++4e-===2H2O,C错误;检测Cl2时,Cl元素的化合价降低,所以敏感电极作正极,则敏感电极的电极反应式是Cl2+2e-===2Cl-,D正确。
练点二 二次电池的充放电过程3.水系锂电池具有安全、环保和价格低廉等优点。以钒酸钠(NaV3O8)为正极材料的电极反应式为NaV3O8+xLi++xe-===NaLixV3O8,该电池示意图如图所示。下列说法不正确的是( )A.放电时,负极的电极反应式:Li-e-===Li+B.充电过程中Li+从阳极向阴极迁移C.充电过程中阳极的电极反应式为NaLixV3O8-xe-===NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化D.该电池可以用硫酸钠溶液作电解质溶液
解析:放电时是原电池,电池的负极发生氧化反应,A正确;充电时是电解池,充电过程中阳离子从阳极向阴极迁移,B正确;充电过程中阳极发生氧化反应,C正确;锂能与水反应,该电池不能用硫酸钠溶液作电解质溶液,D错误。
4.“天宫一号”飞行器在太空工作期间必须有源源不断的电源供应。其供电原理是:白天太阳能帆板发电,将一部分电量直接供给“天宫一号”,另一部分电量储存在镍氢电池里,供黑夜时使用。如图为镍氢电池构造示意图(氢化物电极为储氢金属,可看作H2直接参加反应)。下列说法正确的是( )A.充电时阴极区电解质溶液pH降低B.在使用过程中此电池要不断补充水C.放电时NiOOH在电极上发生氧化反应D.充电时阳极反应式为Ni(OH)2-e-+OH-===NiOOH+H2O
解析:充电时,阴极的反应为2H2O+2e-===H2↑+2OH-,pH升高,A项错误;由题意可知该电池的总反应为2NiOOH+H2===2Ni(OH)2,没有消耗水,无需补充水,B项错误;放电时,NiOOH在电极上得电子,化合价降低,发生还原反应,C项错误;充电时原电池的正极作阳极,故阳极反应式为Ni(OH)2-e-+OH-===NiOOH+H2O,D项正确。
6.甲醇燃料电池具有容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源。如图是甲醇的质子交换膜型燃料电池模型,下列有关说法正确的是( )A.Y极为电池的负极B.X极的电极反应式:CH3OH+H2O-6e-===CO2+6H+C.若常温下用该电池电解100 mL KCl溶液至pH=12时,电池质子交换膜迁移的A为0.01 mlD.空气以20%为氧气计算,X极每消耗1 ml甲醇,Y极必消耗168 L空气中的氧气
方法总结 燃料电池电极反应式书写的常用方法第一步,写出电池总反应式。燃料电池的总反应与燃料燃烧的反应一致,若产物能和电解质反应,则总反应为加合后的反应。如甲烷燃料电池(电解质溶液为NaOH溶液)的反应如下:CH4+2O2===CO2+2H2O ①CO2+2NaOH===Na2CO3+H2O ②①+②可得甲烷燃料电池的总反应式:CH4+2O2+2NaOH===Na2CO3+3H2O。
1. [2021·河北卷,9]K-O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是( )A.隔膜允许K+通过,不允许O2通过B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极C.产生1 Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22D.用此电池为铅酸蓄电池充电,消耗3.9 g钾时,铅酸蓄电池消耗0.9 g水
解析:由题图可知,b极上O2转化为KO2,则b极为电池正极,a极为电池负极,K+通过隔膜由a极向b极迁移,为避免O2氧化K电极,O2不能通过隔膜,A说法正确;放电时,电流由正极经导线流向负极,即由b极经导线流向a极,充电时,b极接外接电源的正极,b电极为阳极,B说法正确;产生1 Ah电量时,生成KO2与消耗O2的质量比为71∶32≈2.22,C说法正确;消耗3.9 g钾时,转移0.1 ml e-,铅酸蓄电池消耗0.1 ml H2O,其质量为1.8 g,D说法错误。
2.[2021·湖南卷,10]锌/溴液流电池是一种先进的水溶液电解质电池,广泛应用于再生能源储能和智能电网的备用电源等。三单体串联锌/溴液流电池工作原理如图所示:
下列说法错误的是( )A.放电时,N极为正极B.放电时,左侧贮液器中ZnBr2的浓度不断减小C.充电时,M极的电极反应式为Zn2++2e-===ZnD.隔膜允许阳离子通过,也允许阴离子通过
解析:在该原电池中,活泼金属锌做负极,则N极为正极,A说法正确;放电时,左侧锌放电产生Zn2+,贮液器中ZnBr2浓度不断增大,B说法错误;充电时,M极为阴极,电极反应式为Zn2++2e-===Zn,C说法正确;放电时Br-通过隔膜进入溶液中与Zn2+结合,充电时Zn2+通过隔膜在双极性碳和塑料电极上沉积,D说法正确。
3.[2020·全国卷Ⅰ,12]科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
5.[2020·山东卷,10]微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是( )A.负极反应为CH3COO-+2H2O-8e-===2CO2↑+7H+B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜C.当电路中转移1 ml电子时,模拟海水理论上除盐58.5 gD.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
5.解析:结合图示可知放电时的电极反应如下:根据上述分析可知,A项正确;该电池工作时,Cl-向a极移动,Na+向b极移动,即隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,B项错误;电路中转移1 ml电子时,向a极和b极分别移动1 ml Cl-和1 ml Na+,则模拟海水理论上可除盐58.5 g,C项正确;电池工作时负极产生CO2,正极产生H2,结合正、负极的电极反应知,一段时间后,正极和负极产生气体的物质的量之比为2∶1,D项正确。
6.[2019·全国卷Ⅰ,12]利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是( )A.相比现有工业合成氨,该方法条件温和,同时还可提供电能B.阴极区,在氢化酶作用下发生反应H2+2MV2+===2H++2MV+C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3D.电池工作时质子通过交换膜由负极区向正极区移动
解析:A项,现有工业合成氨的反应条件是高温、高压、催化剂,则题述方法合成氨条件更为温和,同时可将化学能转化为电能,正确;B项,阴(正)极区,在固氮酶催化作用下发生反应N2+6H++6MV+===2NH3+6MV2+,错误;C项,由B项分析可知正极区N2被还原为NH3,正确;D项,原电池工作时,质子(H+)通过交换膜由负极区向正极区移动,正确。
人教版高考化学一轮复习6.2原电池化学电源课件: 这是一份人教版高考化学一轮复习6.2原电池化学电源课件
2023届高考全国通用版化学一轮考点复习6.2原电池 化学电源课件: 这是一份2023届高考全国通用版化学一轮考点复习6.2原电池 化学电源课件,共60页。PPT课件主要包含了考点一,考点二,真题演练·素养通关,氧化还原反应,活泼性不同,闭合回路,答案C,答案B,答案D,AgNO3等内容,欢迎下载使用。
第16讲 原电池 化学电源: 这是一份第16讲 原电池 化学电源,共60页。PPT课件主要包含了考点一,考点二,必备知识·梳理夯实,自发进行,氧化还原,原电池的构成条件,电解质,自发的,Zn片,Cu片等内容,欢迎下载使用。












