





2.3氧化还原反应
展开
这是一份2.3氧化还原反应,共57页。PPT课件主要包含了考点一,答案B,考点二,真题演练·素养通关等内容,欢迎下载使用。
考纲要求1.了解氧化还原反应的本质是电子的转移。2.了解常见的氧化还原反应。3.掌握常见氧化还原反应的配平和相关计算。4.能利用得失电子守恒原理进行相关计算。
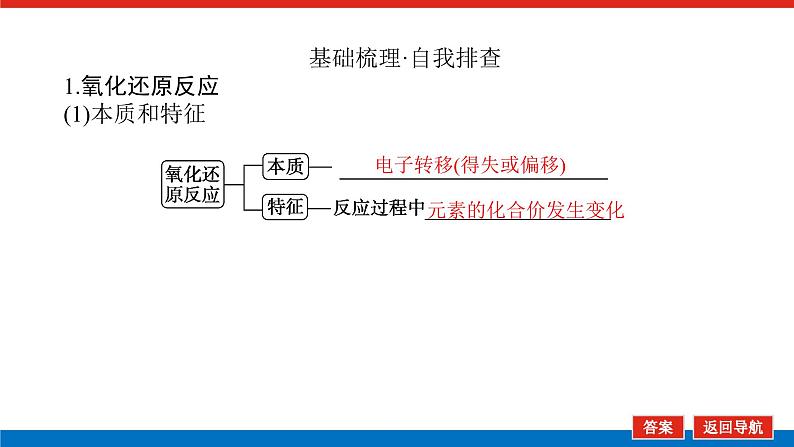
基础梳理·自我排查1.氧化还原反应(1)本质和特征
电子转移(得失或偏移)
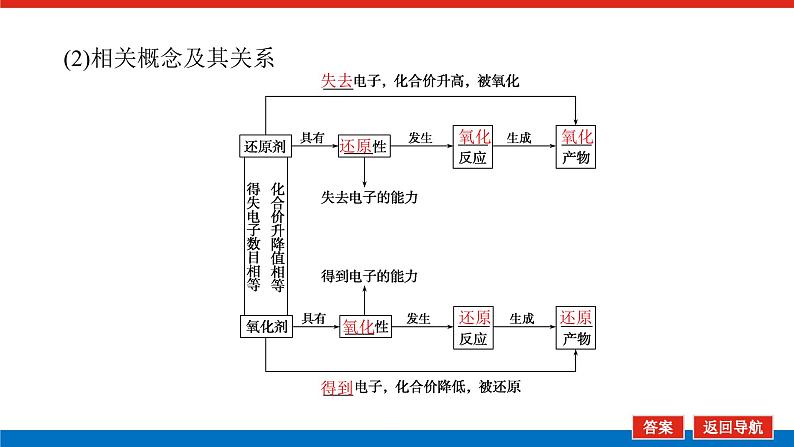
(2)相关概念及其关系
(3)氧化还原反应中电子转移的表示方法①双线桥法请标出Cu与稀硝酸反应中电子转移的方向和数目:___________________________________________________________。
②单线桥法请标出Cu与稀硝酸反应中电子转移的方向和数目:___________________________________________________________。
2.常见的氧化剂和还原剂(1)常见氧化剂常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。如:
(2)常见还原剂常见还原剂包括活泼的金属单质、非金属离子及低价态化合物、低价金属阳离子、非金属单质及其氢化物等。如:
3.氧化性和还原性(1)氧化性是指物质________的性质(或能力);还原性是指物质________的性质(或能力)。(2)从元素的价态考虑:最高价态微粒只有________性;最低价态微粒只有________性;中间价态微粒有________________。(3)氧化性、还原性的强弱取决于得、失电子的________程度,与得、失电子数目的多少无关。
[判断] (正确的打“√”,错误的打“×”)(1)有单质参加或有单质生成的化学反应一定是氧化还原反应( )(2)某元素从游离态变为化合态,该元素一定被氧化( )(3)非金属阴离子只具有还原性,金属阳离子只具有氧化性( )(4)H2O作为还原剂时,产物中一般有O2生成( )(5)氧化还原反应中的反应物,不是氧化剂就是还原剂( )(6)强氧化剂与强还原剂混合不一定能发生氧化还原反应( )(7)阳离子只有氧化性,阴离子只有还原性( )(8)元素的非金属性越强,其氧化性越强,相应单质越活泼( )(9)难失电子的物质一定易得电子( )
微点拨氧化还原反应与四种基本类型的关系
考点专练·层级突破练点一 氧化还原反应基础判断1.下列物质在生活中应用时,起还原作用的是( )A.明矾作净水剂B.甘油作护肤保湿剂C.漂粉精作消毒剂D.铁粉作食品袋内的脱氧剂
解析:A项,明矾作净水剂是因为它溶于水生成的Al(OH)3胶体具有较大的表面积,能够吸附水中的悬浮物而沉降,错误;B项,甘油作护肤保湿剂是因为它具有吸湿性,错误;C项,漂粉精作消毒剂是因为它具有强氧化性,能够杀死水中的细菌和病毒,错误;D项,铁粉作食品袋中的脱氧剂是因为铁粉具有还原性,能够和氧气发生反应,降低食品袋中的氧气浓度,正确。
2.氢化钙(CaH2)可作为生氢剂,反应的化学方程式为CaH2+2H2O===Ca(OH)2+2H2↑,下列说法不正确的是( )A.CaH2既是还原剂,又是氧化剂B.H2既是氧化产物,又是还原产物C.CaH2是还原剂,H2O是氧化剂D.氧化产物与还原产物的质量比为1∶1
解析:该反应中,CaH2中H元素由-1价变为0价,H2O中H元素由+1价变为0价,则CaH2是还原剂,H2O是氧化剂,H2既是氧化产物,又是还原产物。
解析:Cu2S、Cu2O中Cu均显+1价,S、O均显-2价,利用双线桥法分析有: ,Cu2S既是氧化剂又是还原剂,Cu2O只作氧化剂。Cu是还原产物,SO2是氧化产物。每生成0.3 ml Cu,反应中转移0.3 ml电子。
练点二 电子转移方向和数目的分析4.判断下列化学方程式中电子转移方向、数目表示的正误。
解析:由化学方程式可知,铝元素的化合价升高,被氧化,A项错误;10 ml铝原子参加反应转移电子为10 ml×3=30 ml,数目为30NA,B项错误;用双线桥法表示的电子转移如下:C项正确;单线桥上应标注电子总数,并且不注明得失,D项错误。
练后归纳1.正确分析氧化还原反应中电子转移的数目,其前提是确定物质中各元素(特别是变价元素)的化合价。基本方法是先标出熟悉元素的化合价,再根据化合物中正负化合价的代数和为零的原则求解其他元素的化合价。2.根据化合价判断反应体系中的氧化剂、还原剂及氧化产物、还原产物。如对于反应6HCl(浓)+NaClO3===NaCl+3Cl2↑+3H2O中,氧化剂为NaClO3,还原剂为HCl,氧化产物和还原产物都为Cl2。3.近几年高考中一些特殊物质中元素化合价判断:
基础梳理·自我排查1.守恒规律化合价有升必有降,电子有得必有失。对于一个完整的氧化还原反应,化合价升降总数相等,电子得失总数相等。2.强弱规律自发进行的氧化还原反应,一般遵循强氧化剂制弱氧化剂,强还原剂制弱还原剂,即“强制弱”。氧化剂+还原剂―→还原产物+氧化产物氧化性:氧化剂________氧化产物;还原性:还原剂________还原产物。
4.价态规律(1)元素处于最高价,只有________,如Fe3+、Ag+等;元素处于最低价,只有________,如S2-、I-等;元素处于中间价态,既有氧化性又有还原性,如Fe2+、Cl2等。(2)归中反应规律不同价态的同种元素间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价―→中间价”,而不会出现交叉现象。简记为“两相靠,不相交”。如在反应KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O中,氧化产物是_____,还原产物是_____,1 ml KClO3反应时转移电子数是_____。(3)歧化反应规律“中间价―→高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl2+2NaOH===NaCl+NaClO+H2O。1 ml Cl2反应时转移电子数为_____。
考点专练·层级突破练点一 氧化还原反应规律性判断1.已知有如下三个氧化还原反应:2FeCl3+2KI===2FeCl2+2KCl+I22FeCl2+Cl2===2FeCl32KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O若某溶液中Fe2+和I-共存,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是( )A.Cl2 B.KMnO4C.FeCl3 D.HCl
2.铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①Tl3++2Ag===Tl++2Ag+,②Ag++Fe2+===Ag+Fe3+,③Fe+2Fe3+===3Fe2+,下列离子氧化性比较顺序正确的是( )A.Tl3+>Fe3+>Ag+B.Fe3+>Ag+>Tl3+C.Tl+>Ag+>Fe2+D.Tl3+>Ag+>Fe3+
解析:在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性。
3.已知C2O3在酸性溶液中易被还原成C2+,C2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )A.3Cl2+6FeI2===2FeCl3+4FeI3B.Cl2+FeI2===FeCl2+I2C.C2O3+6HCl===2CCl2+Cl2↑+3H2OD.2Fe3++2I-===2Fe2++I2
解析:氧化还原反应发生的条件是强氧化剂+强还原剂=弱还原剂+弱氧化剂。由于Fe3+氧化性强于I2,所以FeI3不存在,A中反应不可能发生;B、C、D中反应符合氧化还原反应规律,所以可以发生。例如n(Cl2)∶n(FeI2)=1∶1时即发生B项的反应。
练后归纳假设法判断氧化还原反应能否进行已知物质的氧化性或者还原性的强弱关系,判断某一氧化还原反应能否发生时可采用假设法。先假设反应成立↓然后根据氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性的规律,列出假设反应中的上述关系↓结合题干条件判断该结论是否符合事实,符合事实,则反应成立;反之,则不成立
练点二 氧化还原反应规律性计算4.氮氧化铝(AlON)是一种透明高硬度防弹材料,可以由反应Al2O3+C+N2 2AlON+CO合成,下列有关说法正确的是( )A.氮氧化铝中氮的化合价是-3价B.反应中每生成5.7 g AlON的同时生成1.12 L COC.反应中氮气作氧化剂D.反应中氧化产物和还原产物的物质的量之比是2∶1
解析:A项,AlON中铝显+3价,氧显-2价,则氮显-1价,错误;B项,没有指明温度和压强,不能计算出生成物CO的体积,错误;C项,反应后氮元素的化合价降低,N2作氧化剂,正确;D项,AlON为还原产物,CO为氧化产物,两者物质的量之比为1∶2,错误。
5.某科研团队研究发现硼氢化钠(NaBH4)在催化剂Ru表面与水反应可生成H2,其反应机理如图所示:根据以上信息判断,下列叙述错误的是( )A.过程①至过程④中硼元素的化合价不变B.X是H3BO3,H3BO3和BH3两分子中H的化合价相等C.过程③和过程④各产生1 ml H2时转移的电子数不相等D.0.25 ml NaBH4的还原能力与标准状况下22.4 L H2的还原能力相当(还原能力即生成H+失去电子的量)
练后归纳守恒法解题的“3步流程”
方法总结氧化还原方程式配平的一般步骤
练点四 信息型氧化还原反应方程式的配平10.按要求书写方程式:(1)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:_______________________________________。(2)①PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为______________________________。②PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为______________________。
PbO+ClO-===PbO2+Cl-
2Ag++ClO-+2OH-===Ag2O2↓+Cl-+H2O
3Na2SO4+8C 3Na2S+4CO↑+4CO2↑
2KMnO4+C2HCl3===2KCl+2CO2↑+2MnO2+HCl
练后归纳信息型氧化还原反应方程式的配平书写步骤
2.[2021·浙江卷1月,8]下列说法不正确的是( )A.铁粉与氧化铝发生的铝热反应可用于焊接铁轨B.镁燃烧会发出耀眼的白光,可用于制造信号弹和焰火C.熟石膏与水混合成糊状后能很快凝固,常用于制作模型和医疗石膏绷带D.工业上可用氨水消除燃煤烟气中的二氧化硫
解析:铝热反应中的反应物是铝单质与金属氧化物,A说法错误;镁燃烧时会发出耀眼的白光,并放出大量的热,可用于制造信号弹和焰火,B说法正确;熟石膏与水混合成糊状后会很快凝固,转化为坚硬的石膏,利用石膏的这一性质,人们常用石膏制作各种模型和医疗石膏绷带,C说法正确;用氨水法处理燃煤烟气中的二氧化硫,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵又被氧化成硫酸铵,既可消除SO2带来的污染,又可得到副产品硫酸铵,D说法正确。
3.[2019·北京卷,10]下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )
解析:A项,用Fe粉除去FeCl2溶液中的Fe3+时,发生了氧化还原反应;C项,除去Cl2中的HCl杂质一般用饱和食盐水,用水除会损失部分Cl2,同时Cl2与H2O的反应是氧化还原反应;D项,NO2和H2O的反应属于氧化还原反应。
4.[2019·浙江4月选考,6]反应8NH3+3Cl2===N2+6NH4Cl,被氧化的NH3与被还原的Cl2的物质的量之比为( )A.2∶3 B.8∶3C.6∶3 D.3∶2
解析:该氧化还原反应用双线桥法表示为 可知实际升价的N原子为2个,所以2个NH3被氧化,同时Cl2全部被还原,观察计量数,Cl2为3个,因而被氧化的NH3与被还原的Cl2的物质的量之比为2∶3。
5.[北京卷改编]NSR技术能有效降低柴油发动机在空气过量条件下的NOx(氮氧化物)的排放,其工作原理:NOx的储存和还原在不同时段交替进行,如图所示。下列说法不正确的是( )A.储存过程中化合价发生改变的元素有两种B.还原过程中,Ba(NO3)2转化为BaOC.在储存过程中,参加反应的NO和O2的物质的量之比为2∶1D.还原过程中,若还原性气体为H2,则参加反应的H2与生成的N2的物质的量之比是5∶1
解析:在储存过程中,只有氮、氧元素的化合价发生变化,A正确;还原过程中,Ba(NO3)2与还原性气体反应生成氧化钡、氮气和水,B正确;储存过程中,NO与O2、BaO反应生成Ba(NO3)2,1 ml NO完全反应化合价升高了3 ml,1 ml O2完全反应得到4 ml电子,根据电子守恒可知,参加反应的NO和O2的物质的量之比=4 ml∶3 ml=4∶3,故C错误;还原过程中,若还原性气体为H2,1 ml氢气完全反应失去2 ml电子,Ba(NO3)2中+5价N转化成N2得到10 ml电子,根据电子守恒可知,参加反应的H2与生成的N2的物质的量之比=10 ml∶2 ml=5∶1,故D正确。
6.[2020·全国卷Ⅱ,26(节选)]化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:(1)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为_______________________。(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 ml ClO2消耗NaClO2的量为______ml;产生“气泡”的化学方程式为____________________________________。
2Cl2+HgO===HgCl2+Cl2O
NaHCO3+NaHSO4===CO2↑+Na2SO4+H2O
解析:(1)HgO与Cl2的反应为歧化反应,Cl2既是氧化剂又是还原剂,汞元素与氧元素化合价不变,故HgO与Cl2反应生成Cl2O的同时还生成HgCl2,依据得失电子守恒可知,生成HgCl2与Cl2O的物质的量之比为1∶1。(2)由题意可知NaClO2生成ClO2的反应为歧化反应,故 ,依据得失电子守恒可得,生成ClO2与NaCl的物质的量之比为4∶1,依据氯原子守恒可得,NaClO2与ClO2的物质的量之比为5∶4,每生成1 ml ClO2消耗NaClO2的量为1.25 ml;ClO2易溶于水,故“气泡”的成分只能是CO2,NaHSO4与NaHCO3反应生成Na2SO4、H2O和CO2。
相关课件
这是一份人教版高考化学一轮复习2.3氧化还原反应课件
这是一份2.3氧化还原反应课件新人教版 高考化学一轮复习,共60页。
这是一份新教材2022届新高考化学人教版一轮课件:2.3 氧化还原反应,共60页。








