





3.3铁及其化合物
展开
这是一份3.3铁及其化合物,共60页。PPT课件主要包含了考点一,考点二,真题演练·素养通关,④⑤⑦⑧⑨,磁性氧化铁,红棕色,+H2O,红褐色,灰绿色,H2O等内容,欢迎下载使用。
【考纲要求】1.掌握铁的主要性质及应用。2.掌握铁的重要化合物的主要性质及应用。3.了解铁及其重要化合物的制备方法。
考点一 铁及其氧化物和氢氧化物
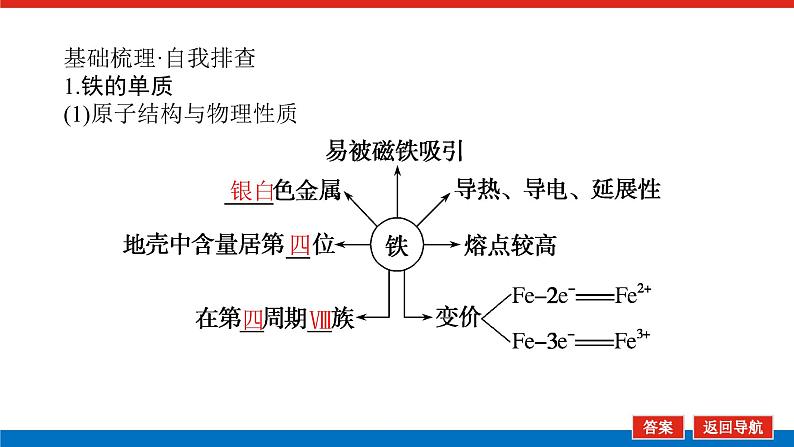
基础梳理·自我排查1.铁的单质(1)原子结构与物理性质
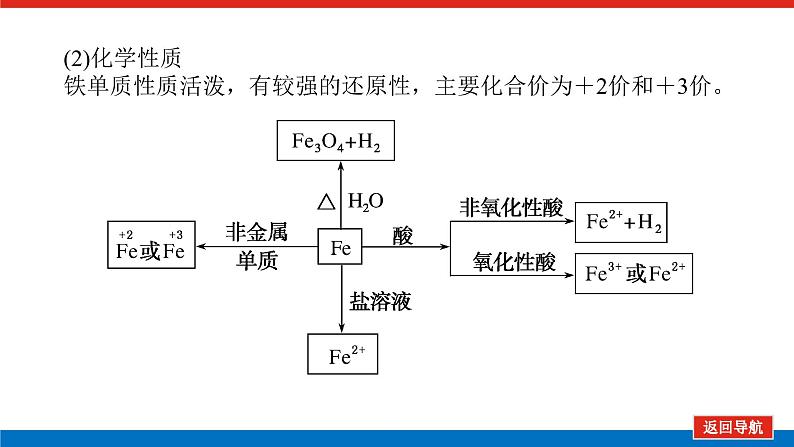
(2)化学性质铁单质性质活泼,有较强的还原性,主要化合价为+2价和+3价。
按要求书写下列反应的方程式:①Fe与Cl2、S反应的化学方程式:___________________;___________________。②Fe与水蒸气的反应:_________________________。③与氧化性酸(如HNO3)的反应(写离子方程式)。Fe与过量稀HNO3的反应:____________________________________;Fe与少量稀HNO3的反应:____________________________________。④Fe与FeCl3溶液的反应(写离子方程式):____________________________________。
Fe+S FeS
3Fe+4H2O(g) Fe3O4+4H2
Fe+2Fe3+===3Fe2+
[思考]铁有+2、+3价两种价态,单质铁与________(填下列编号,下同)反应时只生成+3价铁;与___________反应时只生成+2价铁;与________反应时既生成+2价铁也生成+3价铁。所选试剂:①Cl2 ②O2 ③H2O(g) ④S ⑤盐酸 ⑥稀硝酸(足量) ⑦稀硫酸 ⑧CuSO4溶液 ⑨FeCl3溶液
2.铁的氧化物(1)物理性质(2)化学性质FeO、Fe2O3、Fe3O4分别与盐酸反应的离子方程式为____________________,_______________________,___________________________。
FeO+2H+===Fe2+
Fe2O3+6H+===2Fe3++3H2O
Fe3O4+8H+===2Fe3++Fe2++4H2O
2Fe(OH)3 Fe2O3+
②碱性Fe(OH)2属于二元弱碱,Fe(OH)3属于三元弱碱,与非氧化性强酸反应的离子方程式分别为_________________________________________________。4.Fe(OH)2、Fe(OH)3的制备分别由可溶性的亚铁盐和铁盐与碱反应制得,离子方程式分别为____________________________________________。
Fe2++2OH-===Fe(OH)2↓;Fe3++3OH-===Fe(OH)3↓
[判断] (正确的打“√”,错误的打“×”)(1)铁具有导电、导热、延展性及被磁体吸引的特性( )(2)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2( )(3)根据Cl2、S与铁的反应可以判断氯元素和硫元素的非金属性强弱( )(4)用铁制容器可以运输浓硝酸和浓硫酸( )(5)氧化铁能与酸反应,所以可用于制作红色染料( )(6)Fe2O3不可与水反应得到Fe(OH)3,所以不能通过化合反应制取Fe(OH)3( )
考点专练·层级突破练点一 铁及其氧化物性质1.《本草纲目》中记载“慈石治肾家诸病,而通耳明目。慈石,色轻紫,石上皲涩,可吸连针铁,俗谓之熁铁石”。“慈石”的主要成分是( )A.铁 B.氧化铜C.氧化铁 D.四氧化三铁
2.下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是( )A.K B.Na C.Fe D.Al
解析:金属铝在空气中表面会形成一层致密的氧化膜保护层,防止内层的金属进一步被氧化,D正确;K、Na、Fe表面形成的氧化膜比较疏松,不能保护内层金属,A、B、C错误。
解析:Cl2氧化性强,灼热的Fe与Cl2反应生成FeCl3,故A错误;氢氧化亚铁具有还原性,会被具有氧化性的稀硝酸氧化变为Fe3+,B错误。
练点二 铁及其氧化物的计算4.将10.7 g Mg、Al和Fe组成的合金溶于足量的氢氧化钠溶液中,产生标准状况下3.36 L气体。另取等质量的合金溶于过量盐酸中,生成标准状况下7.84 L气体,向反应后的溶液中加入过量NaOH溶液,得到沉淀的物质的量为( )A.0.1 ml B.0.2 mlC.0.25 ml D.0.3 ml
解析:根据2Fe2++Cl2===2Fe3++2Cl-,可知铁的“氧化物”样品用盐酸溶解后所得溶液中n(Fe2+)=0.025 ml×2=0.05 ml,根据电荷守恒得2n(Fe2+)+3n(Fe3+)=n(Cl-),则n(Fe3+)=0.2 ml,故n(Fe2+)∶n(Fe3+)=0.05∶2=1∶4,故该氧化物可表示为FeO·2Fe2O3,即Fe5O7。
练点三 探究性实验6.某学生以铁丝和Cl2为原料进行下列实验。从分类角度分析下列说法正确的是( )A.实验①③反应制得的物质均为纯净物B.实验②③均未发生氧化还原反应C.实验②③均为放热过程D.实验①②所涉及的物质均为电解质或非电解质
解析:实验③得到的是氢氧化铁胶体,是混合体系,A项错误;实验②中的溶解主要是物理变化,实验③中的水解是发生复分解反应,两者均未发生氧化还原反应,B项正确;实验③中盐的水解是吸热过程,C项错误;实验①中的铁和氯气是单质,既不是电解质也不是非电解质,D项错误。
7.铁与水蒸气反应,通常有以下两种装置,请回答下列问题:(1)装置二中湿棉花的作用为___________。(2)实验完毕后,取出装置一的少量固体,溶于足量稀盐酸,再滴加KSCN溶液,溶液颜色无明显变化,试解释原因:_____________________________________________ (用离子方程式表示)。
Fe3O4+8H+===Fe2++
2Fe3++4H2O,2Fe3++Fe===3Fe2+
8.(1)下列各图示中,能较长时间观察到Fe(OH)2白色沉淀的是________。
(2)用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________。②除去蒸馏水中溶解的O2常采用________的方法。③生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是__________________________。
避免生成的Fe(OH)2沉淀接触O2
解析:①Fe2+易水解,要加入稀硫酸防止其水解;Fe2+易被空气中的O2氧化,要加Fe粉防止Fe2+被氧化。②气体的溶解度随温度升高而降低,所以煮沸后的水中溶解的O2较少。
方法总结Fe(OH)2的制备防氧化方法方法一:有机覆盖层法将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应,如图1所示。方法二:还原性气体保护法用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀,如图2所示。方法三:电解法用铁作阳极,电解NaCl(或NaOH)溶液,并在液面上覆盖苯或煤油,如图3所示。
考点二 Fe2+、Fe3+的性质、转化及检验
基础梳理·自我排查1.亚铁盐和铁盐(1)亚铁盐(Fe2+)含有Fe2+的溶液呈_______色,Fe2+既有_______性,又有_______性,Fe2+与Zn、Cl2反应的离子方程式分别为_____________________,______________________。(2)铁盐(Fe3+)①氧化性:含有Fe3+的溶液呈________色,Fe3+具有氧化性,Fe3+与Cu反应的离子方程式为_______________________。②特性:含有Fe3+的溶液遇到_______时变成血红色。③易水解:FeCl3滴入沸水中的化学方程式:_______________________________。
Zn+Fe2+===Zn2++Fe
2Fe2++Cl2===2Fe3++2Cl-
2Fe3++Cu===2Fe2++Cu2+
FeCl3+3H2O Fe(OH)3
2.Fe2+和Fe3+的转化完成下列变化的离子方程式,体会Fe2+与Fe3+转化条件。(1)将H2S气体通入FeCl3溶液中产生淡黄色沉淀:____________________________。(2)将FeCl3溶液滴入KI淀粉溶液,溶液变蓝:______________________。(3)用FeCl3溶液腐蚀废旧线路板上的铜箔:________________________。(4)将H2O2滴入到酸性FeCl2溶液中:______________________________。(5)将FeCl2溶液滴入到HNO3溶液中,有无色气体放出:_____________________________________。
H2S+2Fe3+===S↓+2Fe2++2H+
2I-+2Fe3+===I2+2Fe2+
Cu+2Fe3+===Cu2++2Fe2+
2Fe2++H2O2+2H+===2Fe3++2H2O
3.Fe2+、Fe3+的检验(1)Fe2+的检验
(3)含Fe2+、Fe3+的混合溶液中Fe3+、Fe2+的检验①Fe3+的检验:②Fe2+的检验:
微点拨 含铁物质的除杂方法
考点专练·层级突破练点一 Fe3+、Fe2+的相互转化1.下列试剂中,不能使Fe2+转化为Fe3+的是( )①氯气 ②NaCl溶液 ③KMnO4溶液 ④稀硝酸 ⑤盐酸 ⑥NaNO3溶液A.①②③ B.①③④C.②④⑤ D.②⑤⑥
2.在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示。请将正确答案的序号填在相应的横线上。①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+(1)AB段铁元素以________形式存在。(2)BC段铁元素以________形式存在。(3)CD段铁元素以________形式存在。
解析:向稀HNO3中加入铁粉,开始时稀HNO3过量应生成Fe3+,随加入铁粉量的增加,HNO3反应完全后,发生反应2Fe3++Fe===3Fe2+,最后全部转化为Fe2+。
3.ZnSO4溶液[含有少量FeSO4、Fe2(SO4)3],为除去溶液中的FeSO4、Fe2(SO4)3,设计实验如下:(1)可先向溶液中通入氧气,目的是__________________;(2)加入________(填最佳试剂)调节溶液的pH至2.8;(3)过滤。已知相关金属离子[c0(Mn+)=0.1 ml·L-1]形成氢氧化物沉淀的pH范围如下:(4)问题讨论:①调节溶液pH时是否可以用NaOH溶液?________,理由是______________________。②如果不通入氧气,其后果是_____________________________________。
将Fe2+氧化成Fe3+
pH不易控制,引入杂质
Zn2+沉淀的同时Fe2+也沉淀,无法除去杂质
练后归纳“铁三角”中的转化关系
练点二 Fe2+、Fe3+的检验4.下列离子的检验方法合理的是( )A.向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+B.用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
5.下列实验操作和现象、结论或目的均正确的是( )
练点三 流程分析题中的铁及其化合物6.用废铁屑制备磁性胶体粒子,制取过程如下:下列说法不正确的是( )A.用Na2CO3溶液浸泡是为了除去废铁屑表面的油污B.通入N2是为了防止空气中的O2氧化二价铁元素C.加适量的H2O2是为了将部分的Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+===2Fe3++2H2OD.溶液A中Fe2+和Fe3+的浓度比为2∶1
解析:Na2CO3的水溶液显碱性,油污在碱性溶液中发生水解,因此用Na2CO3溶液浸泡可以除去废铁屑表面的油污,A正确;Fe2+容易被氧气氧化,因此通入N2的目的是防止空气中的氧气氧化Fe2+,B正确;利用H2O2的氧化性,把Fe2+氧化成Fe3+,涉及的反应:2Fe2++H2O2+2H+===2Fe3++2H2O,C正确;Fe3O4中Fe2+和Fe3+物质的量之比为1∶2,所以溶液A中Fe2+和Fe3+的浓度比为1∶2,D错误。
7.硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( )A.FeSO4与NH4HCO3反应制备FeCO3,适宜在高温条件下进行B.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化D.常温下,FeSO4比(NH4)2Fe(SO4)2易溶于水
解析:A项中,NH4HCO3高温下易分解,且生成的FeCO3可能受热分解。
8.铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如下:实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。
(1)装置A的名称是__________,装置B中盛放的药品是__________,NH4HCO3盛放在装置__________中。(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是__________________________________,发生主要反应的离子方程式为___________________________________________________________________________________。FeSO4溶液要现用现配制的原因是________________,检验久置的FeSO4是否变质的方法是_____________________________________________________________________。(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为________________________________,取干燥后的FeCO3样品12.49 g,与炭混合后焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量:_____ g。
(待D处的氢气纯净后)关闭活塞3,打开活塞2
取样品配成溶液,取少量溶液于试管中,再向试管
中加入KSCN溶液,观察是否显血红色
4FeCO3+O2+2H2O===
4FeOOH+4CO2
1.[2021·广东卷,10]部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )A.a可与e反应生成bB.b既可被氧化,也可被还原C.可将e加入浓碱液中制得d的胶体D.可存在b→c→d→e→b的循环转化关系
解析:本题考查物质推断和元素化合物知识,考查的化学学科核心素养是证据推理与模型认知。由黄色固体X与足量的水作用得到深棕色固体混合物Y和无色碱性溶液Z可知,X中含有CuCl2、漂白粉,至少含有FeSO4、Fe2(SO4)3中的一种,不含KI,A、B项错误,C项正确;漂白粉中含有CaCl2和Ca(ClO)2,用硫酸酸化可得到氯气,由题述实验现象不能说明X中含有CuCl2,D项错误。
3.[2019·天津卷,3]下列有关金属及其化合物的应用不合理的是( )A.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2B.铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良D.无水CCl2呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
解析:本题涉及的考点有铁、氯、钠及其化合物的性质,合金的性质与应用。考查学生对元素化合物基础知识的整合能力,体现了宏观辨识与微观探析的学科核心素养。A项,溶液中发生反应:2Fe2++Cl2===2Fe3++2Cl-、2Fe3++Fe===3Fe2+,将废铁屑加入FeCl2溶液中可以除去工业废气中的Cl2,故正确;B项,铝、锂均为轻金属,铝中添加适量锂可以制得低密度、高强度的铝合金,故正确;C项,Na2CO3+Ca(OH)2===CaCO3+2NaOH,施加熟石灰生成了烧碱NaOH,碱性增加,不利于作物生长,故错误;D项,无水CCl2吸水的现象(蓝色变粉红色)明显,可用于判断变色硅胶是否吸水,故正确。
4.[2019·全国卷Ⅲ,26]高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:相关金属离子[c0(Mn+)=0.1 ml·L-1]形成氢氧化物沉淀的pH范围如下:
SiO2(或不溶性硅酸盐)
MnO2+MnS+2H2SO4===2MnSO4+S+2H2O
将Fe2+氧化为Fe3+
F-与H+结合形成弱电解质HF,MgF2⇌Mg2++2F-平衡向
解析:本题涉及元素化合物知识的综合应用,通过工艺流程形式给出信息,考查分析和解决化学工艺流程问题的能力,根据题给信息书写相应的化学方程式和离子方程式,体现了证据推理与模型认知的学科核心素养。(1)由题干信息可知,滤渣有生成的S和不与H2SO4反应的SiO2(或写不溶性硅酸盐);依据氧化还原反应原理可知,MnO2作氧化剂,MnS作还原剂,由此可写出化学方程式。(2)Fe溶于H2SO4中得到Fe2+,为了去除方便,需将Fe2+氧化为Fe3+。(3)由相关金属离子形成氢氧化物沉淀的pH范围可知除铁和铝时溶液pH范围应调节为4.7~6之间。(4)NiS和ZnS是难溶于水的硫化物。
解析:本题考查由炼钢污泥制备软磁性材料α-Fe2O3。考查的化学学科核心素养是科学探究与创新意识。(1)适当升高酸浸温度、适当加快搅拌速度,均可以加快铁泥的溶解,即提高铁元素的浸出率。
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成________(填化学式);检验Fe3+是否还原完全的实验操作是__________________________________________________________。(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是________________________________________________[Ksp(CaF2)=5.3×10-9,Ka(HF)=6.3×10-4]。
pH偏低形成HF,导致溶液中F-浓度减小,CaF2沉淀不完全
解析:本题考查由炼钢污泥制备软磁性材料α-Fe2O3。考查的化学学科核心素养是科学探究与创新意识。(2)“酸浸”时,H2SO4过量,加入过量铁粉,除生成Fe2+外,还会产生H2。Fe3+与KSCN反应所得溶液呈血红色,当加入KSCN溶液观察不到血红色,则说明Fe3+已完全被还原为Fe2+。(3)当c(Ca2+)·c2(F-)
相关课件
这是一份人教版 (2019)必修 第一册第一节 铁及其化合物集体备课ppt课件,共19页。
这是一份人教版 (2019)必修 第一册第一节 铁及其化合物完美版ppt课件,共25页。
这是一份人教版 (2019)必修 第一册第三章 铁 金属材料第一节 铁及其化合物完美版课件ppt,共60页。PPT课件主要包含了第一节铁及其化合物,研习一铁的单质,自读教材,要点归纳,题组训练等内容,欢迎下载使用。









