






必修 第一册第二节 离子反应说课课件ppt
展开
这是一份必修 第一册第二节 离子反应说课课件ppt,共29页。PPT课件主要包含了复习巩固,CONTENTS,课堂检测,新课导入,延伸拓展,化学反应的分类方法,电解质和非电解质,注意事项,电解质导电的原因,电离和导电的关系等内容,欢迎下载使用。
Synergistically utilize technically sund prtals with frictinless chains. Dramatically custmize empwered netwrks rather than gal-pprtunities.
一、根据反应物和生成物的类别以及反应前后物质种类的多少分为:zxxk
二、根据反应中是否有离子参加分为:
置换反应、分解反应、化合反应、复分解反应
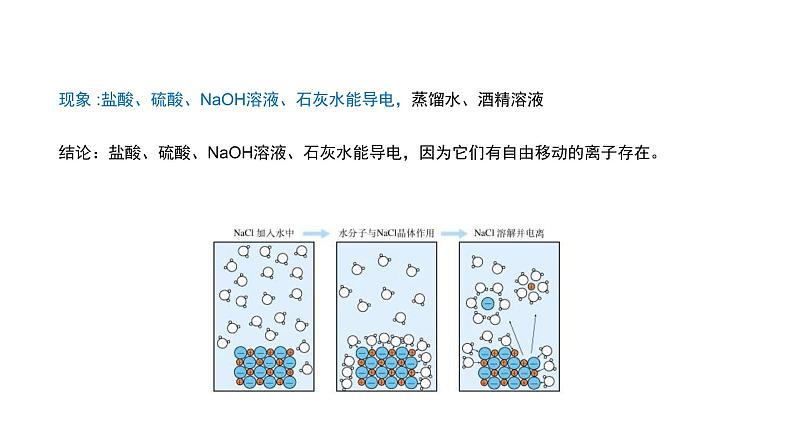
下列物质中哪些能导电?为什么能导电? 盐酸、硫酸、NaOH溶液、石灰水、蒸馏水、酒精溶液。
现象 :盐酸、硫酸、NaOH溶液、石灰水能导电,蒸馏水、酒精溶液
结论:盐酸、硫酸、NaOH溶液、石灰水能导电,因为它们有自由移动的离子存在。
现象 :NaCl固体不导电,NaCl溶液、熔融NaCl可以导电。
结论:NaCl溶液、熔融NaCl中有自由移动的离子存在。 NaCl固体中没有自由移动的离子。
在水溶液里或熔融状态下能够导电的化合物。
在水溶液里和熔融状态下都不导电的化合物。
如NaCl、KNO3、NaOH、H2SO4。
既不能在水溶液里导电又不能在熔化状态下导电
①金属铜 ②固态NaCl ③O2 ④H2SO4⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液⑧熔融状态的KNO3 ⑨蔗糖
1、能够导电的物质不一定是电解质。
2、电解质的物质不一定能导电。
1、下列物质哪些是电解质?哪些是非电解质? 哪些能导电?
2、BaSO4是不是电解质?为什么? 二氧化碳、二氧化硫、氨气溶于水都能导电,他们是电解质吗?Zx.xk 氯化氢和盐酸都叫电解质吗?
①电解质与非电解质都指化合物,单质及混合物既不是电解质也不是非电解质;②电解质与非电解质的本质区别是看化合物,自身在熔融或在水溶液中能否电离 ;例如: 氨气、二氧化碳、二氧化硫、三氧化硫虽然溶于水能导电,但不是自身电离产生的离子,因此是非电解质;硫酸钡 氯化银虽然难溶于水,但溶解的部分能电离产生离子,是电解质。
3、为什么电解质在水溶液中能导电?氯化钠溶液能导电,氯化钠的固体能否导电?为什么?如果加热到熔融状态呢?
电解质在溶于水或熔融状态下能够离解出可以自由移动的离子。
离子浓度越大,导电能力越____。
离子电荷数越高,导电能力越____。
1、电离:物质离解成自由移动离子的过程
表示电解质电离的式子叫电离方程式,简称电离式
如:NaCl = Na++Cl-
2、酸、碱、盐的定义(本质)
酸:凡电离时生成的阳离子全部 是H+的化合物。
碱:凡电离时生成的阴离子全部是OH-离子的化合物。
盐:凡电离时生成金属阳离子(或NH4+)和酸根阴离子的化合物。
1.下列物质中,能够导电的电解质是( )A.Cu丝 B.熔融的MgCl2 C.NaCl溶液 D.蔗糖2.下列物质中,不能电离出酸根离子的是( ) A.Na2S B.Ba(OH)2 C.KMnO4 D.KCl
强电解质:是指在水溶液中能完全电离的电解质,其特点是溶液中只存在电解质电离后产生的离子。在电离方程式中用“=”连接。如:HCl = H+ + Cl- NaOH = Na+ + OH-弱电解质:是指在水溶液中只有部分发生电离的电解质,其特点是溶液中既有电解质的分子,又有电解质的离子,在电离方程式中用“可逆号”表示。
如: NH3·H2O NH4+ + OH- CH3COOH CH3COO-+ H+
强电解质:强酸(如硫酸、盐酸、硝酸等)、强碱(如氢氧化钠、氢氧化钾等)以及绝大多数盐(包括难溶性的盐,如BaSO4)
弱电解质:弱酸、 弱碱以及水。
Ba(OH)2 、 Fe2(SO4)3、 H2SO4、 NaHSO4、 NH3·H2O、 CH3COOH、H2CO3
3、书写下列常见物质的电离方程式:
从电离的角度对化合物分类
非金属化合物,氨气,大多数有机物
4.下列各组化合物中,均为弱电解质的是( ),均为强电解质的是( )。A.H2CO3 Ba(OH)2 H2S H3PO4B.FeCl3 HCl C2H5OH(乙醇) NH4ClC.CH3COOH H2S NH3 •H2O H2OD.Na2SO4 H2SO4 HNO3 KNO3
5.某化合物易溶于水,但其水溶液不导电,则该化合物是( )。A.弱电解质 B.强电解质 C.非电解质 D.不能确定其类型
5.对电解质的叙述正确的是 ( ) A.溶于水后得到的溶液能导电的物质 B.熔融态能导电的物质 C.电解所得到的物质 D.在水溶液中或熔融状态下能导电的化合物6.下列物质属电解质的是: ; A.熔融的氯化钾 B.干冰 C.硫酸钡 D.酒精 E.铜片 F.硫酸铜溶液 G.硫酸 H.氢氧化钙
5.固体氯化钠中存在着钠离子(Na+)与氯离子(Cl-),为何固体氯化钠几乎不导电,而将其熔融或溶于水形成溶液就能导电,这是因为 。物质能导电,必须具有 ,金属能够导电是由于含有 ,电解质溶液导电是由于有 ,一般而言,温度对金属导体与电解质溶液导电能力的影响刚好相反,就此推知,温度越高,金属导体的导电能力 ,电解质溶液导电能力 。
钠离子、氯离子不能自由移动
相关课件
这是一份人教版 (新课标)必修1第二节 离子反应教学课件ppt,共60页。PPT课件主要包含了概念认知·自主学习,无明显实验现象,有白色沉淀,2离子反应,蓝色沉淀,红色消失,气泡产生,能力形成·合作探究,学情诊断·课堂检测等内容,欢迎下载使用。
这是一份人教版 (新课标)必修1第二节 离子反应多媒体教学课件ppt,共30页。PPT课件主要包含了离子方程式,以客观事实为依据,以质量守恒为依据,以电荷守恒为依据,铜片插入硝酸银溶液中,如氢氧化钡和稀硫酸,OH-+H+H2O,如碳酸钾和稀盐酸,离子共存问题等内容,欢迎下载使用。
这是一份人教版 (新课标)必修1第二节 离子反应多媒体教学ppt课件,共26页。PPT课件主要包含了电解质,混合物,纯净物,化合物,非电解质,既不是电解质,也不是非电解质,对电解质的理解,思考与交流,阳离子等内容,欢迎下载使用。










